亚低温对局灶性脑缺血大鼠模型C3表达的影响
2012-09-30张东亚杨苗苗杨改清毛兴爱
张东亚 杨苗苗 杨改清 毛兴爱
1)郑州市中心医院神经内科 郑州 450000 2)郑州市卫校内科学教研室 郑州 450000 3)新乡医学院第一附属医院神经内科 新乡 453100
缺血性脑血管病是目前严重威胁人类健康的疾病之一,是高致死率、高致残率疾病,且其发病率、患病率、死亡率呈上升趋势。其损伤机制的研究正逐步深入,多数研究表明,补体C3的活化和裂解后启动和放大了补体级联反应,其产生的系列补体活性成分参与了缺血性脑损害的病理生理过程,它们可直接和间接引起一系列中间炎症反应引起脑组织损伤[1]。补体C3在脑缺血的病理生理过程中起着关键作用。亚低温(32~35℃)对脑缺血的脑保护作用已得到大多数学者的认可,但目前尚未见有关亚低温与C3关系的报道。本研究通过建立大脑中动脉闭塞模型观察亚低温对局灶性脑缺血大鼠C3表达的影响。探讨亚低温对脑缺血的神经保护作用机制。为亚低温的临床应用提供新的实验依据。
1 材料与方法
1.1 实验动物及主要试剂 3月龄健康雄性Sprague-Dawley大鼠100只,体质量250~300g,新乡医学院实验动物中心提供。兔抗大鼠C3抗体,即用型SABC免疫组化染色试剂盒,DAB显色试剂盒,均由武汉博士德生物工程有限公司提供。
1.2动物实验分组及MCAO模型建立将大鼠随机分成3组:假手术组20只,常温组40只,亚低温组40只,各组又根据观察时间点分为5个亚组,即脑缺血6h、1d、2d、3d、7d五个亚组。假手术各亚组4只,亚低温和常温各亚组8只。采用Zea Longa法制作改进的大鼠大脑中动脉闭塞模型,模型成功的标志是大鼠清醒后出现左侧Horner征和右侧前肢为重的偏瘫。用电子温度计监测肛温,采用灯泡升温、冰袋降温的方法控制温度。常温组和假手术组:固定在常温操作台上6h,保持肛温(37℃±0.5℃)左右。亚低温组:(1)降温:线栓插入成功并固定后,迅速缝合切口,开始进行亚低温干预,将冰块置于大鼠的头部、颈部、肩部及躯干两侧,十分钟内使肛温降至(33℃±1℃),维持低温6h。(2)复温:撤去冰块,使体温自然恢复正常。测温完毕,动物苏醒后放归室温为25℃的动物房内单笼喂养,给予普通饮用水及食物。
1.3神经功能缺失评分采用神经缺陷评分(zealonga five point scale,ZFPS)进行神经功能评定:0分,无神经缺损症状;1分,不能伸展对侧前爪;2分,行走时向偏瘫侧转圈;3分,向偏瘫侧倾倒;4分,不能自发行走,意识丧失。1~3分纳入实验标准,0分或4分为排除标准。
1.4 标本采集、固定、HE染色及C3免疫组化染色 各时间点各组的每只大鼠用10%水合氯醛0.3mL/100g麻醉后,经左心室依次灌注生理盐水100mL,10%多聚甲醛溶液400mL进行前固定后,快速断头取出大脑,所有大鼠取脑后均观察颅底有无凝血块、颅底动脉环有无血栓形成,排除蛛网膜下腔出血和继发性血栓形成后,速用10%多聚甲醛溶液后固定24h。自视交叉前后2mm做冠状切片,制成4mm厚的脑片,梯度酒精脱水,二甲苯透明,石蜡包埋,用切片机做冠状切片,制成切片厚度3~5μm的脑组织切片。对切片进行HE染色及C3免疫组化染色,在光学显微镜下观察C3阳性细胞数目。每个标本在高倍光镜(200倍)随机观察额顶叶和纹状体内外侧不重叠的6个视野,计算各阳性细胞数。阳性结果为细胞胞浆被染成棕黄色颗粒状。
1.5统计学处理实验数据以均数±标准差(s)表示,应用SPSS 11.5统计软件进行统计分析,多组间均数的比较采用单因素方差分析(one way analysis of variance,One-way ANOVA),两两比较采用最小显著差(the least significant difference,LSD)t检验。以P<0.05为差异有统计学意义。
2 结果
2.1亚低温对脑缺血后大鼠神经功能的影响本实验中,假手术组大鼠未见神经功能缺损。常温组及亚低温组造模成功的大鼠均有不同程度的神经功能缺损,两组大鼠神经功能缺损均在3d时最明显,7d时均有所减轻。除6h外各时间点亚低温组大鼠神经功能缺损评分均较常温组低,差异具有统计学意义(P<0.05)。见表1。
表1 各时间点神经功能评分 (s)

表1 各时间点神经功能评分 (s)
注:▲与常温组相比差异无统计学意义,P>0.05,★与常温组相比差异有统计学意义,P<0.05,★★与常温组相比差异有统计学意义,P<0.01
时间假手术组 常温组 亚低温组n(只)评分(分)n(只)评分(分)n(只)评分(分)6h 4 0 7 1.29±0.488 7 1.14±0.378▲1d 4 0 6 2.17±0.408 6 1.50±0.548★2d 4 0 6 2.67±0.516 7 1.86±0.690★3d 4 0 6 2.83±0.408 7 2.14±0.378★★7d 4 0 6 2.33±0.516 6 1.33±0.516★★
2.2 亚低温对脑缺血后脑组织病理学改变的影响 (1)假手术组:神经元胞体丰满,胞核居中。毛细血管无充血扩张,血管周围间隙正常。(2)常温6h组:缺血中心区皱缩神经元明显增多并呈三角形,嗜酸性变。肿胀的胶质细胞增多,血管周围水肿和渗出加重,少量中性粒细胞浸润。(3)常温1d~常温3d组:缺血范围扩大。神经元数目明显减少,缺血区皱缩神经元随时间延长增多,细胞核浓染,固缩,消失,部分神经元胞浆淡染。可见胶质细胞增多,毛细血管充血扩张,细胞周围间隙增大。缺血灶周围可见较多中性粒细胞浸润,第3天最明显。(4)常温7d组:神经元胞浆嗜酸性,胞核深染,细胞间质疏松。胶质细胞增生明显,有胶质结节形成。少量中性粒细胞浸润,组织水肿不明显,坏死区与正常脑组织有清楚分界,周边部有散在神经元。(5)亚低温组:与常温组相比,皱缩神经元数目减少,胶质细胞肿胀较轻,血管周围水肿和渗出较轻。中性粒细胞浸润较少。
2.3 亚低温对脑缺血后C3表达的影响 阳性细胞可见于神经元,神经胶质细胞和血管内皮细胞。假手术组脑组织可见有少量C3表达。与假手术组相比,常温组和亚低温组各时间点大鼠缺血侧脑组织中均有大量C3表达,由于梗死灶内大量细胞坏死,阳性表达以梗死灶周边明显。假手术组脑组织各时间点少量C3表达之间的比较差异无统计学意义(P>0.05)。常温组和亚低温组缺血侧脑组织于缺血后6h补体C3阳性细胞数开始增加,至3d达到高峰,到7d时阳性细胞数明显减少。与常温组相比,亚低温组各时间点缺血侧脑组织补体C3表达明显减少,差异有统计学意义(P<0.01)。见表2。
表2 各时间点缺血侧脑组织补体C3表达细胞数 (s)

表2 各时间点缺血侧脑组织补体C3表达细胞数 (s)
注:#术后6h时3组比较差异有统计学意义,F=204.341,P=0.000,※术后1d时3组比较差异有统计学意义,F=471.402,P=0.000,◆术后2d时3组比较差异有统计学意义,F=963.136,P=0.000,□术后3d时3组比较差异有统计学意义,F=3032.097,P=0.000,▼术后7d时三组比较差异有统计学意义,F=302.424,P=0.000。●假手术组各时间点相比差异无统计学意义,F=0.093,P=0.985,★各时间点与假手术组相比差异有统计学意义,P<0.01,▲各时间点与常温组相比差异有统计学意义,P<0.01
时间 假手术组n(只)细胞数(个)常温组n(只)细胞数(个)亚低温组n(只)细胞数(个)6h 4 4.67±2.297#● 7 17.50±2.662#★ 7 15.48±2.616#★▲1d 4 4.88±2.112※● 6 23.89±2.447※★ 6 19.08±2.500※★▲2d 4 5.00±2.085◆● 6 34.17±2.646◆★ 7 25.50±2.770◆★▲3d 4 4.75±2.192□● 6 60.19±2.713□★ 7 36.36±2.945□★▲7d 4 4.71±2.255▼● 6 20.81±2.713▼★ 6 8.00±2.449▼★▲

图1 为常温6h组缺血侧脑组织补体C3的表达(SABC法×200)
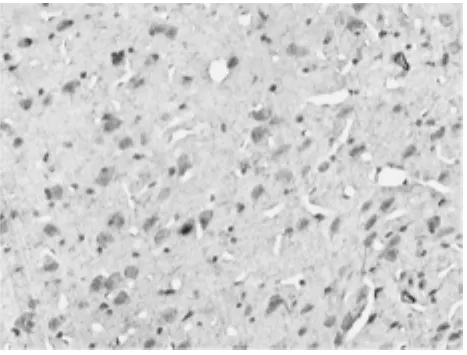
图2 为亚低温6h组缺血侧脑组织补体C3的表达(SABC法×200)

图3 为常温3d组缺血侧脑组织补体C3的表达(SABC法×200)

图4 为亚低温3d组缺血侧脑组织补体C3的表达(SABC法×200)

图5 为常温7d组缺血侧脑组织补体C3的表达(SABC法×200)
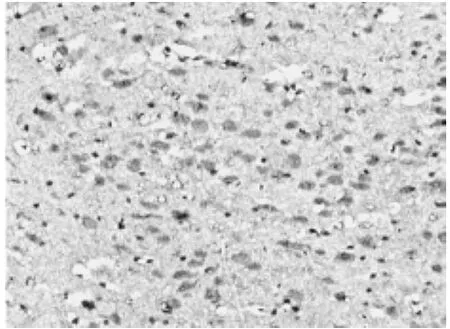
图6 为亚低温7d组缺血侧脑组织补体C3的表达(SABC法×200)
3 讨论
上世纪80年代,人们发现如果脑温低于正常值的(2℃~6℃),能够对缺血脑组织起到明显的保护作用,而且没有严重的并发症[2]。Reith[3]证实,亚低温能够降低死亡率改善病人的预后。Zausinger[4]研究显示:在脑缺血-再灌注24h,亚低温组大鼠脑梗死灶体积较常温组明显缩小,神经功能缺损程度也较常温组有明显改善,表明亚低温干预对脑缺血具有明显神经保护作用。本实验研究光镜下观察,与常温组相比,各时间点亚低温组大鼠缺血灶神经元死亡数目少,胶质细胞肿胀较轻,血管周围水肿和渗出较轻,中性粒细胞浸润相对轻。常温组和亚低温组大鼠神经功能缺损3d时最明显,7d时均有所减轻。除6h外各时间点亚低温组动物神经功能缺损评分均较常温组低,差异具有统计学意义(P<0.05)。这与以上的研究结果基本一致,提示亚低温能减轻脑缺血的病理损伤,减轻神经功能缺损,对局灶性脑缺血具有明显的脑保护作用。
关于亚低温脑保护作用机制方面的研究在许多方面已取得丰硕的研究成果,但目前尚未见有关亚低温与C3关系的报道。补体第三组分(C3)是补体系统的核心,它是1912年Ritg用蛇毒处理血清时发现的。在补体各成分中,C3血清含量最高;在功能上,C3亦居于中心地位,它既是几条激活途径的交汇,又是C3b依赖性阳性反馈环路的基础;同时,C3裂解片段及其结合蛋白复杂而多样。近年来,研究者发现补体系统参与缺血性脑血管疾病病理生理过程。梁丽贞等[5]实验证明脑缺血-再灌注后补体激活参与其损伤过程。Mocco等[6]发现C1q缺陷鼠,C3缺陷鼠和C5缺陷鼠在短暂的局部脑缺血时,仅C3缺陷鼠受到保护,C3缺陷鼠梗塞体积小,中性粒细胞浸润少,氧自由基生成少。Atkinson等[7]实验研究发现与野生小鼠相比,C3缺陷小鼠在脑缺血再灌注24h后存活率高,梗死面积小,并且没有测到有P选择素蛋白表达,白细胞浸润少,微血栓形成少,血流量大。以上研究均说明补体C3在脑缺血的病理生理过程中起着关键作用。本实验研究发现局灶性脑缺血大鼠病变侧脑组织神经元,神经胶质细胞和血管内皮细胞有C3表达,且在缺血后6 h补体C3阳性细胞数开始增加,至3d达到高峰,到7d时阳性细胞数明显减少。这与相关的研究结果基本一致[8],进一步证实了C3参与了缺血性脑损害的病理生理过程。
Cowell[9]发 现 用 眼 镜 蛇 毒 因 子 (cobra venom factor,CVF)去除补体,可以减轻新生鼠缺氧缺血性脑损伤的损伤体积,和损伤的神经元C3的沉积。刘立[10]等用CVF消耗大鼠体内补体后,脑缺血区域内中性粒细胞数减少,脑组织损伤程度减轻。Hua[11]等研究发现,肝素和N-乙酰肝素通过增强C1抑制剂(C1inhibitor,C1-INH)的活性和抑制C3转化酶的活性,阻止补体激活,亦具有与CVF类似的作用。以上研究表明,脑缺血时一些药物通过降低C3的表达起脑保护作用。本实验研究表明常温组和亚低温组于缺血后6h补体C3阳性细胞数均开始增加,至3d均达到高峰,到7d时C3阳性细胞数明显减少。与常温组相比,亚低温组各时间点缺血侧脑组织补体C3表达明显减少,差异具有统计学意义(P<0.05),这提示脑缺血后亚低温能明显下调C3的表达,亚低温可能通过降低C3的表达减轻补体级联反应起到脑保护作用。
[1]罗娜,白云,周静然,等 .小胶质细胞人补体攻膜复合物亚溶破模型制作及功能鉴定[J].第四军医大学学,2006,27(10):872-874.
[2]曹绪政,苏志强,徐建民,等 .局部亚低温对脑梗死大鼠的脑保护作用[J].中国临床康复,2005,9(13):208-209.
[3]Reith J,Jorgensen HS,Pedersen PM,et al.Body temperature in acute stroke:relation to stroke severity,infarct size,mortalityand outcome[J].Lancet,1996,347(8999):422-425.
[4]Zausinger S,Westermaier T,Plesnila N,et al.Neuroprotection in transient focal cerebral ischemia by combination drug therapy and mild hypothermia:comparison with customary therapeutic regimen[J].Stroke,2003,34(6):1 526-1 532.
[5]梁丽贞,李长清,吴春丽,等 .补体在大鼠脑缺血-再灌注损伤中的作用[J].中华急诊医学杂志,2005,14(3):219-221.
[6]Mocco J,Mack WJ,Ducruet AF,et al.Complement component C3mediates inflam-matory injury follo wing focal cerebral ischemia[J].Circ Res,2006,99(2):209-217.
[7]Atkinson C,Zhu H,Qiao F,et al.Complement-dependent P-selectin expression and injury following ischemic stroke[J].J Immunol,2006,177(10):7 266-7 274.
[8]许莉,张祥建,陈左然,等 .脑心通对大鼠局灶性脑缺血脑组织补体C3的影响[J].脑与神经疾病杂志,2005,13(2):107-110.
[9]Cowell RM,Plane JM,Silverstein FS.Complement activation contributes to hypoxic-ischemic brain injury in neonatal rats[J].J Neurosci,2003,23(28):9 459-9 468.
[10]刘立,王津存,张志均,等 .清除补体对大鼠局灶性脑缺血的作用[J].中国临床康复,2003,7(13):1 882-1 883
[11]Hua Y,Xi G,Keep RF,et al.Complement activation in the brain after experimental intracerebral hemorrhage[J].J Neurosurg,2000,92(6):1 016-1 022.
