TIA患者高敏C-反应蛋白水平与颈动脉粥样硬化的关系
2012-09-30孔祥锋欧阳颖
孔祥锋 欧阳颖
1)新疆医科大学第五附属医院神经内科 乌鲁木齐 830011 2)北京佑安医院干部病房 北京 100069
短暂性脑缺血发作(transient ischemic attack,TIA)是脑卒中的高危因子,TIA的发病多与动脉粥样硬化、动脉狭窄等病因有关[1]。动脉粥样硬化斑块的形成是一个炎症过程[2],炎症在动脉粥样硬化的发生、发展及其引起的并发症方面起重要作用,已有许多研究证明,血清炎性标志物对预测不稳定斑块破裂具有较高临床价值[3],如主要的炎症因子高敏 C-反 应 蛋 白 (high sensitivity creactive protein ,hs-CRP)。本研究对62例短暂性脑缺血发作患者血清高敏C-反应蛋白与颈动脉粥样硬化的关系进行探讨和分析。
1 对象和方法
1.1研究对象短暂性脑缺血发作组:为2009-09—2010-12在本院神经内科住院的短暂性脑缺血发作患者62例,男43例,女19例,年龄51~77岁,平均(61.4±8.98)岁,均符合全国第4届脑血管病学术会议修订的诊断标准[4],且必须符合以下条件:发病24h内入院;经头颅MRI检查未见责任灶,同时排除脑出血、急性脑梗死、蛛网膜下腔出血等。对照组:30例,为同期体检健康者,男21例,女9例,年龄49~78岁,平均(61.8±9.29)岁。TIA组与对照者年龄、性别相匹配,差异均无统计学意义(P>0.05)。
1.2排除标准急、慢性感染,有明显的心、肝、肾功能异常,恶性肿瘤、自身免疫性疾病、手术外伤史,近期服用糖皮质激素或免疫抑制剂者。
1.3方法
1.3.1 颈动脉超声检查:应用GE公司VIVID-7型彩色多普勒超声诊断仪,7.5~10.0MHz浅表探头,有超声科医师专人操作,对所有研究对象进行检查。检查内容包括血管解剖形态、内膜情况、有无斑块、斑块回声性质及大小、管腔是否狭窄及狭窄程度。根据动脉粥样硬化的不同二维超声表现将斑块分型:I型:脂质型斑块,为超声显示均匀的低回声内膜增厚;Ⅱa型:纤维脂质型斑块.为超声显示表面有连续轮廓的回声较强的纤维帽,斑块内部脂质沉积有明显的低回声区,如伴有斑块内出血则表现为无回声区;Ⅱb型:纤维型斑块,超声显示局部较均匀的强回声,斑块表面有连续的回声轮廓;Ⅲ型:钙化型斑块.为斑块内纤维化、钙化,局部回声增强,后方伴声影或有明显的声衰减;Ⅳ型:溃疡型斑块,为斑块表面不规则,有时呈“穴状”或“壁龛”样影像,溃疡边缘回声低。I、Ⅱb、Ⅲ型属于稳定性斑块,Ⅱa、Ⅳ为不稳定性斑块。
1.3.2 hs-CRP测定:采用乳胶增强免疫比浊法测定患者血清hs-CRP。所有被检查者清晨空腹,脑梗死组于住院次日清晨空腹,取静脉血3mL,注入含有促凝剂的试管中,室温下静置0.5~1h后离心分离出血清,试剂盒购于北京华夏科海试剂公司。
1.4统计学处理应用SPSS 17.0统计软件,对所有计量资料进行正态性检验和方差齐性检验。两组间计量资料均数间的比较采用两独立样本t检验。设α=0.05为检验水准,以P<0.05为差异具有统计学意义。
2 结果
2.1 TIA组与对照组血清hs-CRP水平比较TIA组血清hs-CRP水平显著高于对照组,P<0.01,见表1。
2.2颈动脉超声检查结果TIA组62例患者中发现颈动脉斑块42例,颈动脉粥样斑块发生率为67.7%。其中42例颈动脉粥样斑块患者中I型(脂质型斑块)4例(9.5%);Ⅱa型(纤维脂质型斑块)9例(21.4%);Ⅱb型(纤维型斑块)12例(28.6%);Ⅲ型(钙化型斑块)11例(26.2%);Ⅳ型(溃疡型斑块)6例(14.3%),纤维型斑块所占比例最高,脂质型斑块最低。TIA组稳定性斑块组27例(64.3%),不稳定性斑块组15例(35.7%)。
2.3 hs-CRP颈动脉粥样斑块性质的关系TIA组中,不稳定粥样斑块组血清hs-CRP水平为(3.5±1.35)mmol/L显著高于稳定粥样斑块组(2.37±0.75)mmol/L,P<0.01。
3 讨论
颈动脉粥样硬化(carotid artery atherosclerosis,CAA)是脑血管病的危险因素之一[5],在CAA的基础上,斑块突然破损、血小板激活、血栓形成是脑梗死的重要发病机制之一。大量研究显示对动脉粥样硬化的关注点从狭窄的程度转移到斑块的生物学特性上。不稳定性斑块是脂质为主的软斑块,纤维帽薄,斑块表面有溃疡或有炎性反应,斑块内出血,软斑和溃疡斑块易脱落,造成动脉-动脉栓塞,血栓反复脱落形成多个栓子而栓塞多出血管。
动脉粥样硬化斑块的形成是一个炎症过程[2],已有许多研究表明[6]血清炎性标志物对预测不稳定斑块破裂具有较高临床价值,主要炎性因子如高敏-C反应蛋白、金属蛋白酶(MMP-9)、黏附因子等可反映斑块稳定程度的炎症标志物。C-反应蛋白是一种敏感性较高但特异性较差的炎症反应标志物,目前已被证实参与动脉粥样硬化形成的各个阶段。与其他炎症标志物相比,血清C反应蛋白测定技术敏感性较高,甚至C反应蛋白水平轻度升高也可反应亚临床炎症反应状态[7]。
目前hs-CRP水平与缺血性脑卒中预后相关性的研究较多,结果显示hs-CRP与梗死部位、危险因素、病情严重程度及预后等均相关[8-9]。Purroy等[10]对135例 TIA 患者血清hs-CRP,以再发卒中或任意新发的血管事件为终点事件随访一年,结果显示hs-CRP>4.1mg/L是任意血管事件的独立预测因素,血清hs-CRP水平可以预测TIA后缺血事件的发生。
本组资料显示,TIA患者的血清hs-CRP水平明显高于对照组(P<0.01),TIA患者中,颈动脉粥样硬化斑块发生率为67.7%,其中纤维型斑块所占比例最高(28.6%),脂质型斑块最低(9.5%);不稳定性斑块组占35.7%,不稳定斑块组血清hs-CRP水平显著高于稳定斑块组(P<0.01)。
综上所述,TIA患者中不稳定斑块组血清hs-CRP水平明显高于稳定斑块组,因此,血清hs-CRP水平升高对TIA患者颈动脉粥样硬化不稳定斑块有显著临床意义,早期测定hs-CRP水平有助于评估TIA患者的卒中风险,更好的指导临床治疗。
表1 TIA组与对照组hs-CRP含量比较 (s,mmol/L)
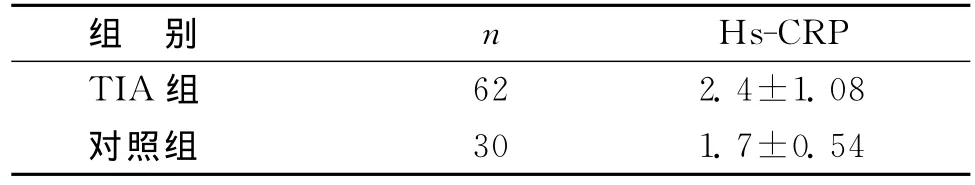
表1 TIA组与对照组hs-CRP含量比较 (s,mmol/L)
注:血清hs-CRP水平,TIA组与对照组相比,t=2.77,P=0.007
组 别 n Hs-CRP TIA组62 2.4±1.08对照组30 1.7±0.54
[1]贾建平 .神经病学[M].北京:人民卫生出版社,2010:173-175.
[2]Libby P.Inflammation in atherosclerosis[J].Nature,2002,420:868-874.
[3]Packard RR,Libby P.Inflammation in atherosclerosis:from vascular biology to biomarker discovery and risk prediction[J].Clin Chem,2008,54:24-28.
[4]中华医学会全国第四届脑血管疾病学术会议 .各类脑血管疾病诊断要点[J].中华神经精神科杂志,1996,12(6):379-380.
[5]Linfante I,Andreone V,Akkawi N,et al.Internal carotid artery steeting in patients over 80year of age:single center experience and review of the literature[J].J Neuroimaging,2009,19:158-163.
[6]Packard RR,Libby P.Inflammation in atherosclerosis:from vascular biology to biomarker discovery and risk prediction[J].Clin Chem,2008,54:24-38.
[7]Masotti L,Ceccarelli E,Forconi S,et al.Prognostic role of C-reactive protein in very old patients with acute ischaemic stroke[J].J Intern Med,2005,258:145-152.
[8]Yoon SR,Bang OY,Hong JM,et al.Non-conventional risk factors were associated with infarct patterns in ischemic stroke[J].Clin Neurol Neurosurg,2009,111:134-139.
[9]黄仙娥 .超敏C反应蛋白在急性脑梗塞早期预测中的临床意义[J].实验与检验医学,2008,26:202.
[10]Purroy F,Montaner J,Molina CA,et al.C-reactive protein predicts further ischemic events in transient ischemic attack patients[J].Acta Neurol Scand,2007,115:60-66.
