拟诊单纯疱疹病毒性脑炎患者海马萎缩与记忆障碍的研究☆
2012-09-14陆芳朱希郑金瓯
陆芳 朱希 郑金瓯
单纯疱疹病毒性脑炎(herpes simplex virus en cephalitis,HSE),作为一种急性中枢神经系统感染性疾病,其病死率高达 50%~70%[1],存活者致残率亦高(约50%)。既往研究表明HSE患者常有认知功能损害,记忆功能的损害尤其突出[2]。目前对其他疾病导致的认知障碍的研究不少,但对HSE患者的神经影像学与认知功能的关系的研究国外报道不多[3],国内前瞻性病例的研究亦甚少报道。本文就拟诊单纯疱疹病毒性脑炎进行普通磁共振成像与认知功能评估,探讨他们之间的关系。
1 对象与方法
1.1 研究对象 2008年1月至2010年3月在广西医科大学第一附属医院神经内科住院的患者中序贯入组符合下述标准的患者10例(发病年龄17~65岁),另于社区中选取年龄和教育程度大致匹配的8名健康对照者(年龄19~50岁)。根据Kennedy[4]、王维治等[5]观 点 的 诊 断 标 准 入 选 病 例组。拟诊HSE患者的入选标准:①患者的病史(起病急、病情重、发热等感染征象,特别是口唇或生殖道疱疹史);②以意识障碍、精神行为异常和癫痫为主的脑实质损害表现,早期出现局灶神经系统损害体征;③脑脊液(CSF)常规检查符合病毒感染特点;④脑电图(EEG)提示以额颞区为主的弥漫性异常;⑤头颅MRI发现颞叶病灶,如有出血性脑软化灶则更支持;⑥特异性抗病毒药物治疗有效;⑦无其他颅内病变依据。对照组选入标准:①性别、年龄和教育程度与患者匹配;②无药物滥用史或影响记忆力的病史;③无脑炎病史及神经系统检查无定位体征、无严重躯体疾病能完成MRI检查,且常规MRI无特殊发现。病例组和对照组均签署知情同意书。
1.2 神经影像学检查 使用Philips公司Achieva3.0 T MRI仪对所有入选者行头颅MRI和海马像扫描,扫描参数如下:T1加权:TR=2000,TE=10 ms,层厚 =4 mm,间距 =2 cm,FOV=24×24 cm 2NEX。 T2加权:TR = 3000,TE = 80 ms,层厚 =4 mm,间距 =2 cm,FOV=24×24 cm 2NEX。FLAIR 成像:TR =11000,TE=120 ms,层厚 =4 mm,间距 =2 cm,FOV=24×24 cm,并对 10例拟诊HSE患者进行临床随访,分别于发病后3个月和6个月再次进行普通头颅MRI和海马像扫描,参考Scheltens等[6]方法,用双人盲法目测法评估左右两侧DHA,分值越高萎缩越明显。
1.3 认知功能测评 全部患者于发病2周内进行首次修订WMS测评,并对临床随访的10例患者分别于发病后3个月及6个月再次行修订WMS测评,内容包括①长时记忆测验:经历,定向,从1顺数至100、从100倒数至1、累积;②短时记忆测验:再认、图片、再生、联想、触摸、理解;③瞬时记忆测验:顺背和倒背数字。
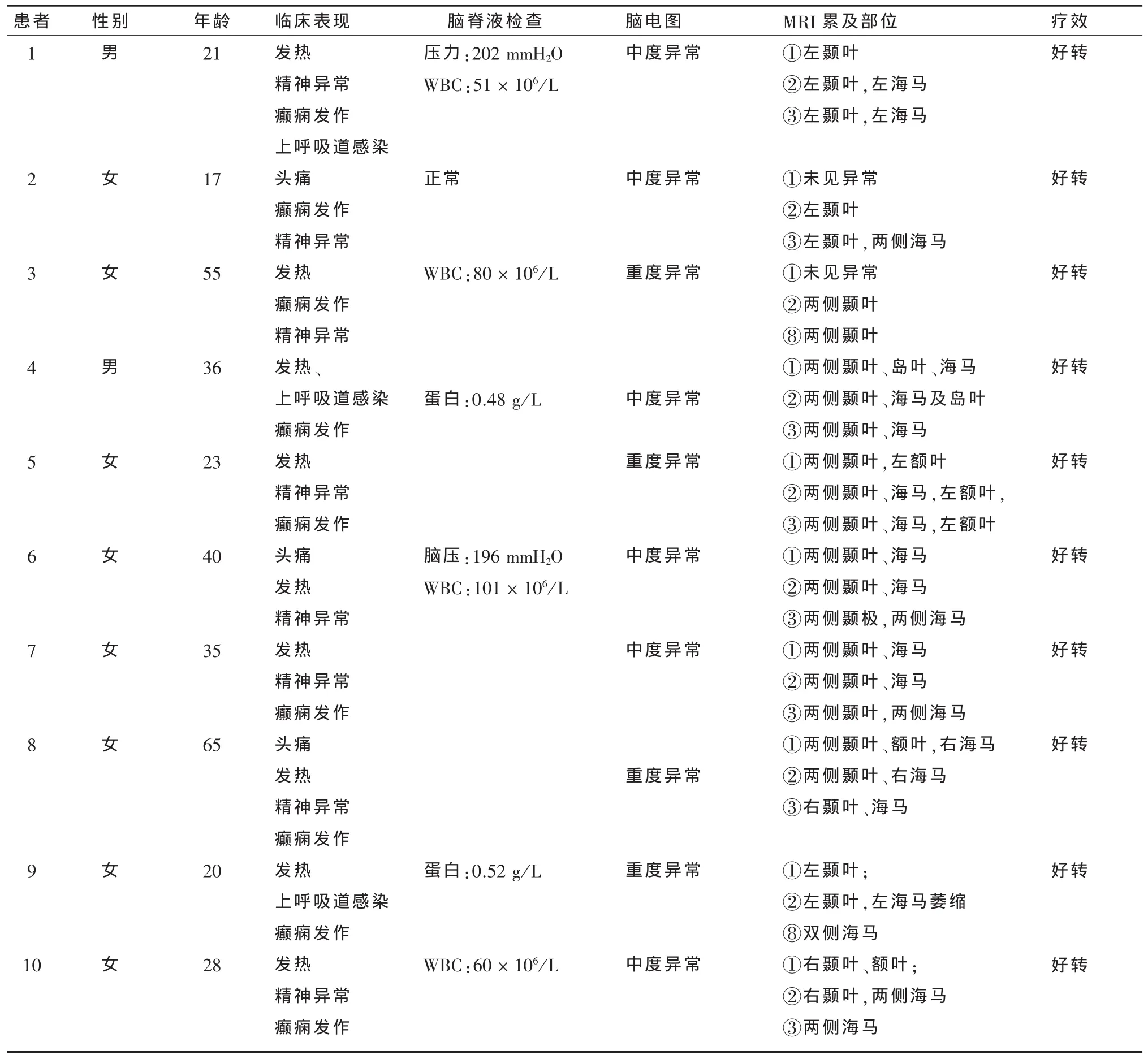
表1 患者组的一般资料
1.4 相关性分析评估 分别对拟诊HSE患者发病后3个月和6个月左右两侧DHA分值与韦氏记忆量表各分值进行相关性分析。
1.5 统计学方法 采用SPSS 13.0进行数据处理,性别比较采用Pearson卡方检验,拟诊HSE患者组与健康对照组数据比较采用非参数检验,拟诊HSE患者发病后3个月和6个月韦氏记忆量表各分值比较采用秩和检验,相关性分析采用一元回归法,检验水准α=0.05。
2 结果
2.1 一般资料 患者组的一般资料见(表1),拟诊HSE患者组与对照组间的年龄(34±15.8 vs.32.1± 10.9)岁、性别(χ2= 0.68,P = 0.41)和受教育程度(11.4± 3.9 vs.11.75± 3.7)年,差异无统计学意义(P >0.05)。
2.2 随访MR结果 拟诊HSE患者发病后1周内检查异常者8例,3周内10例均可见异常,表现为额、颞叶长T1WI、长T2WI信号和FLAIR呈较高信号,随时间的推移,病灶部分吸收、软化及变性,还显示邻近脑组织的萎缩改变,表现为普遍性脑沟增宽和脑室扩大(影像学表现见图1);海马的脉络膜裂及颞角宽度增加、海马结构高度减少,其DHA评分结果见表2。本研究中DHA分值增加以前3个月明显,随后分值仍有增加但变化不大,提示海马萎缩常发生在病后1~3个月内,半年内有加重趋势,但萎缩进展缓慢。

图1 一例患者在不同时间的头颅MRI表现

表2 拟诊HSE患者海马萎缩程度目测评分资料(分)
第7号患者发病14 d时头颅MRI(图1-A1、B1、C1、D1)见右侧颞叶、左侧颞极、两侧海马、两侧岛叶及两侧直回、眶回、扣带回见片状稍长T1、长T2信号灶,FLAIR呈高信号,病灶所在脑沟变浅、脑回稍肿胀;发病第 3个月时(图 1-A2、B2、C2、D2)两侧大脑额叶、颞叶、岛叶可见片状稍长T1、稍长T2信号影,边界不清,FLAIR呈稍高信号影,以右侧为甚;发病第 6个月时(图 1-A3、B3、C3、D3)右侧颞叶、左侧颞极、两侧海马、两侧岛叶及两侧直回、眶回、扣带回见片状长及稍长T1、长T2信号灶,FLAIR双颞叶病灶部分呈低信号,余病灶呈高信号,病灶所在脑沟变浅、脑回稍肿胀,与第14 d片比较,所见病灶范围较前明显扩大,两颞极脑软化灶形成。
比较首次检查与第3个月时的海马左侧(0.30± 0.48 vs.1.90 ± 1.10)及右侧(0.70 ± 0.67 vs.1.90± 1.66)的 DHA 分值,P < 0.05,差异有统计学意义.比较第3个月与第6个月时的海马左侧(1.90±1.10 vs.2.60 ± 1.17)及右侧(1.90 ± 1.66 vs.2.50± 1.77),P > 0.05,差异无统计学意义。
2.3 HSE的认知功能改变 拟诊HSE患者组的首次记忆商(MQ)分值显著低于健康对照组(56.3± 15.2 vs.109.8 ± 13.5),差异有统计学意义(P <0.01)。 发病第 3 个月时与对照组相比,经历(2.7 ±1.2 vs.4.3 ± 0.5,P < 0.05)、定向(3.1 ± 1.6 vs.4.9± 0.4,P < 0.05)、100 → 1(73.5 ± 68.7 vs.177.9 ±16.1,P < 0.01)、累积(51.5 ± 27.4 vs.87.3 ± 8.4,P < 0.05)、图片(9.3 ± 3.8 vs.13.1 ± 1.1,P < 0.01)、再生(4.3 ± 3.6 vs.10.9 ± 0.6,P < 0.01)、联想(10.6± 5.8 vs.17.4 ± 2.4,P < 0.05)、触觉(27.1 ± 19.3 vs. 212.3 ± 50.2,P < 0.01)、 理解(7.5 ± 2.2 vs.17.5 ± 1.1,P < 0.01)和背数(8.4 ± 2.1 vs.13.1 ±1.4,P < 0.01)均降低,差异有统计学意义。 发病第6 个月时定向(3.0 ± 1.6 vs.4.8 ± 0.7,P < 0.05)、联 想(10.3 ± 5.5 vs.14.6 ± 5.2,P < 0.05)、触 觉(27.1 ± 19.5 vs.79.3 ± 38.3,P < 0.01)、理解(7.8 ±2.4 vs.13.6 ± 4.6,P < 0.05)、背数(8.5 ± 2.2 vs.11.4 ± 2.2,P < 0.01) 和记忆商(Memory Quotient,MQ,63.5 ± 9.6 vs.85.4 ± 17.6,P < 0.05)均较第 3个月时提高,差异有统计学意义。
2.4 认知功能与DHA分值的相关性 相关性分析发现,3个月组拟诊HSE患者MQ与左侧DHA分值(r= -0.839)、右侧 DHA 分值(r= -0.836)均呈负相关(P<0.05);6个月组拟诊HSE患者MQ与左侧的 DHA 分值(r= -0.767)、右侧的 DHA 分值(r= -0.540)均呈负相关(P > 0.05);但无统计学意义。
3 讨论
3.1 拟诊单纯疱疹病毒性脑炎的头颅磁共振成像我们的研究发现,8例患者在发病1周内MR表现为额、颞叶长T1WI、长T2WI信号和FLAIR呈较高信号,2例患者未见明显病灶,而随后行头颅MRI检查后发现这些患者均出现了不同程度的额、颞叶长T1WI、长T2WI信号和FLAIR呈较高信号,随着时间推移,上述部位出现不同程度的萎缩,我们认为可能与检查时间有关,选择复查MR可以有效提高诊断阳性率,这与Cinque等[7]的研究结果一致。有研究表明,HSE患者随着临床症状的好转和脑脊液检查的正常,头颅MRI影像反而出现额、颞叶明显萎缩,这不一定是疾病复发,可能与免疫机制调节有关[8],我们的研究也支持这一观点。当头颅MRI和临床症状不一致的时候,需综合考虑各项影响因素,对病情做出合理的判断。
3.2 记忆障碍与海马萎缩的关系 记忆力下降和其他认知功能减退是HSE患者最常见的后遗症。HSE患者的韦氏记忆量表各分值(除1至100和再认)均低于健康对照者,其中与短时记忆和瞬时记忆的相关内容:再生、图片、联想、触觉、理解和背数显著降低,说明存在记忆力减退,尤以瞬时记忆力及短时记忆力受损明显,与文献报道相符。临床随访发现,第6个月时HSE患者的记忆商较第3个月时提高,提示HSE患者在3~6个月这段时间脑功能有较明显修复,起到较明显代偿作用。
随着神经影像学的发展,特别是MRI技术的应用使研究者可以无创性研究海马的形态结构、海马萎缩[9]和T2WI信号改变等,从不同的角度研究和阐述海马与认知功能障碍的关系。海马结构与认知及记忆水平之间存在着密切联系,Mungas等[10]研究表明,海马体积甚至是决定轻度认知功能障碍患者记忆力下降的最重要的因素。我们的研究亦发现海马萎缩或硬化可能是导致记忆损害的原因[11],但 HSE后海马动态萎缩过程和认知障碍之间的内在相关性目前还不十分清楚。Reminger SL[12]等对颞叶癫痫患者的研究发现双侧海马体积是言语记忆功能最好的预测因素。我们的研究发现,HSE后海马萎缩在患病后前3个月时明显,半年内仍有加重趋势,但后3个月海马萎缩进展缓慢,而记忆力在后3个月内是有一定程度改善的。同时,我们发现在HSE发病后前3个月时左右两侧海马萎缩分值与认知指数的负相关性,表明在3个月内海马萎缩明显则认知功能损害严重,提示HSE后海马体积的缩小有可能损伤了认知功能产生的关键环节。Tom den Heijer等[10]通过对518例老年人跟踪观察10年后的队列研究发现,在MRI上海马体积下降是发展为痴呆和认知减退的一个危险因素,这提示海马体积下降对认知可造成影响。但本研究在HSE后第6月随访时间点未发现左右两侧海马萎缩分值与认知指数的相关性,其原因可能是①由于样本量偏少,被试的年龄分布跨度大,从17岁一直到65岁,这就很难排除生长和成熟因素对实验的影响;②HSE患者的记忆功能除了颞叶、海马,或许还与其他脑组织结构密切相关,即海马萎缩并不是决定HSE患者记忆障碍的唯一主要因素[13]。大量神经心理学研究亦发现人类大脑中存在多种形式的记忆,即存在多重记忆系统[14]。根据这一理论,记忆是由依赖于不同的脑机制的几个不同的记忆系统协同完成的,所有的脑结构都与记忆有关。③大脑的本身存在代偿机制。大脑是个很复杂的体系,脑功能之间、脑皮质以及皮质下纤维之间有广泛的联系,当某一脑区受损后,脑可以出现功能及结构重组以适应其变化。因此,目前对HSE患者认知障碍的相关性尚需长期大量研究来不断完善和证实。
我们的研究表明:①拟诊HSE早期常规MRI大多数患者有颞、额叶的皮质和皮质下白质肿胀及T2WI、FLAIR高信号的表现;②随访发现拟诊HSE患者海马萎缩以发病后3个月明显,半年内仍有加重趋势,但损害的发展有所减轻;拟诊HSE患者以短期记忆力受损为主,发病后半年左右智能和记忆力有一定程度的改善;③左右两侧海马萎缩程度与认知障碍在第3个月时关系密彻,第6个月时无明显相关性,可能提示大脑的代偿功能。
[1]Whitley RJ,Gnann JW.Viral encephalitis: familiar infections and emerging pathogens[J].Lancet,2002,359(2):507-513.
[2]Hokkanen L,Poutiainen E,Valanne L,et al.Cognitive impairment after acute encephalitis:comparison of herpes simplex and other aetiologies[J].J Neurol Neurosurg Psychiatry,1996,61(5):478-484.
[3]Hahn K,Schildmann EK,Baumeister C,et al.Cognitive Impairment After Acute Encephalitis: An ERP Study[J].Int J Neurosci,2012,Early Online(1-7).
[4]Kennedy PG.Viral encephalitis: causes,differential diagnosis,and management[J].J Neurol Neurosurg Psychiatry 2004;75(Suppl):10-15.
[5]王维治.神经病学[M].北京:人民卫生出版社,2006:235-236
[6]Scheltens P,Leys D,Barkhof F,et al.Atrophy of medial temporal lobes on MRI in "probable" Alzheimer's disease and normal ageing: diagnostic value and neuropsychological correlates[J].J Neurol Neurosurg Psychiatry,1992,55(10):967-972.
[7]Cinque P,Cleator GM,Weber T,et al.The role of laboratory investigation in the diagnosis and management of patients with suspected herpes simplex encephalitis:a consensus report.The EU Concerted Action on Virus Meningitis and Encephalitis[J].J Neurol Neurosurg Psychiatry,1996,61(4):339-345.
[8]Markoula S,Giannopoulos S,Pelidou SH,et al.MRI deterioration in herpes simplex encephalitis despite clinical recovery[J].Neurologist,2009,15(4):223-226.
[9]Mehrabian S,Raycheva M,Traykova M,et al.Neurosyphilis with dementia and bilateral hippocampal atrophy on brain magnetic resonance imaging[J].BMC Neurol,2012,12(1):96.
[10]den Heijer T,van der Lijn F,Koudstaal PJ,et al.A 10-year follow-up of hippocampal volume on magnetic resonance imaging in early dementia and cognitive decline[J].Brain,2010,133(10):1163-1172.
[11]李丽萍,郑金瓯,余璐,等.颞叶癫痫患者磁共振弥散张量成像及记忆损害的研究[J].中风与神经疾病杂志,2012,29(1):13-16.
[12]Reminger SL,Kaszniak AW,Labiner DM,et al.Bilateral hippocampal volume predicts verbal memory function in temporal lobe epilepsy[J].Epilepsy & Behavior,2004,5(5):687-695.
[13]Jokinen P,Bruck A,Aalto S,et al.Impaired cognitive performance in Parkinson's disease is related to caudate dopaminergic hypofunction and hippocampal atrophy[J].Parkinsonism Relat Disord,2009,15(2):88-93.
[14]Eichenbaum H.Hippocampus:cognitive processes and neural representations that underlie declarative memory[J].Neuron,2004,44(1):109-120.
