胞外唾液酸酶造成工程中国仓鼠卵巢细胞株所产人源重组促红素唾液酸含量降低
2012-09-03刘颖慰周祥山刘海峰宋志伟张元兴
刘颖慰,周祥山,刘海峰,3,宋志伟,张元兴
1 华东理工大学生物反应器工程国家重点实验室,上海 2002372 新加坡科技研究局生物过程技术研究所,新加坡 1386683 山东阿华生物药业有限公司,山东 东阿 252201
胞外唾液酸酶造成工程中国仓鼠卵巢细胞株所产人源重组促红素唾液酸含量降低
刘颖慰1,周祥山1,刘海峰1,3,宋志伟2,张元兴1
1 华东理工大学生物反应器工程国家重点实验室,上海 200237
2 新加坡科技研究局生物过程技术研究所,新加坡 138668
3 山东阿华生物药业有限公司,山东 东阿 252201
刘颖慰, 周祥山, 刘海峰, 等. 胞外唾液酸酶造成工程中国仓鼠卵巢细胞株所产人源重组促红素唾液酸含量降低. 生物工程学报, 2012, 28(12): 1492−1499.
Liu YW, Zhou XS, Liu HF, et al. Extracellular sialidase degrades sialic acid in recombinant human erythropoietin produced by an industrial Chinese hamster ovary cell strain. Chin J Biotech, 2012, 28(12): 1492−1499.
为了对工程中国仓鼠卵巢 (CHO) 细胞所产人源重组促红素 (rhEPO) 的N-糖基化特点进行考察,静置培养工程细胞后,通过等电聚焦和凝集素共沉淀对培养上清中的 rhEPO进行分析,并对无血清培养上清中乳酸脱氢酶 (LDH) 和唾液酸酶活性进行检测,发现这株CHO细胞可以表达唾液酸含量较高的rhEPO蛋白。但是随着培养时间的延长,细胞的存活率逐渐降低,死亡的细胞将胞内的唾液酸酶释放到胞外,唾液酸酶的降解作用会造成N-糖链分枝末端的唾液酸占有率降低,导致rhEPO蛋白糖基化形态的变化。所使用的方法及得到的结果为进一步对工业过程进行分析提供了参考。
中国仓鼠卵巢细胞株,人源重组促红素,N-糖基化,细胞活性,唾液酸酶
重组人促血红细胞生成素 (Recombinant human erythropoietin, rhEPO) 被用来治疗贫血,2009年在美国的销售额是63亿美元[1]。唾液酸可以保护 rhEPO不被生物体肝脏内的无唾液酸糖蛋白受体清除,所以经皮下注射,唾液酸化的rhEPO的体内半衰期是 5.6 h,没有唾液酸化的rhEPO在体内的半衰期是1.4 min[2]。
山东阿华生物药业有限公司在固定床灌注培养模式下培养CHO细胞株生产rhEPO,最高可以获得20 000 IU/mL的表达量,但是在生产过程中,该细胞株表达的rhEPO蛋白中至少有70%是唾液酸含量不足的,会在后期的纯化过程中被去除[3]。这会增加相同市场需要条件下的生产批次,增加成本,因此,通过优化来提高高唾液酸丰度的rhEPO在细胞所生产蛋白中的比例,是一项十分紧迫的任务。
生产过程中,表达系统的修饰作用是糖基化形成的生物学基础,不同的表达系统对同一产品的糖基化修饰存在差异[4-5]。因此我们首先对生产使用的CHO细胞株的N-糖基化特点进行考察。
在固定床反应器中,CHO细胞贴附在载片上,使用有血清培养基培养细胞达到较高的密度后,清洗培养体系,直接更换为无血清培养条件来生产重组蛋白,细胞表达的rhEPO产品被分泌到胞外的培养上清中,整个生产过程中细胞无法被采样,所以文中主要以培养该株CHO细胞所获得的培养上清为研究对象。
很多方法被用来分析糖蛋白的唾液酸化程度[6]。Lim 等[7]使用等电聚焦结合转膜印迹的方法对培养上清中的 rhEPO蛋白的唾液酸化程度进行检测,这个方法不需要纯化蛋白,对样品进行脱盐处理即可。文中使用肽 N-糖苷酶 F(PNGase F) 酶切除不同培养时期收获的 rhEPO的N-糖链后进行等电聚焦,考察该株细胞所产的rhEPO的肽链结构、O-糖链形态等是否会随培养时间的延长而发生改变。
蓖麻凝集素I (Ricinus communisagglutinin I,RCA-I) 是从蓖麻种子中分离得到的一种凝集素,这种凝集素可以特异性与寡糖链上的半乳糖或N-乙酰乳糖氨结合,但是当糖链末端的半乳糖与唾液酸结合,唾液酸会阻断该种凝集素与半乳糖的结合。因此可以通过 RCA-I与蛋白共沉淀的方法定性检测糖蛋白N-糖链末端的唾液酸占有率[8]。
当细胞活性降低,细胞膜严整性降低,胞内的乳酸脱氢酶 (Lactate dehydrogenase, LDH) 会进入胞外环境中,文中通过检测培养上清中的LDH活性来作为培养液中细胞的活性的指示[9]。同时,胞外的重组蛋白会被死亡细胞释放的唾液酸酶 (Sialidase) 去唾液酸化[10]。RNAi研究[11-12]显示,抑制CHO细胞唾液酸酶的表达可以在一定程度上提高蛋白产品的唾液酸含量。因此,文中对培养过程中胞外唾液酸酶活性的变化及其对CHO细胞所产rhEPO的唾液酸含量的影响进行考察。
通过上述的研究,我们尝试对该株工程CHO细胞在培养过程中不同阶段收获的 rhEPO的糖基化特点及影响因素进行阐释。
1 材料与方法
1.1 材料
1.1.1 细胞株及培养基
实验使用生产rhEPO的工程CHO细胞株,由山东阿华生物药业有限公司提供。DMEM 培养基、F12培养基、CHO-S-SFMⅡ培养基和新生牛血清 (NBCS) 均购自美国Gibco公司。
1.1.2 主要试剂
本实验使用的常规化学试剂主要购自中国医药集团上海化学试剂公司,均为分析纯级。两性电解质 (Pharmalyte pH 3.0~10)、样品缓冲液(IPG buffer)、凝胶支持膜 (Gel Bond PAG film)均购自美国GE Healthcare公司;固相pH梯度介质 (pI select)、四甲基伞形酮标准品 (4MU) 购自美国Sigma公司;α-2,3唾液酸酶 (P0728S)、PNGase F酶 (P0704S) 购自美国 NEB公司;Ricinus communisagglutinin-I (RCA-I) 凝集素购自美国Vector Labs公司;兔抗人促红细胞生成素多抗 (AB-286-NA) 购自美国 R&D公司;辣根过氧化物酶 (HRP) 标记山羊抗兔 IgG(ZB-2301) 由北京中杉金桥公司进口分装;Bradford法检测蛋白总量试剂盒购自中国天根公司;LDH检测试剂盒购自南京建成生物研究所;四甲基伞形酮唾液酸 (4MU-Neu5Ac) 购自上海百灵威公司。
1.2 方法
1.2.1 CHO细胞的静置培养
在T-175方瓶内接种CHO细胞,接种密度约为 5×104cells/mL,生长阶段使用添加 10%NBCS的DMEM/F12培养基将CHO细胞培养至约100%融合,使用无菌PBS冲洗2次后,更换为生产用高糖无血清培养基 CHO-S-SFMⅡ,培养基中添加0.5 mmol/L正丁酸钠,设置2个重复,每隔3 d收集培养上清,更换新鲜培养基,无血清培养至第9天结束。
1.2.2 CHO细胞在生产阶段的生长动力学
参照文献[13],在24孔板内接种CHO细胞,接种密度及培养方式与方瓶中相同,每天台盼蓝染色后使用血球计数板计数平行 3孔的活细胞数,绘制细胞在无血清生产阶段的生长曲线。
1.2.3 超滤培养上清及PNGase F酶消化
取1 mL培养上清,12 000 r/min离心5 min,去除细胞碎片,倒入4 mL (10 kDa) 规格的超滤离心管 (Millipore,USA),再加入20 mmol/L 磷酸缓冲液 (pH 7) 至满,离心至剩下0.2~0.5 mL,离心条件为5 000× g (g为重力加速度),10 min,再加入20 mmol/L 磷酸缓冲液 (pH 7) 至满,离心至剩下0.2~0.5 mL,重复2次,即共用约12 mL磷酸缓冲液换相,最后剩0.2~0.4 mL左右,达到脱盐和浓缩的目的。取部分超滤后的样品使用PNGase F酶或α-2,3唾液酸酶处理,方法详见试剂说明书,对处理后的样品进行超滤脱盐。
1.2.4 等电聚焦与转膜印记
使用等电聚焦结合扩散转膜印记方法[14]对超滤后的培养上清样品及 PNGase F酶或 α-2,3唾液酸酶处理后的样品进行检测。
1.2.5 凝集素共沉淀
使用凝集素共沉淀方法检测培养上清中rhEPO糖链分枝末端唾液酸占有率。使用Bradford法检测培养方瓶培养CHO细胞上清中蛋白总量,蛋白定量方法参照试剂盒说明书。取不同时期的培养上清,控制相同的 rhEPO含量(~2 μg),加入 NBCS,使蛋白总量达到 20 μg,加入100 μg RCA-I凝集素,使用PBS将总体积补齐至100 μL。将反应体系于4 ℃放置48 h;放置后,将体系在4 ℃条件下以14 000 r/min离心10 min,将沉淀使用预冷的PBS洗2遍,而后对蛋白样品进行SDS-PAGE和Western blotting。
1.2.6 乳酸脱氢酶 (LDH) 和唾液酸酶的活性测定
培养上清中 LDH活性检测方法参照相应试剂盒说明书。采用以下方法测定培养上清中唾液酸酶的活性[15]:使用384孔板 (Greiner Bio-One,Germany),100 μL 反应体系,样本:25 μL 4 mmol/L 4MU-Neu5Ac 溶液,75 μL 培养上清;对照:25 μL 4 mmol/L 4MU-NeuAc 溶液,75 μL无血清培养基;标准:100 μmol/L 4MU溶液,充分混合体系,使用Fluoroskan Ascent FL化学发光仪 (Thermo Fisher Scientific, USA) 自动程序,37 ℃温育1 h后进行检测,激发光为355 nm,散射光为460 nm。
2 结果与分析
2.1 N-糖链变化造成CHO细胞所生产rhEPO质量降低
等电聚焦结果如图1所示。静置培养条件下,早期无血清培养CHO细胞生产的rhEPO质量是较好的,集中在酸端,到培养中期,碱端的条带增加,但是酸端的部分依然存在,到培养后期,酸端的部分条带消失,碱端的条带增多,蛋白聚体增多。不同时期所生产的rhEPO被PNGase F酶切除N-糖链后,等电聚焦结果条带分布基本相同,说明培养过程中rhEPO的等电点分布的变化是由N-糖基化水平的变化引起的,同时也可以排除蛋白降解或O-糖链变化等其他因素造成不同培养时期的rhEPO蛋白的等电点差异的可能性。
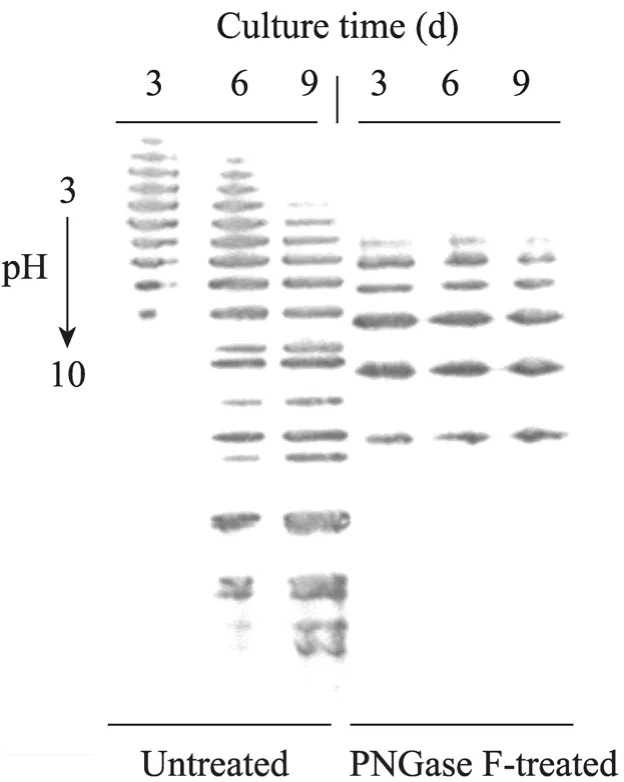
图1 rhEPO样品固相pH梯度等电聚焦印迹结果Fig. 1 Immobilized pH gradients isoelectric focusing(IPG-IEF) analysis of rhEPO samples.
2.2 N-糖链末端的唾液酸占有率降低导致CHO细胞所生产rhEPO品质降低
对阿华生物公司生产的 rhEPO原液和方瓶培养CHO细胞获得的不同时期的培养上清进行凝集素免疫沉淀。离心后将沉淀与上清同时进行SDS-PAGE和Western blotting,结果如图2所示。rhEPO原液和培养早期的上清里的 rhEPO蛋白没有出现在沉淀中,rhEPO蛋白都只出现在培养上清中,到培养中期,沉淀中出现rhEPO蛋白,培养后期有更多的rhEPO沉淀,说明方瓶培养过程中rhEPO的N-糖链末端的半乳糖逐渐暴露。因此rhEPO蛋白在方瓶培养后期唾液酸含量降低的一个重要原因是N-糖链末端没有全部结合唾液酸。从图2中还可以看到,随着培养时间的延长,rhEPO蛋白的分子量逐渐降低,之前的IEF实验已经证明培养过程中没有蛋白降解的影响,因此是蛋白N-糖基化的改变使rhEPO的分子量下降。
2.3 CHO细胞培养过程中细胞活性的变化
对方瓶无血清培养的CHO细胞上清中的乳酸脱氢酶 (LDH) 活性进行检测,结果如图3所示。从图中可以看到,随着培养时间延长,胞外LDH活性逐渐升高,细胞活性逐渐降低。这与无血清培养基中该株细胞的生长曲线所显示的细胞活性变化一致 (图 4),随着生产时间的延长,贴附的活细胞数量逐渐减少。
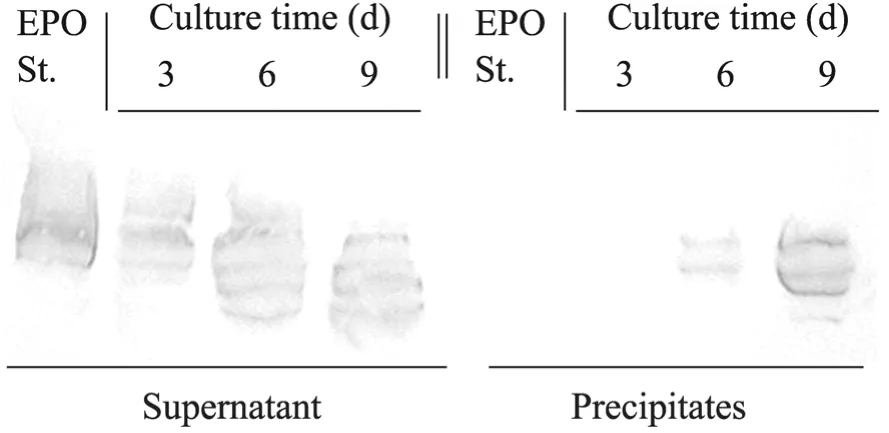
图 2 方瓶培养 CHO 细胞上清凝集素蛋白共沉淀SDS-PAGE和Western blotting结果Fig. 2 SDS-PAGE and Western blotting analysis of rhEPO samples after lectin precipitation.
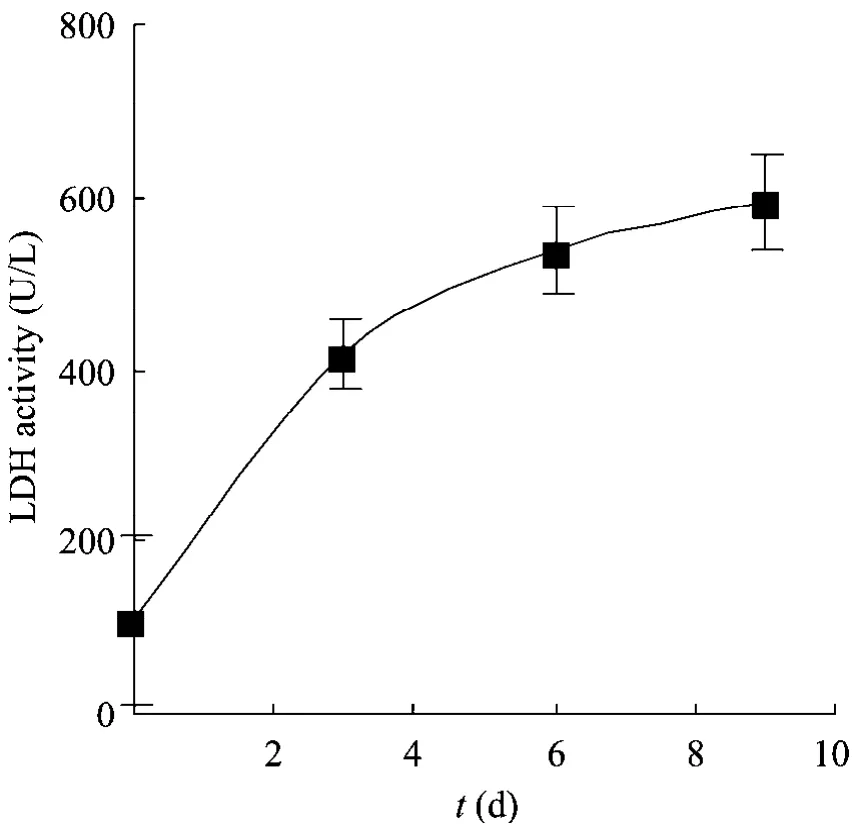
图3 静置培养CHO细胞上清中LDH活性变化Fig. 3 LDH activity in conditioned media of CHO cultured in T-175 flasks.
2.4 唾液酸酶对CHO细胞所产rhEPO存在降解作用
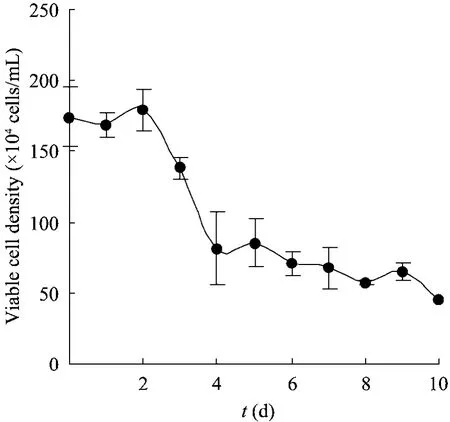
图4 CHO细胞在CHO-S-SFM II培养基生产阶段的生长曲线Fig. 4 Growth curve of CHO cells at production phase in CHO-S-SFM II.
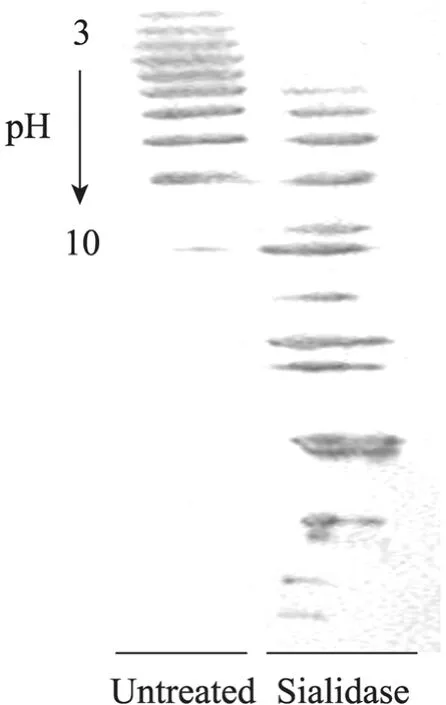
图5 经唾液酸酶处理后CHO培养上清中rhEPO样品的等电聚焦结果Fig. 5 IPG-IEF results of rhEPO in CHO conditioned media after sialidase digestion.
如图5所示,使用唾液酸酶对T-175方瓶的无血清培养初期所收获的rhEPO进行处理,处理后,rhEPO的等电点分布发生变化,酸端条带减少,说明唾液酸酶会对该株 CHO细胞所产的rhEPO上的唾液酸产生降解作用。
2.5 CHO细胞培养过程中上清中唾液酸酶活性变化
对方瓶培养的CHO细胞上清中的唾液酸酶酶活性进行检测,结果见图6。在培养过程中,更换为无血清培养基后,培养上清中的唾液酸酶活性逐渐升高,到培养中后期,培养基中的唾液酸酶活性稳定存在。
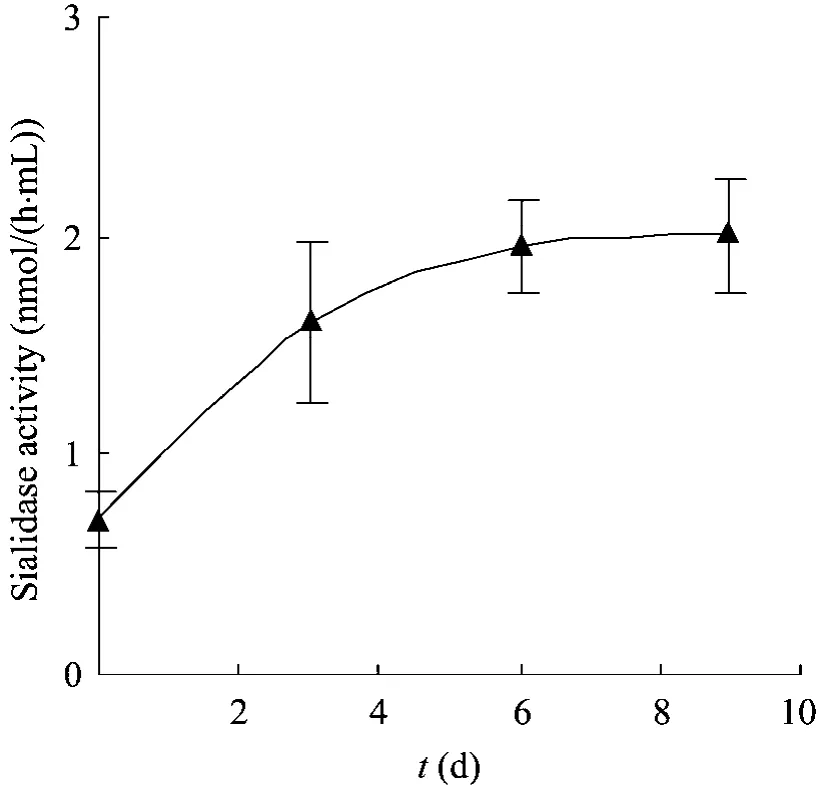
图6 静置培养CHO上清中唾液酸酶酶活性变化Fig. 6 Sialidase activity in supernatant of CHO cultured in T-175 flasks.
3 讨论
重组人 EPO的一级结构与天然蛋白没有差别,肽链部分包含166个氨基酸残基,糖成分约占EPO分子量的40%。糖基在EPO蛋白所占比例较大,对 EPO蛋白的性质和功能也有很大影响[16]。对于 rhEPO蛋白,糖基化后形成的唾液酸丰度会显著影响 rhEPO蛋白在人体内的半衰期,所以生产中质量控制的一个重要环节就是对rhEPO唾液酸丰度的检测,大量不符合标准的蛋白会被丢弃。生产糖蛋白类药物的过程中,很多生物、化学或物理的参数会影响产品的糖基化形态,糖基化的通路复杂而且被严格调控,这使得控制蛋白的糖基化并不是一件简单的事[17]。了解培养过程中的各种因素对糖基化的影响,有助于改善工艺条件,保持理想的糖基化形态和蛋白产品质量的稳定性。
CHO细胞被广泛用于重组蛋白药物的生产,一个重要原因是其糖基化修饰与人类相似,表达的蛋白适于人体使用[18-19],但是糖基化相关的酶对于CHO细胞的生存不是必需的,所以在没有环境压力的条件下,糖基化相关基因发生突变的CHO细胞大量存在,不同的CHO细胞株对重组蛋白的糖基化修饰能力存在差异,甚至同一株CHO细胞在经过传代后也会变为一群具有不同糖基化修饰能力的细胞的集合,所产蛋白的糖基化修饰程度也就产生了差异[20]。所以,在无血清培养初期,细胞状态较好的条件下,我们考察了所研究的工程细胞株是否可以表达高唾液酸含量的rhEPO产品,以证明该细胞株是否存在糖基化酶的缺陷。
通过等电聚焦的方法,我们可以直观地展示培养过程中细胞所生产 rhEPO的等电点变化情况,在培养初期,该细胞株可以表达高唾液酸含量的rhEPO,这说明该细胞株具备完整的N-糖基化修饰系统,但是随着培养时间的延长,蛋白N-糖链的修饰发生变化,而这种变化是由于外部环境的改变引起的,这些环境因素一方面可能影响细胞内的N-糖基化通路,一方面可能直接作用于胞外的蛋白产品。
血清可以提供细胞生长所需要的营养,但是由于其成分的不确定性,不能被应用于重组蛋白的生产,虽然无血清培养基可以取代血清的作用,但是细胞往往需要经过适应才能在无血清培养基中正常生长和代谢[21]。CHO-S-SFMⅡ是一种商业化培养基,在营养成分方面存在一定的缺陷[22],本研究中的细胞株由于工艺要求,在有血清培养后直接转换至 CHO-S-SFMⅡ中培养,培养环境的变化是造成细胞大量死亡的主要原因。
在细胞培养过程中,CHO胞内的糖苷酶会由于细胞分泌或者细胞裂解而被释放到胞外。Gramer和Goochee[15]发现CHO细胞上清中存在4种糖苷酶的活性,其中唾液酸酶积累在胞外培养基内,并且在pH为7的条件下仍保持一定的活性。这种现象是否存在于我们的培养过程中,也是我们关注的问题之一。
凝集素共沉淀的结果表明,培养过程中rhEPO糖基化修饰的变化是由于rhEPO蛋白N-糖链末端的唾液酸含量下降造成的,N-糖链末端的半乳糖逐渐暴露,说明随着培养时间的延长,rhEPO蛋白上N-糖链的天线数目逐渐多于其末端的唾液酸数目,这可能是由于唾液酸没有连接到糖链上或连接后被切除造成的。培养过程中细胞的活性逐渐降低,死亡的细胞所释放的唾液酸酶在胞外积累,这些唾液酸酶的降解作用会对胞外rhEPO唾液酸含量的降低做出贡献。
结合上述发现,我们可以采用相同的方法对工业生产过程中该株细胞所生产的rhEPO的N-糖基化变化规律及影响因素进行研究,考察灌注培养模式下该株细胞是否会释放唾液酸酶到胞外并对产品的唾液酸含量产生影响,为进一步研究打下了基础。
[1]Aggarwal S. What’s fueling the biotech engine-2009-2010. Nat Biotechnol, 2010, 28(11):1165−1171.
[2]Walsh G. Post-translational modifications of protein biopharmaceuticals. Drug Discov Today,2010, 15(17/18): 773−780.
[3]Pan TQ. Monitoring recombinant human erythropoietinN-Glycosylation during perfusion culture of CHO cells [D]. Shanghai: East China University of Science and Technology, 2009.
潘婷琪. 灌注培养重组CHO细胞生产EPO的N-糖基化规律研究[D]. 上海: 华东理工大学, 2009.
[4]Zhang PQ, Tan DL, Heng D, et al. A functional analysis ofN-glycosylation-related genes on sialylation of recombinant erythropoietin in six commonly used mammalian cell lines. Metab Eng,2010, 12(6): 526−536.
[5]Berger M, Kaup M, Blanchard V. Protein glycosylation and its impact on biotechnology // Hu WS, Zeng AP. Advances in Biochemical Engineering/Biotechnology, Genomics and Systems Biology of Mammalian Cell Culture, Vol.127. Germany: Springer Science Business Media,2012: 165−185.
[6]Lingg N, Zhang P, Song Z, et al. The sweet tooth of biopharmaceuticals: importance of recombinant protein glycosylation analysis. Biotechnol J, doi:10.1002/biot.201200078.
[7]Lim SF, Lee MM, Zhang PQ, et al. The Golgi CMP-sialic acid transporter: a new CHO mutant provides functional insights. Glycobiology, 2008,18(11): 851−860.
[8]Goh JSY, Zhang PQ, Chan KF, et al.RCA-I-resistant CHO mutant cells have dysfunctional GnT I and expression of normal GnT I in these mutants enhances sialylation of recombinant erythropoietin. Metab Eng, 2010,12(4): 360−368.
[9]Chuan KH, Lim SF, Martin L, et al. Caspase activation, sialidase release and changes in sialylation pattern of recombinant human erythropoietin produced by CHO cells in batch and fed-batch cultures. Cytotechnology, 2006, 51(2):67−79.
[10]Gramer MJ, Goochee CF, Chock VY, et al.Removal of sialic acid from a glycoprotein in CHO cell culture supernatant by action of an extracellular CHO cell sialidase. Nat Biotechnol, 1995, 13(7):692−698.
[11]Ngantung FA, Miller PG, Brushett FR, et al. RNA interference of sialidase improves glycoprotein sialic aicd content consistency. Biotechnol Bioeng,2006, 95(1): 106−119.
[12]Zhang M, Koskie K, Ross JS, et al. Enhancing glycoprotein sialylation by targeted gene silencing in mammalian cells. Biotechnol Bioeng, 2010,105(6): 1094−1105.
[13]Freshney RI. Culture of Animal Cells: A Manual of Basic Technique. USA: Wiley-Liss, 2005.
[14]Towbin H. Blotting from immobilized pH gradient gels: application to total cell lysates // Kurien BT,Scofield RH. Methods in Molecular Biology,Protein Blotting and Detection. New York: Humana Press, 2009: 253−258.
[15]Gramer MJ, Goochee CF. Glycosidase activities in Chinese hamster ovary cell lysate and cell culture supernatant. Biotechnol Prog, 1993, 9(4): 366−373.
[16]Takeuchi M, Takasaki S, Shimada M, et al. Role of sugar chains in thein vitrobiological activity of human erythropoietin produced in recombinant Chinese hamster ovary cells. J Biol Chem, 1990,265(21): 12127−12130.
[17]Hossler P, Khattak SF, Li ZJ. Optimal and consistent protein glycosylation in mammalian cell culture. Glycobiology, 2009, 19(9): 936−949.
[18]Jayapal KP, Wlaschin KF, Hu WS, et al.Recombinant protein therapeutics from CHO cells---20 years and counting. CHO Consortium:SBE Special Edition, 2007: 40−47.
[19]Kim JY, Kim Y, Lee GM. CHO cells in biotechnology for production of recombinant proteins: current state and further potential. Appl Microbiol Biotechnol, 2012, 93(3): 917−930.
[20]Markely LRA. High-throughput quantification of glycoprotein sialylation[D]. USA: Massachusetts Institute of Technology, 2011.
[21]LeFloch F, Tessier B, Chenuet S, et al. Related effects of cell adaptation to serum-free conditions on murine EPO production and glycosylation by CHO cells. Cytotechnology, 2006, 52(1): 39−53.
[22]Dietmair S, Hodson MP, Quek LE, et al. Metabolite profiling of CHO cells with different growth characteristics. Biotechnol Bioeng, 2012, 109(6):1404−1414.
June 16, 2012; Accepted: September 27, 2012
Zhiwei Song. Tel: +86-65-64070844; Fax: +86-65-96220671; E-mail: song_zhiwei@bti.a-star.edu.sg Yuanxing Zhang. Tel: +86-21-64253065; Fax: +86-21-64253025; E-mail: yxzhang@ecust.edu.cn
国家新药创制重大专项 (No. 2009ZX09503-013),上海市重点学科 (No. B505) 资助。
Extracellular sialidase degrades sialic acid in recombinant human erythropoietin produced by an industrial Chinese hamster ovary cell strain
Yingwei Liu1, Xiangshan Zhou1, Haifeng Liu1,3, Zhiwei Song2, and Yuanxing Zhang1
1State Key Laboratory of Bioreactor Engineering, East China University of Science and Technology, Shanghai200237,China
2Bioprocessing Technology Institute, Agency for Science, Technology and Research, Singapore138668,Singapore
3E-hua Biotech Pharmaceutical Co.,Ltd., Dong’e252201, Shandong, China
To investigate theN-glycosylation characteristics of recombinant human erythropoietin (rhEPO) produced by an industrial Chinese hamster ovary (CHO) cell line that is currently used in a large scale manufacturing process, we cultured this cell strain in static mode. The produced rhEPO in the culture supernatant was analyzed using isoelectric focusing (IEF) andRicinus communisagglutinin-I (RCA-I) lectin precipitation. The lactate dehydrogenase (LDH) and sialidase activity in the serum-free supernatant were assayed as well. The analyses revealed that this cell strain could produce rhEPO with high sialic acid content, but during prolonged culture, cell viability decreased with time whilst the activity of sialidase present in the supernatant increased. The loss in rhEPO quality was due to a decrease in terminal sialic acid on theN-glycans, caused by sialidase degradation. The methods and findings in this paper serve as basis for further investigation of industrial production process.
Chinese hamster ovary cell strain, recombinant human erythropoietin,N-glycosylation, cell viability, sialidase
book=1499,ebook=71
Supported by: National Special Project of Key Technology of China (No. 2009ZX09503-013), Shanghai Leading Academic Discipline Project(No. B505).