Toll样受体对病原寄生虫的天然免疫识别
2012-09-05何小兵贾怀杰景志忠
何小兵,贾怀杰,景志忠
中国农业科学院兰州兽医研究所 家畜疫病病原生物学国家重点实验室 农业部兽医公共卫生重点实验室,甘肃 兰州 730046
Toll样受体对病原寄生虫的天然免疫识别
何小兵,贾怀杰,景志忠
中国农业科学院兰州兽医研究所 家畜疫病病原生物学国家重点实验室 农业部兽医公共卫生重点实验室,甘肃 兰州 730046
何小兵, 贾怀杰, 景志忠. Toll样受体对病原寄生虫的天然免疫识别. 生物工程学报, 2012, 28(12): 1401−1413.
He XB, Jia HJ, Jing ZZ. Innate immune recognition of the pathogenic parasites by Toll-like receptors. Chin J Biotech, 2012,28(12): 1401−1413.
Toll样受体是机体天然免疫系统最重要的模式识别受体之一,通过识别病原寄生虫的病原相关分子模式,活化依赖和非依赖于髓样分化因子88的信号转导通路,诱导干扰素、炎症因子、趋化因子等的表达以及树突状细胞的成熟,抵御病原寄生虫的感染。因此,以下综述了 Toll样受体对原病寄生虫,尤其对动物寄生性原虫与蠕虫感染的模式识别与天然免疫应答机制,以进一步理解病原寄生虫与宿主相互作用的复杂性,为寄生虫病的有效防治提供理论参考。
天然免疫,模式识别受体,病原相关分子模式,Toll样受体,病原寄生虫
Toll样受体 (Toll-like receptors, TLRs) 作为一类古老的天然免疫受体家族,是机体天然免疫系统最重要的模式识别受体 (Pattern recognition receptors, PRRs) 之一,通过识别病原 (病毒、细菌、真菌和寄生虫) 在漫长进化过程中遗留下来的保守的结构成分,即病原相关分子模式(Pathogen-associated molecular patterns, PAMPs),启动细胞内依赖于髓样分化因子 88 (Myeloid differentiation factor 88, MyD88) 或Toll/白介素-1受体衔接蛋白 (Toll/IL-1 receptor domain containing adaptor protein, TRIF) 的信号转导通路,诱导I型干扰素 (Interferons, IFNs)、炎症因子 (Inflammatory cytokines)、趋化因子(Chemokines) 和共刺激分子 (Co-stimulatory molecules) 的释放和表达,以及树突状细胞(Dendritic cells, DCs) 的成熟,并诱导获得性免疫的建立,从而发挥免疫防御作用[1-3]。
病原寄生虫是无脊椎单细胞或多细胞的真核生物,生活史复杂,抗原成分多,能在广泛的动物宿主和人群中建立稳定的宿主与寄生关系。以疟原虫和弓形虫等感染为代表的寄生虫病,是世界性的公共卫生问题,其发病率、致残率和死亡率高,严重影响社会、经济发展和人类健康,尤其在发展中国家尤为猖獗。在长期的进化及与宿主的相互作用过程中,一方面病原寄生虫为了长期存活于宿主体内,适应性地进化了一系列的手段来干扰宿主的天然和获得性免疫;另一方面,宿主通过各种防御策略,尤其是通过TLRs以及其他PRRs构成的“三位一体”的模式识别系统,识别病原寄生虫的各种 PAMPs,启动机体的抗寄生虫的天然免疫防御效应,防止病原寄生虫的入侵、感染和致病,维持机体内环境稳态。
在宿主严阵以待的模式识别和天然免疫体系中,TLRs及其信号转导通路在机体抵抗病原寄生虫的感染中扮演了关键而复杂的角色。在已发现的哺乳动物的13个TLRs中,TLR1、TLR2、TLR3、TLR4、TLR6、TLR7、TLR9、TLR11、TLR12与病原寄生虫 (主要包括原虫和蠕虫) 的识别有关。其中TLR1、TLR2、TLR4、TLR6、TLR11、TLR12主要识别病原寄生虫的虫体结构成分及其分泌成分,TLR3、TLR7和TLR9主要识别病原寄生虫的核酸成分 (图1)[1-5]。因此,作者拟通过概述TLRs对病原寄生虫感染的模式识别与天然免疫应答机制,理解病原寄生虫感染和宿主抗感染的分子机制,探讨寄生虫与宿主相互作用的复杂性,为寄生虫病的防治提供理论依据。

图1 TLRs对病原寄生虫PAMPs的天然免疫识别[3]Fig. 1 Innate immune recognition of pathogenic parasites PAMPs by TLRs[3]. P. falciparum: Plasmodium falciparum;T. cruzi: Trypanosoma cruzi; T. gondii: Toxoplasma gondii; TLRs: Toll-like receptors; GPI:glycosylphosphatidylinositol; GIPL: glycoinositolphospholipid; PFTG: profilin-like protein; NF-κB: nuclear factor-κB;MAPK: mitogen-activated protein kinase; IκB: inhibitor of NF-κB; IL: interleukin; IFN-γ: interferon-γ; TGF-β:transforming growth factor-β; TNF: tumor-necrosis factor.
1 TLRs的基本特征
1.1 TLRs的分子特征
TLRs是一类进化上高度保守的胚系编码的I型跨膜受体蛋白,由胞外区、跨膜区和胞内区组成。其中胞外区由18~31个富含亮氨酸的重复序列 (Leucine rich repeats, LRRs) 组成,与PAMPs的识别有关;跨膜区是富含半胱氨酸的区域,与TLRs的亚细胞定位有关;胞内区由约200个氨基酸残基组成的 Toll/IL-1R(TIR) 结构域,与下游信号转导有关[1-3]。TIR是与其下游蛋白激酶相互作用的关键部位,也是TLRs信号转导的核心元件,这一区域关键位点的突变或序列缺失将阻断信号向下游传递[1-3]。从进化角度看,LRRs具有长度的多样性,是为了适应 PAMPs的变化而进行相应的进化,而 TIR结构域在不同动物/宿主之间相当保守,使其在不同动物中能介导相似的信号转导通路[1-3]。
1.2 TLRs的信号转导通路及其相关分子
TLRs的信号转导通路主要包括依赖于MyD88和TRIF的信号转导通路。其中TLR1、2、5、6、7、8、9依赖于MyD88的信号通路,TLR3依赖于TRIF的信号转导通路,而TLR4依赖于以上两种信号转导通路。TLRs的信号通路涉及多种信号分子的参与,主要包括 MyD88、TIRAP/TRIF、IL-1受体相关激酶 (IL-1 receptor associated kinases, IRAKs)、肿瘤坏死因子受体相关因子 6 (TNF receptor associated factor 6,TRAF6)、丝裂原活化蛋白激酶 (Mitogen activated protein kinases, MAPKs) 以及核转录因子-κB (Nuclear factor-κB, NF-κB)、活化蛋白-l (Activating protein, AP-l)、干扰素调节因子 (Interferon regulatory factors,IRFs) (表 1)[6]。
1.3 TLRs的组织细胞分布
根据细胞内定位的不同,可将TLRs分为2个亚家族,即位于细胞膜表面的TLR1、TLR2、TLR4、TLR5、TLR6、TLR10和 TLR11,以及位于胞内细胞器膜 (如细胞内体膜、溶酶体膜或内质网膜) 的 TLR3、TLR7、TLR8、TLR9和TLR13 (表1)[1-3,6]。此外,依据TLRs的表达特性,可将其分为广泛性表达、局限性表达和特异性表达 (表1)[1-3,6]。因此,TLRs在组织、细胞中的广泛表达与某一或某几类TLRs在特定细胞上的表达及其精细的结构构成可能是其发挥生物学作用的必要条件。由于TLRs细胞定位的不同以及自身结构的差异,不同的TLRs可识别病原的不同PAMPs (表2)[1-3,6-9]。
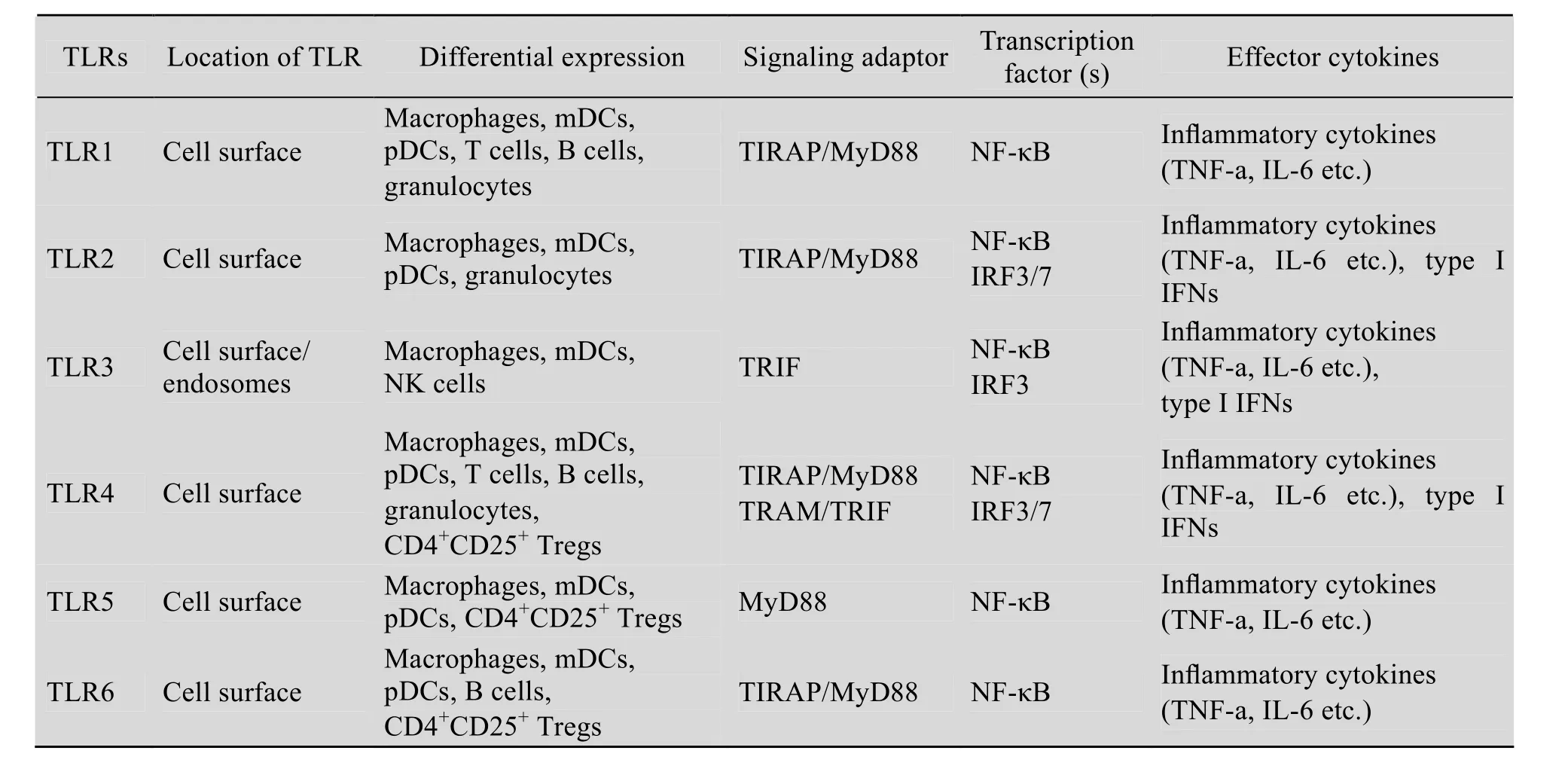
表1 TLRs的差异表达及其介导的信号转导通路Table 1 Differential expression and signalling pathways of TLRs

T L R 7 E n d o s o m e p D C s, g r a n u l o c y t e s,B c e l l s(续表 1)N F-κ B I n f l a m m a t o r y c y t o k i n e s M y D 8 8 T L R 8 E n d o s o m e M o n o c y t e s/m a c r o p h a g e s,m D C s, C D 4+C D 2 5 High T r e g s I R F 7(T N F-a, I L-6 e t c.), t y p e I I F N s N F-κ B I n f l a m m a t o r y c y t o k i n e s M y D 8 8 T L R 9 E n d o s o m e p D C s, B c e l l s I R F 7(T N F-a, I L-6 e t c.), t y p e I I F N s I n f l a m m a t o r y c y t o k i n e s M y D 8 8 M a c r o p h a g e s, m D C s,T L R 1 0 C e l l s u r f a c e p D C s, B c e l l s, C D 4+C D 2 5+N F-κ B I R F 7(T N F-a, I L-6 e t c.), t y p e I I F N s M y D 8 8 U n k n o w n U n k n o w n T r e g s T L R 1 1 C e l l s u r f a c e D C s M y D 8 8 T L R 1 2 U n k n o w n p D C s, m a c r o p h a g e s,D C s N F-κ B I n f l a m m a t o r y c y t o k i n e s(T N F-a, I L-6 e t c.)I n f l a m m a t o r y c y t o k i n e s U n k n o w n T L R 1 3 E n d o s o m e M a c r o p h a g e s, D C s U n k n o w n (I L-1 2)M y D 8 8 N F-κ B I R F 7 T y p e I I F N s

表2 TLRs对病原寄生虫PAMPs的识别Table 2 Recognition of the parasites pathogen-associated PAMPs by TLRs
2 TLRs对病原寄生虫的识别
如前所述,在已发现的哺乳动物的 13个TLRs中,TLR1、TLR2、TLR3、TLR4、TLR6、TLR7、TLR9、TLR11、TLR12均与识别病原寄生虫有关。其中TLR1、TLR2、TLR4、TLR6、TLR11、TLR12主要识别病原寄生虫的虫体成分和分泌成分,如恶性疟原虫、刚地弓形虫、利什曼原虫以及克氏锥虫的糖基磷脂酰肌醇(Glycosylphosphatidylinositol, GPI) 锚定蛋白、糖基肌醇磷脂 (Glycoinositolphospholipids, GIPLs)锚定蛋白和鼠刚地弓形虫的肌动蛋白抑制蛋白Profilin (Profilin-like protein, PFTG) 等;TLR3主要识别病原寄生虫的 dsRNA,如曼氏血吸虫(S. mansoni) 虫卵的 dsRNA;TLR7识别克氏锥虫的ssRNA;TLR9主要识别病原寄生虫的DNA,如克氏锥虫、牛巴贝斯虫和布氏锥虫基因组的非甲基化的CpG DNA等 (表1)[1-2,4-5]。因此,当病原寄生虫感染时,TLRs通过识别的PAMPs,活化依赖于MyD88和TRIF的信号转导通路,募集、激活单核/巨噬细胞、自然杀伤细胞、中性粒细胞以及诱导IFNs、炎症因子、趋化因子等的表达和DCs的成熟,发挥天然抗寄生虫免疫作用。
2.1 TLR2对病原寄生虫的识别
一般而言,TLR2单独或与TLR6以异源二聚体的形式识别病原寄生虫的 PAMPs。研究发现,MyD88-/-小鼠对鼠伯氏疟原虫、布氏锥虫、鼠刚地弓形虫和利什曼原虫高度易感,表现为Th1型细胞因子IFN-γ和IL-12分泌的减少、寄生虫血症的增加和死亡率的升高等[10];同时MyD88-/-小鼠的 DCs感染鼠刚地弓形虫时也表现为IL-12分泌的减少与Th1细胞的缺陷[11]。这说明DCs的TLRs介导的天然免疫反应的激活以及 Th1型细胞的活化对机体抵御原虫的感染至关重要。TLR2与DC相关性C型植物血凝素-1(Dendritic cell associated C-type lectin-1,Dectin-1) 通过协同识别卡氏肺孢子虫胞壁的 β-葡聚糖,活化 NF-κB,诱导肺泡巨噬细胞分泌MIP-2、TNF-α、IL-12[12],而卡氏肺孢子虫的β-葡聚糖也能刺激TLR4-/-巨噬细胞产生TNF-α[13]。因此,TLR2在对卡氏肺孢子虫的天然免疫中发挥重要作用。溶组织内阿米巴虫的脂肽磷酸多糖(Lipopeptidophosphoglycan, LPPG) 作为TLR2和TLR4的PAMPs而被识别。溶组织内阿米巴虫的LPPG通过激活单核细胞,上调TLR2、TLR4的表达、活化NF-κB导致IL-10、TNF-α和IL-8的分泌[14]。利什曼原虫的毒力因子,即脂磷聚糖(Lipophosphoglycan,LPG) 可介导宿主单核巨噬细胞的内吞作用,并通过TLR2激活自然杀伤细胞和巨噬细胞[15]。利什曼原虫的另一个蛋白,即沉默信息调节因子 2相关蛋白 1 (Silent information regulator 2 related protein 1,SIR2RP1) 能以依赖于TLR2的方式刺激B细胞的增殖、MHCⅡ分子、共刺激分子CD40和CD86的上调以及促进获得性免疫的建立,也能通过TLR2刺激DCs导致TNF-α、IL-12的分泌以及CD40和CD86的上调,而TLR2-/-小鼠对其无任何反应[16-17]。这说明TLR2在抵御利什曼原虫的感染中发挥了重要作用。不仅如此,兔脑炎微孢子虫 (Encephalitozoon cuniculi,E. cuniculi)、肠道微孢子虫 (E. intestinalis) 也以依赖于 TLR2的方式激活巨噬细胞,活化NF-κB,诱导炎症因子TNF-α和IL-8的分泌,激活机体的炎症反应[18]。
克氏锥虫的GPI作为TLR2的配体,能刺激巨噬细胞分泌炎症因子来引发宿主的抗锥虫免疫反应。相对于野生型小鼠,克氏锥虫的 GPI刺激TLR2-/-小鼠时,IL-12、TNF-α和 NO的释放减少[19];同时,TLR6-/-的巨噬细胞对克氏锥虫的感染无反应[20],这说明 TLR2/TLR6/CD14复合体可能参与对克氏锥虫GPI的识别。除了克氏锥虫的GPI可被TLR2识别外,克氏锥虫的另一个分子量为 52 kDa的克氏锥虫的释放蛋白(T. cruzi-released protein with a molecular mass of 52 kDa, Tc52) 也是TLR2识别的PAMPs。Tc52通过TLR2激活人和小鼠的DCs,诱导炎症因子的分泌[21]。由于磷脂基是最接近作为原生动物的PAMPs,因此类似于克氏锥虫GPI的识别,TLR2也识别来源于恶性疟原虫、鼠刚地弓形虫和利什曼原虫的 GPI[10]。Debierre-Grockiego等研究显示,鼠刚地弓形虫以 TLR2-MyD88依赖的方式诱导宿主的IL-12和中性粒细胞趋化因子CCL2的释放[22],这说明 TLR2-MyD88信号转导通路在宿主抗鼠刚地弓形虫感染中起重要作用。
不仅TLR2识别原虫的PAMPs分子,也识别蠕虫的PAMPs分子。Reyes等发现,牛带绦虫囊尾蚴 (Taenia crassiceps,T. crassiceps) 感染TLR2-/-小鼠及其脾细胞后,在血清和细胞上清中均未检测到炎症因子,而且TLR2-/-小鼠及其脾细胞对牛带绦虫囊尾蚴更加易感[23]。此外,TLR2-/-小鼠趋向于Th2型免疫反应,而野生型小鼠趋向于Th1型免疫反应[23]。这说明TLR2及其介导的信号通路参与对牛带绦虫囊尾蚴的天然免疫识别,介导Th1型炎症因子的分泌以及限制牛带绦虫囊尾蚴的感染。曼氏血吸虫虫卵通过TLR2上调小鼠mDCs的共刺激分子CD40和CD86以及细胞因子 IFN-β、TNF-α、IL-12等的表达[24]。此外,曼氏血吸虫成虫和虫卵的溶血性磷酸甘油酯(Lysophosphatidylserine, lyso-PS) 与 TLR2 相互作用,可诱导DCs的分化,促进T细胞分泌IL-4和 IL-10[25];成虫及其虫卵分泌的可溶性虫卵抗原SEA也可上调多发性硬化患者 DCs和 B细胞的TLR2的表达,增强TGF-β和IL-10的产生[25-26]。因此,曼氏血吸虫的虫体分子通过TLR2介导的信号途径对DCs和B细胞进行了有效调节,导致IL-10的分泌,抑制机体的免疫状态,从而逃避机体的免疫识别。值得注意的是,曼氏血吸虫虫卵的 dsRNA 能以依赖和非依赖TLR3-MyD88的信号途径激活 DCs,导致 I型IFNs和干扰素刺激基因 (IFN stimulated genes,ISGs) 的表达[27]。
2.2 TLR4对病原寄生虫的识别
不仅TLR2识别溶组织内阿米巴虫的LPPG,TLR4也识别溶组织内阿米巴虫的 LPPG。溶组织内阿米巴虫的LPPG通过刺激单核细胞,上调TLR4/MD2的表达,活化NF-κB的核转移,导致炎症因子 IL-10、TNF-α和 IL-8的分泌[14]。TLR4不仅通过识别鼠刚地弓形虫的 GIPLs激活鼠巨噬细胞,活化NF-κB,诱导TNF-α和趋化因子的表达,而且也识别来源于恶性疟原虫、鼠刚地弓形虫和利什曼原虫的 GPI[1,10]。有趣的是,利什曼原虫的LPG可激活TLR4,诱导IFN-α/β的分泌,增强一氧化氮合成酶 (NOS) 早期表达并合成NO,从而促进利什曼原虫的死亡[17-18]。这证明了TLR4介导机体对原虫的天然免疫反应。感染阴道毛滴虫的妇女,其阴道分泌物通过 TLR4刺激细胞产生TNF-α[28]。克氏锥虫的GIPLs作为TLR4和CD1d复合受体的配体,引发宿主的抗锥虫的炎症反应[18-19]。曼氏血吸虫不同成熟期的活幼虫或其可溶性制备物中的多糖,以TLR4/CD14-MyD88信号途径刺激巨噬细胞分泌IL-6、IL-12p40和IL-10等细胞因子[29]。
2.3 TLR9对病原寄生虫的识别
TLR9不仅识别细菌、病毒和真菌非甲基化的CpG DNA,也识别病原寄生虫的非甲基化的CpG DNA。利什曼原虫以依赖于TLR9的方式诱导IFN-α/β和IL-12的产生。TLR9不仅对于mDCs分泌 IL-12必不可少,对于自然杀伤细胞产生IFN-γ及其杀伤作用也必不可少[30]。来源于利什曼原虫、牛巴贝斯虫、克氏锥虫和布氏锥虫的DNA以依赖于 TLR9的方式激活巨噬细胞与DCs,诱导机体的抗寄生虫炎症反应;同时来源于克氏锥虫的富含CpG基序的基因组DNA作为TLR9的配体,以依赖TLR9的方式激活抗原递呈细胞分泌细胞因子,而感染克氏锥虫的TLR9-/-小鼠则表现出寄生虫血症和死亡率升高[31-35]。这说明TLR9在机体抵御克氏锥虫感染中扮演了重要的角色。
疟原虫基因组中富含AT的DNA,其中也包含少量的 CpG基序,具有免疫刺激活性。富含AT 的 DNA,如 5′-TATAATTTTTACCAACTA GC-3′,能激活 TLR9信号通路[35]。因此认为,来源于疟原虫基因组的具有这两种特征 (富含AT和少量的CpG基序) 的DNA序列就能激活TLR9。有趣的是,除DNA外,恶性疟原虫的消化宿主血红蛋白的代谢产物疟原虫色素(Hemozoin, HZ),能通过TLR9激活巨噬细胞和DCs分泌I型IFNs、炎症因子和表达趋化因子。纯化的天然恶性疟原虫的HZ能激活野生型小鼠的脾细胞、巨噬细胞和BMDCs高水平表达炎症因子、趋化因子以及NO,并上调CD40和CD86和促进 mDCs的成熟[36-37]。同时抗疟药物氯喹能阻断HZ引发的炎症反应,并且HZ也不能刺激 TLR9-/-或 MyD88-/-小鼠的细胞表达提高TNF-α和MCP-1等细胞因子以及协同刺激分子的表达[36-37]。应用ELISA和圆二色谱测定显示,HZ能阻断重组的 TLR9蛋白与恶性疟原虫粗提物的结合,并且当重组TLR9中加入HZ后,TLR9的构象发生变化,表明TLR9与疟原虫色素发生了结合,并具有结构特异性[36-37]。
尽管如此,一些学者对这一结论表示质疑。Parroche和 Griffith等用 HZ体外刺激骨髓源DCs,培养上清中IL-6和 TNF-α的表达量并未增加[38-39]。由于疟原虫色素有很强的非特异性结合其他物质的能力,因此认为HZ可能结合了疟原虫染色体DNA,DNA酶处理不能使DNA完全降解,是 HZ结合的 DNA刺激了 TLR9,而HZ如同阳性脂质体仅作为载体将疟原虫 DNA运输到内体,然后被内体的TLR9所识别[38-39]。因此,后续的研究应阐明TLR9在识别疟原虫组分的具体作用。有趣的是,TLR9-/-小鼠在一定程度上能够抵抗致死量的约氏疟原虫的感染[40],这说明 TLR9可能是疟原虫逃避机体免疫反应的靶点。
2.4 TLR11对病原寄生虫的识别
人的 TLR11基因存在一个终止区而无任何生物学功能,鼠的 TLR11不仅识别感染泌尿系统的大肠杆菌 8NU菌株,也识别病原寄生虫。目前发现鼠TLR11识别鼠刚地弓形虫的Profilin。因此,弓形虫的 PFTG是目前唯一被认定作为TLR11的配体分子。PFTG不仅是TLR11的配体,也是CD4+T细胞的免疫优势抗原,其免疫原性完全依赖于 TLR11-MyD88信号通路。宿主的DCs通过TLR11和MHCⅡ分子协同识别PFTG,然后递呈给CD4+T细胞,从而诱导了机体的天然与获得性免疫[41]。
早期的研究发现,用低毒力的弓形虫ME49虫株腹腔注射感染小鼠模型中,导致 MyD88-/-小鼠快速死亡。死亡率与高负荷寄生虫量以及低水平的IL-12和IFN-γ密切相关[4,10]。MyD88不仅在宿主抵抗腹腔注射弓形虫的感染中,而且在口腔感染引发的抗感染免疫中也起着重要作用。Egan等发现,MyD88-/-小鼠在口腔感染弓形虫2周内死亡,在感染早期,IFN-γ的产生、中性粒细胞的诱导和肠黏膜p47 GTP酶即IFN-γ诱导的鸟苷三磷酸酶 (Interferon gamma induced GTPase, IGTP) 的诱导均依赖于MyD88[10,42]。虽然 TLR2/4-MyD88信号通路在宿主抗鼠刚地弓形虫感染的保护机制中起重要作用,然而证据表明控制弓形虫免疫反应的并非 TLR2/4。Yarovinsky等发现,通过超声裂解并高速离心后获得的鼠刚地弓形虫速殖子可溶性裂解液(STAg) 能够以依赖MyD88的方式刺激DCs分泌IL-12[43]。然后通过生化分析,是存在于STAg中的一个相对分子质量为 18 000 的普遍存在的、小分子的肌动蛋白连接蛋白,即PFTG以剂量依赖的方式激活 TLR11-NF-κB信号通路,诱导了IL-12 和IFN-γ的分泌,而TLR11-/-小鼠的DCs和 MyD88-/-的 DCs并不对 STAg和重组的PFTG发生免疫反应,并且对鼠刚地弓形虫感染高度易感。这说明鼠的 TLR11识别鼠刚地弓形虫的PFTG,发挥抗弓形虫感染的免疫反应[42-44]。除了通过 TLR11诱导宿主细胞分泌 IL-12和IFN-γ外,PFTG在弓形虫的入侵过程中也发挥了重要功能,这揭示了PFTG在弓形虫与宿主相互作用中的双重作用[10]。有趣的是,虽然在小球隐孢子虫和艾美耳球虫的PFTG也能诱导IL-12的分泌,然而恶性疟原虫的PFTG却有很微弱的诱导产生IL-12的能力[43-44]。
最近发现,感染鼠刚地弓形虫的pDCs通过TLR11诱导了IL-12的分泌,以及将抗原递呈给初始化的幼稚CD4+T细胞[45-46]。这一重要发现揭示了pDCs在机体对非病毒病原的获得性免疫反应中的重要角色。进一步的研究发现,TLR3-/-、TLR7-/-或TLR9-/-的小鼠或DCs未表现出对鼠刚地弓形虫易感性增加,但分别用TLR3、TLR7、TLR9相应的激活剂刺激秀丽隐杆线虫的Unc-93同源基因 B1 (Unc-93 homolog B1,UNC93B1) 缺失小鼠的DCs时,IL-12的分泌减少,以及对鼠刚地弓形虫高度易感[45-46]。这说明核酸识别TLRs (包括 TLR3、TLR7、TLR8、TLR9) 可能在抵抗鼠刚地弓形虫的感染中也扮演了重要的角色。虽然 TLR11表达于细胞表面,但研究发现其与UNC93B1相偶联,并定位于内体,这说明UNC93B1不仅调节TLR3、TLR7、TLR8、TLR9的转运,也通过对TLR11转运的调节,使TLR11感知鼠刚地弓形虫的PFTG,以便使机体建立抗病原寄生虫感染的天然免疫状态。
3 讨论与展望
在机体的免疫防御体系中,天然免疫系统的PRRs,尤其是TLRs在识别病原寄生虫的感染中扮演了重要角色。在与病原寄生虫的长期的相互作用过程中,宿主通过天然PRRs形成了机体从细胞外到细胞内以及不同区室的“三位一体”的模式识别系统,实时监测、识别和清除病原寄生虫及其代谢产物。一旦病原寄生虫感染,宿主通过天然 PRRs,尤其是 TLRs识别病原寄生虫的各种 PAMPs,启动抗寄生虫的天然免疫效应,以防止病原寄生虫的感染和致病,维持机体内环境的稳态。目前,对病原寄生虫与TLRs的相互作用研究仅限于TLRs对寄生虫虫体、某些抗原和核酸的识别,如TLR1、TLR2、TLR4、TLR6、TLR11、TLR12分别识别恶性疟原虫、刚地弓形虫、利什曼原虫以及克氏锥虫的 GPI、GIPLs、鼠刚地弓形虫的 PFTG以及其他病原寄生虫的PAMPs,TLR3识别曼氏血吸虫虫卵的dsRNA,TLR7识别克氏锥虫的 ssRNA,TLR9主要识别克氏锥虫、牛巴贝斯虫和布氏锥虫的非甲基化的CpG DNA以及疟原虫的富含AT的DNA。
目前,TLRs对病原寄生虫的天然识别研究已取得了一定进展,但还有一些争论和很多疑问有待解决和澄清。TLRs-MyD88通路在小鼠抵抗病原寄生虫感染中发挥了重要作用,但这一途径在人类宿主防御的作用尚不明确[4,10,43,47]。小鼠的 TLR11识别弓形虫的 PFTG,但人的 TLR11基因存在一个终止区而无任何生物学功能,那么人类的哪个 TLR分子修正这种缺陷尚不清楚。此外,TLR9对 HZ识别存在的争论,因为一方面是TLR9均识别疟原虫的DNA和HZ,另一方面是疟原虫色素具有很强的非特异性结合 DNA的能力,DNA酶处理不能使DNA完全降解。因此,HZ的纯化是解决争议的关键。TLR3和TLR9分别识别病原寄生虫的dsRNA和DNA,以及也肯定了pDCs在机体对病原寄生虫的天然免疫反应中的重要角色,最近的研究也证实了TLR7参与对克氏锥虫的ssRNA的识别[48-49]。有趣的是,日本血吸虫S. japonicum的HZ并不能诱导小鼠骨髓来源的未成熟DCs的成熟与活化。这说明疟原虫与日本血吸虫的HZ的结构与组分可能存在差异,导致相应的激活机体免疫细胞的途径也不同[50]。因此,研究TLRs或其他PRRs对疟原虫的识别,不仅要了解HZ的免疫识别网络,更为重要的是发现更多的疟原虫致病因子,通过这类研究去阐明疟疾致病的分子机制,这将有助于疟疾的治疗和相关治疗药物的开发,以降低恶性疟疾的死亡率。
目前,对病原寄生虫与TLRs的相互作用研究仅限于虫体、某些抗原和核酸对免疫细胞的调节,而对病原寄生虫的新 PAMPs的鉴定、纯化以及诱导TLRs的信号转导通路的研究较少;同时开发基于TLRs或PRRs的新型药物、疫苗或疫苗佐剂也迫在眉睫。因此,病原寄生虫与TLRs相互作用的分子机制以及不同TLRs间的相互调节与影响研究,对机体 TLRs识别和抵抗病原寄生虫的入侵、寄生和致病机制研究具有重要意义。
[1]Kawai T, Akira S. Toll-like receptors and their crosstalk with other innate receptors in infection and immunity. Immunity, 2011, 34(5): 637−650.
[2]Jing ZZ, He XB, Fang YX, et al. Progress on the molecular patterns and pathways of host recognition to viral nucleic acids. Acta Veter Et Zootech Sin, 2011, 42(3): 311−322.
景志忠,何小兵,房永祥,等. 机体识别病毒核酸的几种分子模式及途径. 畜牧兽医学报,2011,42(3): 311−322.
[3]Gazzinelli RT, Denkers EY. Protozoan encounters with Toll-like receptor signalling pathways:implications for host parasitism. Nat Rev Immunol,2006, 6(12): 895−906.
[4]Liehl P, Mota MM. Innate recognition of malarial parasites by mammalian hosts. Int J Parasitol, 2012,42(6): 557−566.
[5]Alicia KA. Characterization of a novel Toll-like receptor, TLR12, in the host-pathogen immune response to apicomplexan parasites [D]. New Haven: Yale University, 2011.
[6]West AP, Koblansky AA, Ghosh S. Recognition and signaling by Toll-like receptors. Annu Rev Cell Dev Biol, 2006, 22(1): 409−437.
[7]He XB, Fang YX, Jia HJ, et al. Recognition of viral envelope proteins by Toll-like receptors 2 and 4.Immunol J, 2011, 27(10): 902−909.
何小兵, 房永祥, 贾怀杰, 等. Toll样受体2、4对病毒囊膜蛋白的识别. 免疫学杂志, 2011, 27(10):902−909.
[8]Guan Y, Ranoa DR, Jiang S, et al. Human TLRs 10 and 1 share common mechanisms of innate immune sensing but not signaling. J Immunol, 2010, 184(9):5094−5103.
[9]Shi Z, Cai Z, Sanchez A, et al. A novel Toll-like receptor that recognizes vesicular stomatitis virus. J Biol Chem, 2011, 286(6): 4517−4524.
[10]Egan CE, Sukhumavasi W, Butcher BA, et al.Functional aspects of Toll-like receptor/MyD88 signalling during protozoan infection: focus onToxoplasma gondii. Clin Exp Immunol, 2009,156(1): 17−24.
[11]Hou B, Benson A, Kuzmich L, et al. Critical coordination of innate immune defense againstToxoplasma gondiiby dendritic cells responding via their Toll-like receptors. Proc Natl Acad Sci USA, 2011, 108(1): 278−283.
[12]Steele C, Marrero L, Swain S, et al. Alveolar macrophage-mediated killing ofPneumocystis cariniif. sp.murisinvolves molecular recognition by the Dectin-1 beta-glucan receptor. J Exp Med,2003, 198(11): 1677−1688.
[13]Lebron F, Vassallo R, Puri V, et al.Pneumocystis cariniicell wall beta-glucans initiate macrophage inflammatory responses through NF-kappaB activation. J Biol Chem, 2003, 278(27):25001−25008.
[14]Maldonado-Bernal C, Kirschning CJ, Rosenstein Y,et al. The innate immune response toEntamoeba histolyticalipopeptidophosphoglycan is mediated by Toll-like receptors 2 and 4. Parasite Immunol,2005, 27(4): 127−137.
[15]Becker I, Salaiza N, Aguirre M, et al.Leishmanialipophosphoglycan (LPG) activates NK cells through Toll-like receptor-2. Mol Biochem Parasitol, 2003, 130(2): 65−74.
[16]Silvestre R, Silva AM, Cordeiro-da-Silva A, et al.The contribution of Toll-like receptor 2 to the innate recognition of aLeishmania infantumsilent information regulator 2 protein. Immunology, 2009,128(4): 484−499.
[17]Singh RK, Srivastava A, Singh N. Toll-like receptor signaling: a perspective to develop vaccine against leishmaniasis. Microbiol Res, 2012, 167(8):445−451.
[18]Fischer J, Suire C, Hale-Donze H. Toll-like receptor 2 recognition of theMicrosporidia Encephalitozoonspp. induces nuclear translocation of NF-κB and subsequent inflammatory responses.Infect Immun, 2008, 76(10): 4737−4744.
[19]Campos MA, Almeida IC, Takeuchi O, et al.Activation of Toll-like receptor-2 by glycosylphosphatidylinositol anchors from a protozoan parasite. J Immunol, 2001, 167(1):416−423.
[20]Ropert C, Gazzinelli RT. Regulatory role of Toll-like receptor 2 during infection withTrypanosoma cruzi. J Endotoxin Res, 2004, 10(6):425−430.
[21]Ouaissi A, Guilvard E, Delneste Y, et al. TheTrypanosoma cruziTc52-released protein induces human dendritic cell maturation, signals via Toll-like receptor 2, and confers protection against lethal infection. J Immunol, 2002, 168(12):6366−6374.
[22]Debierre-Grockiego F, Azzouz N, Schmidt J, et al.Roles of glycosylphosphatidylinositols ofToxoplasma gondii. Induction of tumor necrosis factor-alpha production in macrophages. J Biol Chem, 2003, 278(35): 32987−32993.
[23]Reyes JL, González1 MI, Ledesma-Soto Y. TLR2 mediates immunity to experimental Cysticercosis.Int J Biol Sci, 2011, 7(9): 1323−1333.
[24]Trottein F, Pavelka N, Vizzardelli C, et al. A type I IFN-dependent pathway induced bySchistosoma mansonieggs in mouse myeloid dendritic cells generates an inflammatory signature. J Immunol,2004, 172(5): 3011−3017.
[25]Van der Kleij D, Latz E, Brouwers JFHM, et al. A novel host-parasite lipid cross-talk. Schistosomal lyso-phosphatidylserine activates toll-like receptor 2 and affects immune polarization. J Biol Chem,2002, 277(50): 48122−48129.
[26]Correale J, Farez M. Helminth antigens modulate immune responses in cells from multiple sclerosis patients through TLR2-dependent mechanisms. J Immunol, 2009, 183(9): 5999−6012.
[27]Aksoy E, Zouain CS, Vanhoutte F, et al. Double stranded RNAs from the helminth parasiteSchistosomaactivates TLR3 in dendritic cells. J Biol Chem, 2005, 280(1): 277−283.
[28]Zariffard MR, Harwani S, Novak RM, et al.Trichomonas vaginalisinfection activates cells through Toll-like receptor 4. Clin Immunol, 2004,111(1): 103−107.
[29]Jenkins SJ, Hewitson JP, Bernard FS, et al.Schistosome larvae stimulate macrophage cytokine production through TLR4 dependent and independent pathways. Int Immunol, 2005, 17(11):1409−1418.
[30]Liese J, Schleicher U, Bogdan C. The innate immune response againstLeishmania parasites.Immunobiology, 2008, 213(3/4): 377−387.
[31]Abou Fakher FH, Rachinel N, Klimczak M, et al.TLR9-dependent activation of dendritic cells by DNA fromLeishmaniamajor favors Th1 cell development and the resolution of lesions. J Immunol, 2009, 182(3): 1386−1396.
[32]Gallego C, Golenbock D, Gomez MA, et al.Toll-like receptors participate in macrophage activation and intracellular control ofLeishmania(Viannia) panamensis. Infect Immun, 2011, 79(7):2871−2879.
[33]Ropert C, Franklin BS, Gazzinelli RT, et al. Role of TLRs/MyD88 in host resistance and pathogenesis during protozoan infection: lessons from malaria.Semin Immunopathol, 2008, 30(1): 41−51.
[34]Harris TH, Cooney NM, Mansfield JM, et al.Signal transduction, gene transcription, and cytokine production triggered in macrophages by exposure to trypanosome DNA. Infect Immunol,2006, 74(8): 4530−4537.
[35]Shimosato T, Kitazawa H, Katoh S, et al.Augmentation of T(H)-1 type response by immunoactive AT oligonucleotide from lactic acid bacteria via Toll-like receptor 9 signaling. Biochem Biophys Res Commun, 2005, 326(4): 782−787.
[36]Coban C, Ishii KJ, Kawai T, et al. Toll-like receptor 9 mediates innate immune activation by the malaria pigment hemozoin. J Exp Med, 2005,201(1): 19−25.
[37]Coban C, Igari Y, Yagi M, et al. Immunogenicity of whole parasite vaccines againstPlasmodium falciparuminvolves malarial hemozoin and host TLR9. Cell Host Microbe, 2010, 7(1): 50−61.
[38]Parroche P, Lauw FN, Goutagny N, et al. Malaria hemozoin is immunologically inert but radically enhances innate responses by presenting malaria DNA to Toll-like receptor 9. Proc Natl Acad Sci USA, 2007, 104(6): 1919−1924.
[39]Griffith JW, Sun T, McIntosh MT, et al. Pure hemozoin is inflammatoryin vivoand activates the NALP3 inflammasome via release of uric acid. J Immunol, 2009, 183(8): 5208−5220.
[40]Hisaeda H, Tetsutani K, Imai T, et al. Malaria parasites require TLR9 signaling for immune evasion by activating regulatory T cells. J Immunol, 2008, 180(4): 2496−2503.
[41]Kucera K, Koblansky AA, Saunders LP, et al.Structure based analysis ofToxoplasma gondiiprofilin a parasite specific motif is required for recognition by Toll-like receptor 11. J Mol Biol,2010, 403(4): 616−629.
[42]Yarovinsky F, Kanzler H, Hieny S, et al. Toll-like receptor recognition regulates immunodominance in an antimicrobial CD4+T cell response. Immunity,2006, 25(4): 655−664.
[43]Yarovinsky F, Zhang D, Andersen J F, et al. TLR11 activation of dendritic cells by a protozoan profilin-like protein. Science, 2005, 308(5728):1626−1629.
[44]Yarovinsky F, Hieny S, Sher A. Recognition ofToxoplasma gondiiby TLR11 prevents parasite-induced immunopathology. J Immunol,2008, 181(12): 8478−8484.
[45]Pifer R, Benson A, Sturge CR, et al. UNC93B1 is essential for TLR11 activation and IL-12-dependent host resistance toToxoplasma gondii. J Biol Chem, 2011, 286(5): 3307−3314.
[46]Melo MB, Kasperkovitz P, Cerny A, et al.UNC93B1 mediates host resistance to infection withToxoplasma gondii. PLoS Pathog, 2010, 6(8):e1001071.
[47]Denkers EY. Toll-like receptor initiated host defense againstToxoplasma gondii. J Biomed Biotechnol, 2010, 2010: 737125.
[48]Caetano BC, Carmo BB, Melo MB, et al.Requirement of UNC93B1 reveals a critical role for TLR7 in host resistance to primary infection withTrypanosoma cruzi. J Immunol, 2011, 187(4):1903−1911.
[49]Rodrigues MM, Oliveira AC, Bellio M. The immune response toTrypanosoma cruzi: role of toll-like receptors and perspectives for vaccine development. J Parasitol Res, 2012, 2012: 1−12.
[50]Jiang YY, Xue XY, Chen XP, et al. Hemozoin fromSchistosoma japonicumdoes not affect murine myeloid dendritic cell function. Parasitol Res,2010, 106(3): 653−659.
May 29, 2012; Accepted: August 28, 2012
Zhizhong Jing. Tel: +86-931-8341979; E-mail: zhizhongj@yahoo.com.cn
国家自然科学基金 (No. 30871884),国家高技术研究发展计划 (863计划) (No. 2011AA10A211) 资助。
Innate immune recognition of the pathogenic parasites by Toll-like receptors
Xiaobing He, Huaijie Jia, and Zhizhong Jing
State Key Laboratory of Veterinary Etiological Biology,Key Laboratory of Veterinary Public Health of Ministry of Agriculture,Lanzhou Veterinary Research Institute,CAAS,Lanzhou730046,Gansu,China
Toll-like receptors (TLRs) have emerged as major receptor components of pattern-recognition receptors(PRRs), which are responsible for the recognition of pathogen-associated molecular patterns (PAMPs)-derived pathogenic parasites. This recognition triggers the secretion of a large amount of type I interferons (IFNs), inflammatory cytokines, and chemokines and maturation of immune cells, for effective host defense by eradicating infectious parasites. Both the myeloid differentiation factor 88 (MyD88) and the TIR domain containing the adaptor molecule (TRIF) are involved in these signaling pathways. Here, we review the latest fi ndings on the recognition of the pathogenic parasites and activation of corresponding signaling pathways through TLRs, with special emphasis on the recognition of pathogenic protozoan and helminthes. By highlighting recent progress in these areas, we hope to provide references in future studies not only for the complexity of host-parasite interactions but also for the prevention of the pathogenic parasite infections.
innate immunity, pattern-recognition receptors, pathogen-associated molecular patterns, Toll-like receptors,pathogenic parasites
Supported by: National Natural Science Foundation of China (No. 30871884), National High Technology Research and Development Program of China (863 Program) (No. 2011AA10A211).