λpL/pR-cI857温控系统的改造及其对大肠杆菌菌蜕制备的影响
2012-09-03董洪亮韩先干白灏何亮刘蕾刘瑞柴同杰丁铲刘海文于圣青
董洪亮,韩先干,白灏,何亮,刘蕾,刘瑞,柴同杰,丁铲,刘海文,于圣青
1 山东农业大学动物科技学院,山东 泰安 2710002 中国农业科学院上海兽医研究所,上海 200241
λpL/pR-cI857温控系统的改造及其对大肠杆菌菌蜕制备的影响
董洪亮1,2,韩先干2,白灏2,何亮2,刘蕾2,刘瑞2,柴同杰1,丁铲2,刘海文2,于圣青2
1 山东农业大学动物科技学院,山东 泰安 271000
2 中国农业科学院上海兽医研究所,上海 200241
董洪亮, 韩先干, 白灏, 等. λpL/pR-cI857温控系统的改造及其对大肠杆菌菌蜕制备的影响. 生物工程学报, 2012,28(12): 1423−1430.
Dong HL, Han XG, Bai H, et al. Mutation of λpL/pR-cI857 system for production of bacterial ghost inEscherichia coli. Chin J Biotech, 2012, 28(12): 1423−1430.
菌蜕是革兰氏阴性菌在噬菌体Phix174的溶菌基因E的作用下形成的细菌空壳,通常由λpL/pR-cI857温控系统通过调控E基因的表达制备。通过重叠PCR技术,将λpL/pR-cI857温控系统中λpR启动子的第2个操纵基因 (OR2) 的第9位碱基由T突变为C (T→C)。溶菌试验结果表明,突变后的λpL/pR-cI857系统在37 ℃时仍能稳定抑制基因E的表达,对大肠杆菌的溶菌率为99.9%。通过对λpR启动子的改造,扩大了λpL/pR-cI857温控系统的温度调控范围,为菌蜕疫苗的研制提供了参考。
大肠杆菌,菌蜕,重叠PCR,突变
菌蜕 (Bacterial ghost) 是通过PhiX174噬菌体溶菌基因E的可调控表达而形成的缺少细胞浆和核酸且无繁殖能力的革兰氏阴性细菌空壳[1]。溶菌基因E编码91个氨基酸的疏水蛋白,它能在革兰氏阴性细菌细胞膜上形成一个直径约为40~200 nm的特异性的跨膜孔道,在渗透压的作用下使革兰氏阴性细菌的胞质内含物由孔道排出,从而形成不含核酸、核糖体及其他组分的细菌空壳[2-6]。菌蜕作为一种新型的疫苗,与传统的灭活疫苗相比,菌蜕保持了细菌原有的细胞形态、细菌表面抗原结构和黏附性等特性,因而能诱导机体产生更强的体液免疫、细胞免疫以及黏膜免疫[7-10]。
通常用 λpL/pR-cI857温控制系统控制溶菌基因E的表达来制备菌蜕。这一温控系统在高于30 ℃时,阻遏蛋白cI857因热失活,并引起E基因的表达,在42 ℃时达到最佳的细菌溶菌效果[11]。但在菌蜕制备过程中存在两点不足,一是溶菌前细菌需要在30 ℃以下进行培养,不利于细菌的大量生产。二是温度由 30 ℃突然转为42 ℃时,热冲击容易对抗原决定簇结构造成影响。本实验通过定点突变技术,使λpR启动子的第2个操纵基因 (OR2) 的第9位碱基由T突变为C (T→C),突变后的λpL/pR-cI857系统在37 ℃时仍能稳定抑制基因 E的表达,而当温度达到39 ℃~42 ℃时开始诱导溶菌。本研究通过对λpL/pR-cI857系统的优化,成功解决菌蜕制备过程中存在的不足,为进一步研究菌蜕疫苗提供参考。
1 材料与方法
1.1 质粒、菌株及试剂
pUC19-cI857-E-rrnB溶菌质粒由本实验室构建保存[12]。大肠杆菌DH5α感受态细胞购自天根生物技术有限公司,鸭源禽致病性大肠杆菌DE17株由本实验室分离保存[13]。
限制性内切酶SphⅠ和PstⅠ购自宝生物技术有限公司。普通质粒小提试剂盒购自天根生物技术有限公司。GenJETTMPCR Extraction Kit购自 Fermentas。2×TaqPCR Master Mix,DNA Ligation Kit,DNA marker 5000以及pUC19载体购自TaKaRa公司。
1.2 溶菌表达盒cI857-E-rrnB的扩增
用引物cI857-F/rrnB-R (表1) 扩增溶菌质粒pUC19-cI857-E-rrnB中长度为1 589 bp的溶菌表达盒cI857-E-rrnB。
1.3 溶菌表达盒的点突变
cI857-E-rrnB溶菌表达盒中的λpR启动子有3个操纵基因 (ORs),其中第 2个操纵基因(OR2) 序列为 5′-TAACACCGTGCGTGTTG-3′[14]。对其第9位点进行定点突变 (图1)。
以本实验室构建的 pUC19-cI857-E-rrnB为模板,以cI857-F/cI857-mutR为引物扩增大小为783 bp的ΔcI857-E片段,以cI857-mutF/rrnB-R为引物扩增大小为806 bp的ΔcI857-rrnB片段。PCR产物用GenJETTMPCR Extraction Kit试剂盒回收。以回收的 ΔcI857-E (模板 1) 片段和ΔcI857-rrnB (模板2) 片段同时作为模板,用引物cI857-F/rrnB-R扩增大小为 1 589 bp的 ΔcI857-E-rrnB片段。PCR的反应条件为:95 5℃ min;98 10℃ s,55 5℃ s,72 2℃ min,35个循环;72 ℃延伸10 min。PCR产物经琼脂糖凝胶电泳检测,用DNA凝胶回收试剂盒回收。
1.4 溶菌表达质粒的构建
用限制性内切酶SphⅠ和PstⅠ对纯化的ΔcI857-E-rrnB片段和pUC19载体进行酶切、连接后,转化大肠杆菌DH5α,用含100 μg/mL Amp的LB固体培养基进行筛选。将PCR鉴定为阳性的克隆,转接到含100 μg/mL Amp的LB液体培养基,提取质粒进行酶切、测序鉴定,阳性质粒命名为pUC19-ΔcI857-E-rrnB。
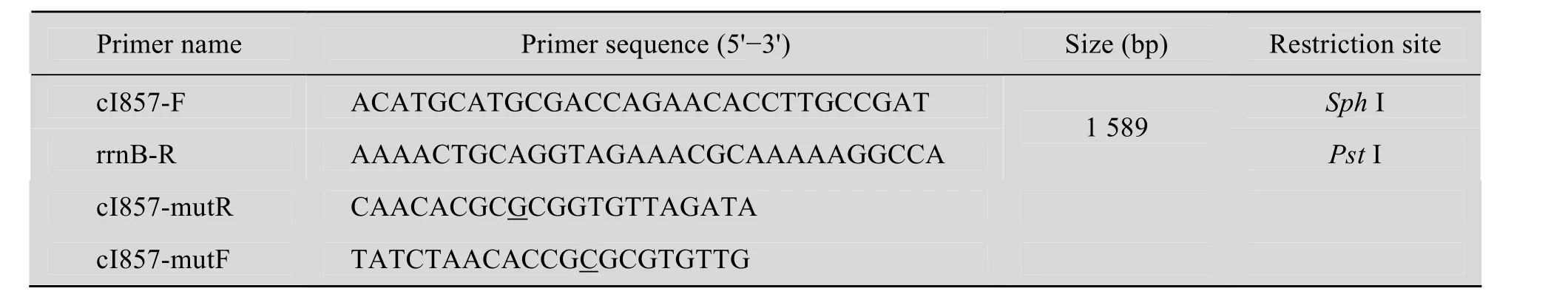
表1 本研究中PCR扩增所用引物序列Table 1 Primer sequence for PCR amplification in this study
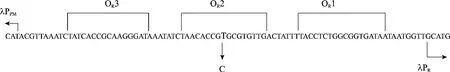
图1 点突变示意图Fig. 1 Operator/promoter sequence of the mutated rightward λpR promoter.
1.5 溶菌实验
将质粒 pUC19-cI857-E-rrnB、pUC19-ΔcI857-E-rrnB以及pUC19分别转化大肠杆菌DH5α中,并将质粒pUC19-ΔcI857-E-rrnB转化本实验室分离的禽致病性大肠杆菌DE17中,挑取上述转化中的阳性克隆,分别在 28 ℃和 37 ℃培养至OD600=0.4后,转至42 ℃培养,每隔20 min取100 μL菌液测其OD600,绘制溶菌曲线。
分别取上述42 ℃诱导0 h和4 h后的菌液100 μL,10倍稀释后,接种到含 100 μg/mL Amp的 LB固体培养基上。培养过夜后进行活菌计数,每个稀释度3个重复。计算细菌溶菌效率,计算公式为:溶菌率=(1−诱导后 CFU/诱导前CFU) ×100%。
2 结果
2.1 溶菌质粒pUC19-ΔcI857-E-rrnB的构建
以cI857-F/cI857-mutR为引物,成功扩增大小为 783 bp的 ΔcI857-E片段 (图 2,泳道 1),以 cI857-mutF/rrnB-R为引物,成功扩增大小为806 bp 的 ΔcI857-rrnB (图 2,泳道 3),以cI857-F/rrnB-R为引物,运用重叠PCR技术,成功扩增大小为 1 589 bp的溶菌表达盒ΔcI857-E-rrnB片段 (图2,泳道5)。
对构建的溶菌质粒pUC19-ΔcI857-E-rrnB进行双酶切鉴定,结果在预期位置 (1 589 bp处)出现目的条带,表明溶菌表达盒 ΔcI857-E-rrnB成功克隆至pUC19 (图3)。
对pUC19-ΔcI857-E-rrnB的测序结果表明,λpR启动子中操纵基因的OR2 的第9位碱基成功地由T诱变为C (T→C) (图4)。
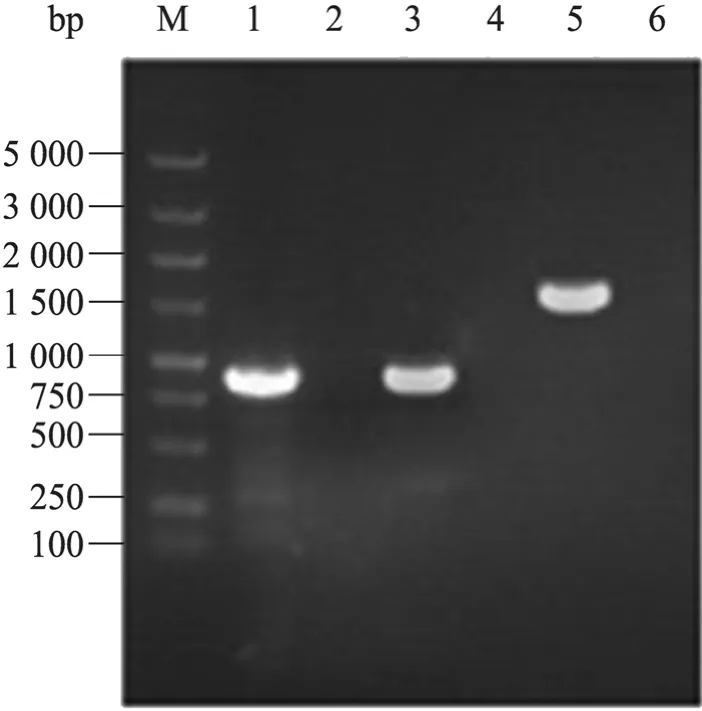
图2 PCR扩增ΔcI857-E-rrnBFig. 2 PCR amplification of ΔcI857-E-rrnB. M: DNA marker DL-2000; 1: PCR product of ΔcI857-E; 3: PCR product of ΔcI857-rrnB; 5: PCR product of ΔcI857-E-rrnB; 2,4,6: negative control.
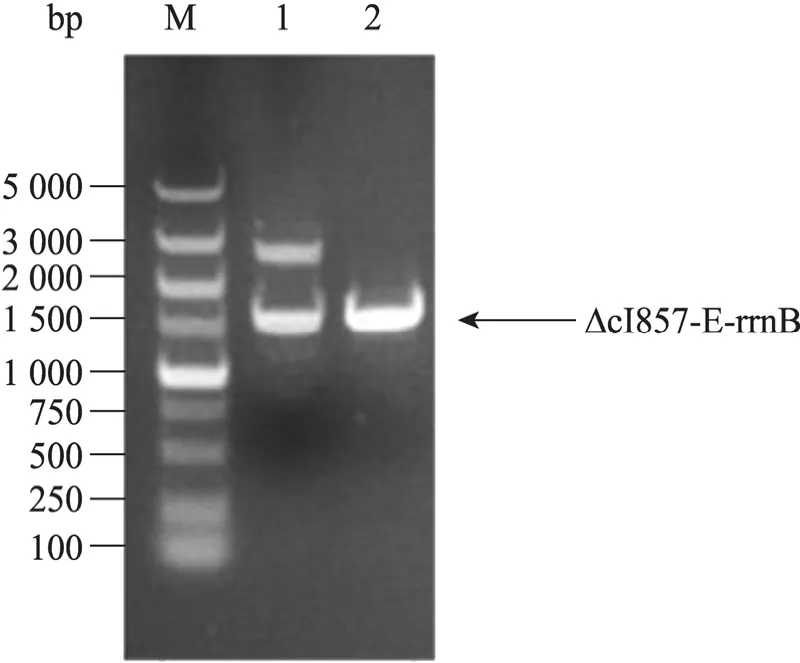
图3 pUC19-ΔcI857-E-rrnB双酶切鉴定Fig. 3 Degestion analysis of plasmid pUC19-ΔcI857-E-rrnB. M: DNA marker DL-5000; 1: pUC19-ΔcI857-E-rrnB digested with Sph I and Pst I; 2: PCR product of ΔcI857-E-rrnB.
2.2 大肠杆菌溶菌动力学比较
转化溶菌质粒pUC19-cI857-E-rrnB和pUC19-ΔcI857-E-rrnB的大肠杆菌DH5α在28 ℃培养至OD600值约为0.4后,转入42 ℃培养80 min后DH5α的OD600值均达到约0.9,随后开始下降,培养200 min后,OD600值降至约0.2后保持不变。而含有pUC19的大肠杆菌DH5α的OD600值一直增加约1.3后,维持不变 (图5)。
转化溶菌质粒pUC19-ΔcI857-E-rrnB的大肠杆菌DH5α和禽致病性大肠杆菌DE17,在37 ℃培养至OD600值约为0.4后,转入42 ℃培养,其OD600值均持续增大,60 min后,OD600达到约1.0,随后开始下降,培养200 min后,OD600值降至约 0.7后保持不变。而转化溶菌质粒pUC19-cI857-E-rrnB的大肠杆菌DH5α,在37 ℃培养直至OD600值约为0.4后,转入42 ℃培养,OD600值在60 min后达到约0.6,随后一直维持稳定 (图6)。转化质粒pUC19的大肠杆菌DH5α,其OD600值在从37 ℃转为42 ℃后,一直上升直至达到平台期 (OD600=1.3)。
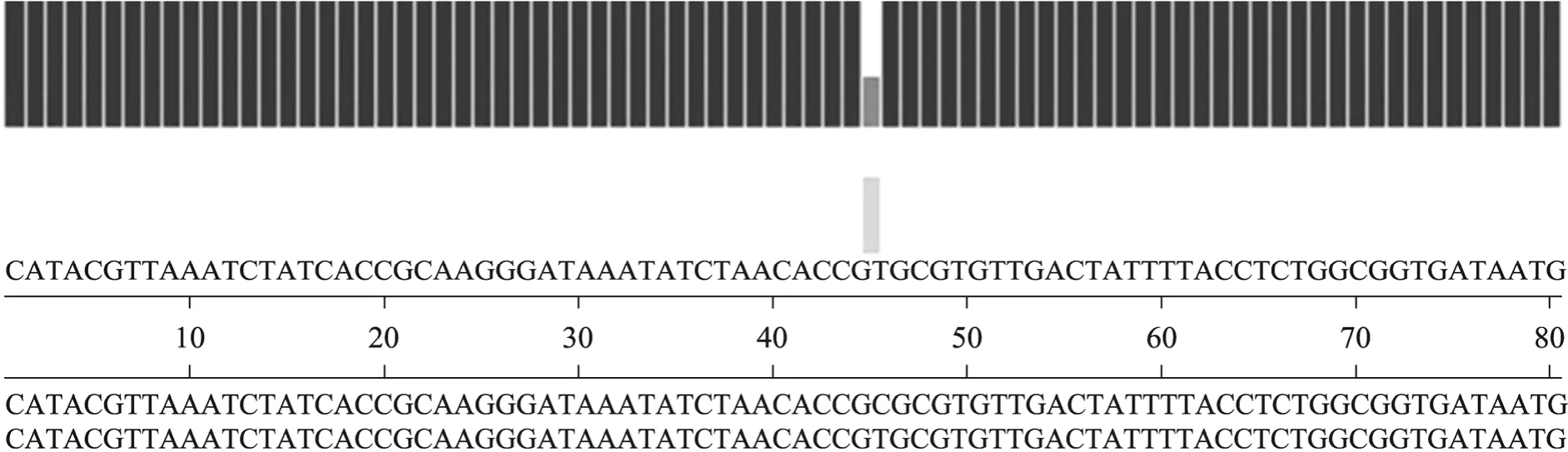
图4 点突变测序图谱Fig. 4 Mutated identification by DNA sequencing.
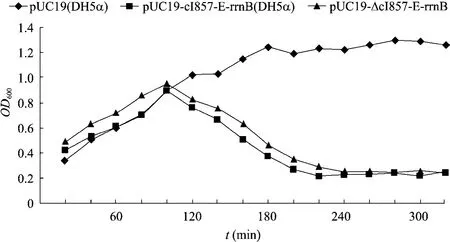
图5 大肠杆菌溶菌动力学曲线 (28 ℃培养)Fig. 5 Growth and lysis curves of bacteria (28 ℃).
2.3 不同诱导温度对溶菌率的影响
转化溶菌质粒pUC19-cI857-E-rrnB和pUC19-ΔcI857-E-rrnB的大肠杆菌DH5α,在28 ℃培养至OD600值为0.4,转入42 ℃诱导4 h后,溶菌率都可达到99.95%。
转化溶菌质粒pUC19-cI857-E-rrnB和pUC19-ΔcI857-E-rrnB的大肠杆菌DH5α,在37 ℃培养至OD600值为0.4,转入42 ℃诱导4 h后,溶菌率分别为61.53%和99.94%。
转化溶菌质粒pUC19-ΔcI857-E-rrnB的禽致病性大肠杆菌DE17,在37 ℃培养至OD600值为0.4,转入42 ℃诱导4 h后,溶菌率为99.93% (表2)。
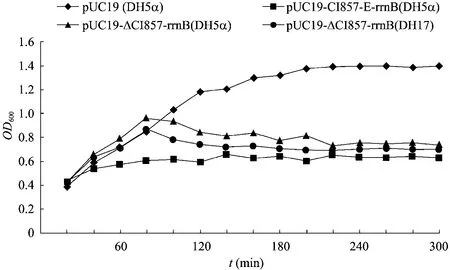
图6 大肠杆菌溶菌动力学曲线 (37 ℃培养)Fig. 6 Growth and lysis curves of bacteria (37 ℃).
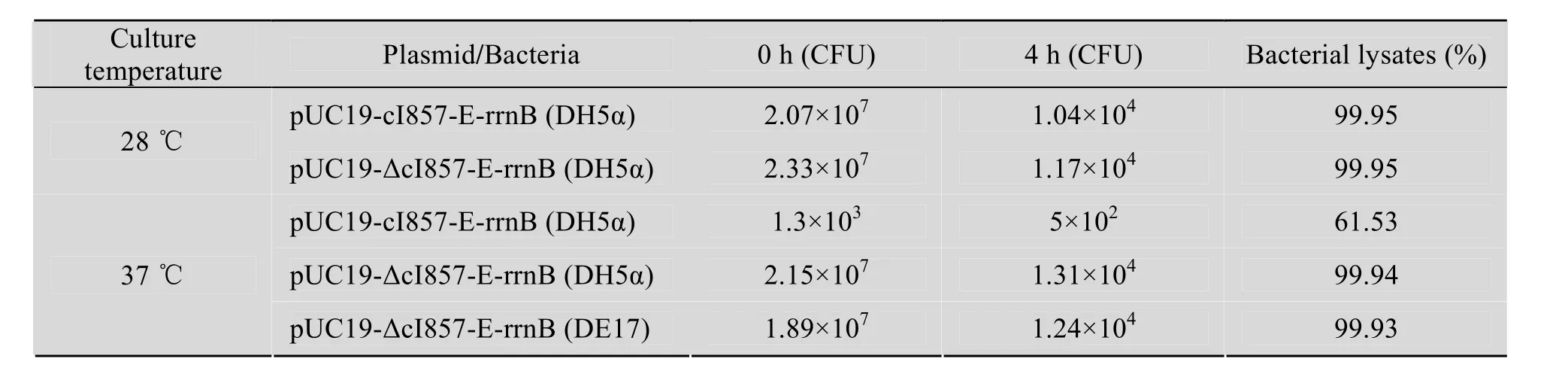
表2 不同温度对溶菌质粒溶菌效率的比较Table 2 Comparison of the efficiency of bacterial lysates
3 讨论
与常规疫苗相比,菌蜕具有与活菌相同功能的膜抗原结构,可诱导机体同时产生体液免疫和细胞免疫。此外,菌蜕成本低廉,易于大规模生产,且制成的冻干苗在室温下即可长时间保存,免疫时也无需加入佐剂,因其本身就具有佐剂的性质。包括大肠杆菌在内,目前许多革兰氏阴性菌均能在溶菌基因 E的作用下产生菌蜕[15-17]。如:多杀性巴氏杆菌菌蜕,霍乱弧菌菌蜕,沙门氏菌菌蜕等,用多杀性巴氏杆菌菌蜕免疫家兔,可以抵抗同源细菌的感染[18-19];用霍乱弧菌菌蜕腹腔注射免疫小鼠,可产生霍乱弧菌特异性IgG反应和高效价抗体[20-21];用沙门氏菌菌蜕和传统的灭活菌免疫家禽,攻毒后发现菌蜕组表现出完全的免疫力,而灭活组仍携带有致病菌[22-23]。正是由于菌蜕具有如此多的优点,使得菌蜕日益成为当前疫苗研究的热点。
目前,通常运用 λpL/pR-cI857转录调控系统,来实现Phix174的溶菌基因E可控表达的。但在菌蜕制备过程中存在两点不足,一是溶菌前细菌需要在30 ℃以下进行培养,不利于细菌的大量生产。二是温度由30 ℃突然转为42 ℃时,热冲击容易对抗原决定簇结构造成影响。因此,开展对pL/pR-cI857转录调控系统的优化,实现λpL/pR-cI857系统在37 ℃时仍能稳定抑制基因E的表达,解决菌蜕制备过程中存在的不足,为进一步开展菌蜕疫苗的研制提供技术支持,具有重要的经济意义[24]。
本实验通过定点突变技术,使λpR启动子的第2个操纵基因 (OR2) 的第9位碱基由T突变为C (T→C),突变后的λpR系统在37 ℃的高温下仍能稳定抑制基因 E的表达,而当温度达到39 ℃~42 ℃时开始诱导细胞溶菌。溶菌试验结果表明,转化溶菌质粒pUC19-cI857-E-rrnB的大肠杆菌DH5α,在37 ℃培养至OD600值为0.4,转入42 ℃诱导4 h后,溶菌率为61.53%,明显低于其他实验组的溶菌效率。这主要是因为转化溶菌质粒的大肠杆菌DH5α在37 ℃培养时,由于温度已经高于30 ℃,阻遏蛋白cI857失活,E基因已经开始表达,导致大部分细菌在37 ℃已经溶菌死亡。而转化pUC19-ΔcI857-E-rrnB的大肠杆菌DH5α,则可以在37℃的条件下稳定生长,42 ℃诱导后,可以引起细菌的溶菌,生成菌蜕。上述结果表明,通过对λpR启动子的突变,成功实现了λpL/pR-cI857系统在37 ℃时溶菌基因E的抑制作用。
禽大肠杆菌病是由禽致病性大肠杆菌(Avian pathogenicEscherichia coli,APEC) 引起的严重危害家禽养殖业的传染病之一[25]。目前,国内对禽大肠杆菌病的防治除加强管理外,主要采用药物防治,国内尚缺乏自主研制的商品化疫苗。本研究中,APEC的 DE17分离株转化pUC19-ΔcI857-E-rrnB后,在37 ℃的培养条件下,E基因的表达被成功抑制,42 ℃诱导后,生成APEC的菌蜕,为进一步研究APEC的菌蜕疫苗用于该病的防治提供思路。
本研究通过对λpL/pR-cI857系统的优化,使得λpL/pR-cI857系统在37 ℃时仍能稳定抑制基因 E的表达,解决了菌蜕制备过程中存在的不足,为进一步研究菌蜕疫苗提供参考。
[1]Witte A, Lubitz W. Biochemical characterization of PhiX174 protein E-mediated lysis ofEscherichia coli. Eur J Biochem, 1989, 180(2): 393−398.
[2]Witte A, Bläsi U, Halfmann G, et al. Phi X174 protein E-mediated lysis ofEscherichia coli.Biochimie, 1990, 72(2/3): 191−200.
[3]Lubitz W. Bacterial ghosts as carrier and targeting systems. Expert Opin Biol Ther, 2001, 1(5):765−771.
[4]Kudela P, Koller VJ, Lubitza W. Bacterial ghosts(BGs)—Advanced antigen and drug delivery system. Vaccine, 2010, 28(36): 5760−5767.
[5]Mayrhofer P, Tabrizi CA, Walcher P, et al.Immobilization of plasmid DNA in bacterial ghosts. J Control Release, 2005, 102(3): 25−35.
[6]Mader HJ, Szostak MP, Hensel A, et al.Endotoxicity does not limit the use of bacterial ghosts as candidate vaccines. Vaccine, 1997, 15(2):195−202.
[7]Eko FO, Lubitz W, McMillan L, et al. RecombinantVibrio choleraeghosts as a delivery vehicle for vaccinating againstChlamydia trachomatis.Vaccine, 2003, 21(15): 1694−1703.
[8]Mayr UB, Walcher P, Azimpour C, et al. Bacterial ghosts as antigen delivery vehicles. Adv Drug Deliv Rev, 2005, 57(9): 1381−1391.
[9]Pavol K, Susanne P, Ulrike BM, et al. Effective gene transfer to melanoma cells using bacterial ghosts. Cancer Lett, 2008, 262: 54−63.
[10]Tabrizi CA, Walcher P, Mayr UB, et al. Bacterial ghosts-biological particles as delivery systems for antigens, nucleic acids and drugs. Curr Opin Biotechnol, 2004, 15(6): 530−537.
[11]Remaut E, Stanssens P, Fiers W. Plasmid vectors for high efficiency expression controlled by the promoter of coliphage lambda. Gene, 1981, 15(1):81−93.
[12]He L. Production and Immunogenicity of bacterial ghosts from pathogenicEscherichia coliisolated from ducklings[D]. Jiangsu: Yangzhou University,2011.
何亮. 鸭致病性大肠杆菌菌蜕的制备及其免疫原性研究[D]. 江苏: 扬州大学, 2011.
[13]Cheng WJ, Han XG, He L, et al. Characterization of duck pathogenicEscherichia coli.Chin J Animal Infect Disea, 2010, 18(2): 34−40.
陈文静, 韩先干, 何亮, 等. 鸭致病性大肠杆菌的分离鉴定及其生物学特性分析. 中国动物传染病学报, 2010, 18(2): 34−40.
[14]Jechlinger W, Szostak M, Witte A, et al. Altered temperature induction sensitivity of the lambda PR/cI857 system for controlled gene E-expression inEscherichia coli. FEMS Microbiol Lett, 1999,173(2): 347−352.
[15]Szostak MP, Hensel A, Eko FO, et al. Bacterial ghosts: non-living candidate vaccines. J Biotechnol,1996, 44(1/3): 161−170.
[16]Eko FO, Mayr UB, Attridge SR, et al.Characterization and immunogenicity ofVibrio choleraeGhosts expressing toxin-coregulated pili.J Biotechnol, 2000, 83(1/2): 115−123.
[17]Haslberger AG, Kohl G, Felnerova D, et al.Activation, stimulation and uptake of bacterial ghosts in antigen presenting cells. J Biotechnol,2000, 83(1/2): 57−66.
[18]Marchart J, Dropmann G, Lechleitner S, et al.Pasteurella multocida-andPasteurella haemolyticaghosts: new vaccine candidates, Vaccine, 2003,21(25/26): 3988−3997.
[19]Huter V, Hensel A, Brand E, et al. Improved protection against lung colonization byActinobacillus pleuropneumoniaeghosts:characterization of a genetically inactivated vaccine. J Biotechnol, 2000, 83(1/2): 161−172.
[20]Eko FO, Schukovskaya T, Lotzmanova EY, et al.Evaluation of the protective efficacy of Vi briocholerae ghost (VCG) candidate vaccines in rabbits. Vaccine, 2003, 21(25/26): 3663−3674.
[21]Eko FO, Hensel A, Bunka S, et al. Immunogenicity ofVibrio choleraeghosts following intraperitoneal immunization of mice. Vaccine, 1994, 12(14):1330−1334.
[22]Petra W, Xianlan C, Jane AA, et al. Bacterial ghosts as a delivery system for zona pellucida-2 fertility control vaccines for brushtail possums(Trichosurus vulpecula). Vaccine, 2008, 26:6832−6838.
[23]Jawale CV, Chauhari AA, Jron BW, et al.Characterization of a novel inactivatedSalmonella entericaserovar enteritidis vaccine candidate generated using a modified cI857/λ PR/GeneEexpression system. Infect Immun, 2012, 8(4):1502−1509.
[24]Kudela P, Koller VJ, Mayr UB, et al. Bacterial Ghosts as antigen and drug delivery system for ocular surface diseases: effective internalization of Bacterial Ghosts by human conjunctival epithelial cells. J Biotechnol, 2011, 153(3/4): 167−175.
[25]Kaper JB, Nataro JP, Mobley HL. PathogenicEscherichia coli. Nat Rev Microbiol, 2004, 2(2):123−140.
August 4, 2012; Accepted: September 28, 2012
Shengqing Yu. Tel: +86-21-34293461; E-mail: yus@shvri.ac.cn Xian’gan Han. Tel: +86-21-34293412; E-mail: hanxgan@163.com
国家自然科学基金 (Nos. 31001078,31072161,30871851) 资助。
Mutation of λpL/pR-cI857 system for production of bacterial ghost inEscherichia coli
Hongliang Dong1,2, Xian’gan Han2, Hao Bai2, Liang He2, Lei Liu2, Rui Liu2, Tongjie Chai1,Chan Ding2, Haiwen Liu2, and Shengqing Yu2
1School of Animal Science and Technology,Shandong Agricultural University,Taian271100,Shandong,China
2Shanghai Veterinary Research Institute,Chinese Academy of Agricultural Sciences,Shanghai200241,China
Bacterial ghost is intact envelope of Gram-negative bacteria, which is produced by the function of the lysis gene E from bacteriophage PhiX174. The expression of the lysis gene E is usually controlled by the thermosensitive λpL/pR-cI857 promoter. In this study, we described a mutation (T→C) at the ninth nucleotide of the OR2 in the λpR promoter of the λpL/pR-cI857 system by overlap PCR. The bacteriolytic assay showed that the mutation in the λpL/pR-cI857 system enhanced the temperature of repressing the expression of gene E up to 37 ℃ . The lysis efficiency of altered λpR promoter inEscherichia coliDH5α and avian pathogenicE. coliDE17 was up to 99.9%. The expanded range of temperature will benefit for the production of bacterial ghost.
Escherichia coli, bacterial ghosts, overlap PCR, mutation
Supported by: National Natural Science Foundation of China (Nos. 31001078, 31072161, 30871851).