大黄鱼三种病原弧菌外膜蛋白交叉保护性抗原筛选
2012-09-03张崇文毛芝娟于涟
张崇文,毛芝娟,于涟
1 上海市水产研究所,上海 2004332 浙江万里学院,浙江 宁波 3151003 浙江大学动物科学学院,浙江 杭州 310058
大黄鱼三种病原弧菌外膜蛋白交叉保护性抗原筛选
张崇文1,毛芝娟2,于涟3
1 上海市水产研究所,上海 200433
2 浙江万里学院,浙江 宁波 315100
3 浙江大学动物科学学院,浙江 杭州 310058
张崇文,毛芝娟,于涟. 大黄鱼三种病原弧菌外膜蛋白交叉保护性抗原筛选. 生物工程学报, 2012, 28(12): 1460−1472.
Zhang CW, Mao ZJ, Yu L. Selection of cross-protective antigens from outer membrane proteins of three pathogenic vibrios isolated from infected large yellow croaker (Pseudosciaena crocea). Chin J Biotech, 2012, 28(12): 1460−1472.
弧菌是海水养殖环境中常见的条件性致病菌,弧菌病的暴发给水产养殖业造成了严重损失。鉴于水生动物尤其是鱼类弧菌病的发生常常是多种 (血清型或亚种) 弧菌的混合感染,筛选具有潜在的交叉保护性蛋白抗原,作为制备多价疫苗或联合疫苗的侯选成分具有重要意义。文中从患病大黄鱼中分离到8株弧菌,经生理生化和分子生物学鉴定分别为6株哈维氏弧菌Vibrio harveyi,1株溶藻弧菌Vibrio alginolyticus和1株副溶血弧菌Vibrio parahaemolyticus。选择典型的不同种的弧菌为代表,提取其外膜蛋白,经SDS-PAGE和Western blotting分析,确定它们大约在45 kDa、35 kDa、22 kDa处出现了3条共同的免疫印迹条带,表明它们很有可能含有共同的能够彼此交叉保护的抗原。利用双向电泳和免疫印迹相结合的方法,借助于MALDI-TOF-MS质谱分析技术,发现溶藻弧菌V. alginolyticus的一种功能未知的孔蛋白 (Porin, GenBank Accession No. ZP_01260407)和副溶血弧菌V. parahaemolyticus的一种麦芽糖孔蛋白的前体蛋白 (Maltoporin precursor,GenBank Accession No. NP_801154) 能够和哈维氏弧菌V. harveyi全菌多抗产生免疫反应,表明这两种蛋白可以作为3种弧菌的交叉保护性抗原,以此制备的疫苗可望对3种弧菌的感染产生交叉保护作用。
弧菌,鉴定,外膜蛋白,交叉保护性抗原
弧菌是海洋环境中最常见的一类条件致病菌,属于弧菌科弧菌属,是一类革兰氏阴性、具极生鞭毛、能运动、无芽胞的短杆状细菌。目前已知弧菌属至少包括202个种[1]。近年来,随着养殖水域生态环境的恶化,弧菌已成为海水养殖动物的主要病原菌之一。已报道的海水养殖动物病原弧菌有 20多种[2],主要有哈维氏弧菌V. harveyi、溶藻弧菌V. alginolyticus、副溶血弧菌V. parahaemolyticus、创伤弧菌V. vulnificus、鳗弧菌V. anguillarum和费氏弧菌V. fischeri等,其中,哈维氏弧菌、溶藻弧菌和副溶血弧菌是海洋生物尤其是海水鱼类弧菌病的主要致病菌[2-5]。
与其他病原菌一样,弧菌的致病性取决于与宿主细胞的相互作用,致病过程也包括黏附、侵袭、体内增殖及产生毒素等系列过程[6]。现已明确,外膜蛋白 (Outer membrane protein,OMP)与弧菌的黏附过程密切相关,是重要的致病因子[7]。外膜蛋白是革兰氏阴性细菌细胞壁中所特有的结构,是外膜的重要组成部分。国内外对OMP免疫原性和免疫保护性进行了大量研究,结果证实,外膜蛋白具有良好的免疫原性,可以作为保护性抗原发挥重要作用[8,9]。同时迟发性超敏反应试验也证明,OMP能诱发变态反应,间接证明OMP具有较强的引起细胞介导免疫反应的能力[10]。
研究还发现革兰氏阴性菌的外膜蛋白中存在保守成分,同一种细菌的不同菌株的外膜蛋白图谱很相似,仅有很小的差异,这些差异与菌株的血清型、致病性及生长条件有关[11]。目前,针对多种致病性海洋弧菌的OMP进行了较深入的研究[10,12-16],发现不同弧菌的外膜蛋白表现出一定的交叉免疫反应性,可能形成某些弧菌间的共同抗原,对不同病原弧菌产生交叉保护[17-18]。如果能够确定不同种 (血清型/亚种) 致病性弧菌共同保护性抗原,就可制备出针对不同种、不同血清型弧菌的通用疫苗或亚单位联合疫苗,收到一种疫苗同时预防多种弧菌的良好效果。
本研究从患病大黄鱼上分离得到几株病原菌,经传统生理生化方法和分子生物学方法鉴定,分别为哈维氏弧菌、溶藻弧菌和副溶血弧菌,然后提取它们的外膜蛋白,经 SDS-PAGE和Western blotting分析,发现不同种弧菌的外膜蛋白存在着交叉反应条带,预示着不同种弧菌的某些外膜蛋白具有交叉保护作用。运用免疫蛋白质组学 (Immunoproteomics) 技术,采用双向电泳和传统免疫印迹相结合的方法,将具有免疫反应性的蛋白点通过质谱分析得到肽质量指纹图谱(Peptide mass fingerprinting,PMF),然后据此搜索相关数据库,最终鉴定出这几种病原弧菌株外膜蛋白交叉保护性抗原。
1 材料与方法
1.1 病原菌的分离与鉴定
1.1.1 病原菌的生化鉴定
病原菌分离自患病大黄鱼 (来自浙江省舟山和象山港的海水养殖网箱) 的肝脏、肾脏和脾脏中,经腹腔注射回归感染证实为病原菌。根据生化反应和 API细菌鉴定系统 (法国,梅里埃)对菌株进行初步鉴定。
1.1.2 病原菌的分子生物学鉴定
从TCBS平板上挑选单菌落在2216E海水培养基中28 ℃振荡培养24 h,抽提病原菌DNA。从 GenBank (http://www.ncbi.nlm.nih.gov/) 中获取相关弧菌 HSP60基因序列,利用 ClustalW(http://www.ebi.ac.uk/clustalw/) 软件进行序列比对,根据保守序列设计一对兼并引物。上游引物HSPFP: 5′-AACATGGGYGCRCAAATG-3′;下游引物 HSPRP: 5′-TCTTGTAGCATWGCTTTACG ACG-3′,扩增目标序列。目的片段 (约 600 bp) 割胶回收后直接测序并进行序列比对。联合从GenBank中获取的多种相关弧菌 HSP60基因部分序列,运用 MEGA3.1软件邻接法构建待定弧菌的系统进化树,以确定它们的分类地位并命名。
1.2 哈维氏弧菌灭活及其抗血清制备
选取鉴定明确的哈维氏弧菌典型株接种于Zobell 2216E培养基28 ℃振荡培养过夜,在菌液中加入0.5%福尔马林,置于28 ℃灭活24 h后取样涂TCBS平板检查,确定无细菌生长后作为抗原,皮下多点注射免疫新西兰大白兔,首次免疫每千克兔注射 0.5 mL细菌 (1×109cells/mL) 加0.5 mL弗氏完全佐剂,隔2周加强免疫1次,共2次,加强免疫均用弗氏不完全佐剂乳化,末次加强免疫后2周试血,ELISA检测血清抗体效价,满意后颈动脉放血,离心分离血清,冷冻保存备用。
1.3 Sarcosyl法抽提外膜蛋白
接种鉴定明确的副溶血弧菌和溶藻弧菌于Zobell 2216E培养基,28 ℃振荡培养过夜。离心收获细菌,用20 mmol/L Tris-HCl (pH 7.2) 洗涤2次,沉淀重悬于含有 10 mmol/L EDTA的Tris-HCl中;超声波破碎 (200 W) 2 次;10 000 ×g离心15 min,弃沉淀;48 000×g离心1.5 h,弃上清;沉淀溶于0.5% (W/V) Sarkosyl (上海生工生物工程有限公司) 中,48 000×g离心1.5 h,弃上清;20 mmol/L Tris-HCl 48 000×g 离心 1.5 h,重复2~3次;Bradford法定量。
1.4 凝胶电泳和免疫印迹
配置两块凝胶 (4%浓缩胶,12%分离胶),其中一块胶用考马斯亮兰-R250染色,另一块用于免疫印迹。上样前样品沸水浴5 min,上样量10 μg/孔,120 V恒压电泳2.5~3 h。电泳结束后,凝胶中的外膜蛋白电转印至NC膜上,先后加入兔抗哈维氏弧菌全菌多抗,再加入羊抗兔IgG酶标抗体 (北京鼎国生物技术有限公司),TMB Membrane Substrate显色液 (Cell Signaling Technology,USA) 显色。
1.5 双向电泳
具体步骤按仪器操作说明书进行。抽提的蛋白沉淀用1 mL裂解液溶解,8 000×g离心15 min,取适量上清 (约25 μg蛋白/胶条),与含有DTT的重泡胀液混匀。用2根7 cm胶条 (pH:3~5.6,非线性,Amersham Pharmacia,USA),进行等电聚焦:重泡胀,12 h;200 V,1 h;500 V,1 h;1 000 V,1 h;梯度:1 000~8 000 V,0.5 h;8 000 V,5 h。聚焦结束先后放入平衡液Ⅰ和平衡液Ⅱ中各平衡15 min,再转入Mini-PROTEAN Tetra电泳系统 (Bio-Rad,USA) 进行电泳,结束后两块凝胶 (分析胶和制备胶) 经固定,敏化,漂洗后用硝酸银溶液染色,再经漂洗,显色,最后将分析胶扫描后用Image Master软件分析。
1.6 免疫印迹
采用Trans-Blot转印系统 (Bio-Rad,USA),将分析胶用0.5 mA/cm2恒流转移到NC膜上,5%脱脂奶粉的封闭液中37 ℃封闭1 h,然后在兔抗哈维氏弧菌多克隆抗体 (1∶1 000) 中 37 ℃孵育1 h,TBST漂洗3次,加入用辣根过氧化物酶标记的羊抗兔二抗 (北京鼎国生物技术有限公司,1∶1 000),37 ℃中缓慢孵育1 h。ECL反应试剂盒显色,胶片曝光后透射扫描。
1.7 质谱分析
将制备胶上和免疫印迹对应的蛋白点切下,经无水乙腈脱水,真空干燥,加胰酶 (蛋白质组学测序级) 消化,萃取液萃取。将酶解和萃取后的上清合并,经真空干燥后用 0.1% TFA溶解,与等量基质液混合,取少量混合液进行 MALDI-TOF(Voyager DE-Pro,Applied Biosystems,USA) 质谱分析。将生成的肽指纹图谱用 Data Explorer TM 软件处理后,通过 MASCOT搜索引擎(http://www.matrixscience.com/) 搜索 Swiss-Prot和NCBInr数据库。
2 结果
2.1 病原菌的分离和生理生化鉴定
先后从患病大黄鱼中分离得到8株细菌,经回归感染后确定为致病菌[2-3]。在 TCBS培养基培养 24 h,菌落呈黄色或绿色,菌落直径约2.2~3.5 mm,菌体革兰氏染色阴性,短杆状,可运动,氧化酶反应阳性,对弧菌抑制剂 O/129(150 μg/mL) 敏感,发酵葡萄糖产酸不产气。结合其他生化指标结果,这些菌株属和弧菌属的哈维氏弧菌V. harveyi、溶藻弧菌V. alginolyticus和副溶血弧菌V. parahaemolyticus的生化特征相近,某些生化指标和伯杰氏细菌鉴定手册 (第九版)[19]标准株的特征不一致 (表1),尚不能最后确定为何种弧菌。这些菌株分别命名为V.sp. NB1011、V.sp. NB1012、V.sp. NB1013、V.sp. NB1014、V.sp. NB1015、V.sp. NB1016、V.sp. NB1017、V.sp. NB1018。
2.2 HSP60基因部分序列扩增及系统进化树分析
PCR扩增获得大小约600 bp的HSP60基因特异序列。测序后比对发现V.sp. NB1018和V.sp. NB1014的HSP60基因部分序列完全相同,且生化特征也相同 (表 1),据此认定为同种弧菌。其余几种弧菌的 HSP60 基因部分序列表现出一定的差异性,表明为不同的种/株 (表2)。由系统进化树 (图 1) 可以看出,7株弧菌(V.sp. NB1018和V.sp. NB1014取其一) 分别同各自同种的弧菌聚类。V.sp. NB1011同溶藻弧菌聚为一类;V.sp. NB1013和副溶血弧菌聚为一类;其余各株弧菌都同哈维氏弧菌聚类,说明它们和哈维氏弧菌亲缘关系最接近,属于哈维氏弧菌,尽管它们彼此之间也存在着进化关系上的差异,属于同种不同株 (亚种)。从表2中8株弧菌部分HSP60基因序列差异性比对结果也可以看出,V.sp. NB1011 (溶藻弧菌) 和V.sp. NB1013 (副溶血弧菌) 的 HSP60基因序列无论相互比对还是和其他弧菌比对,同源性都低于90.0%,因而属于不同种;其他6株弧菌间HSP60基因的同源性皆大于95.0%,属同种弧菌,即哈维氏弧菌,证明弧菌 HSP60基因序列种内高度保守,种间差异明显。
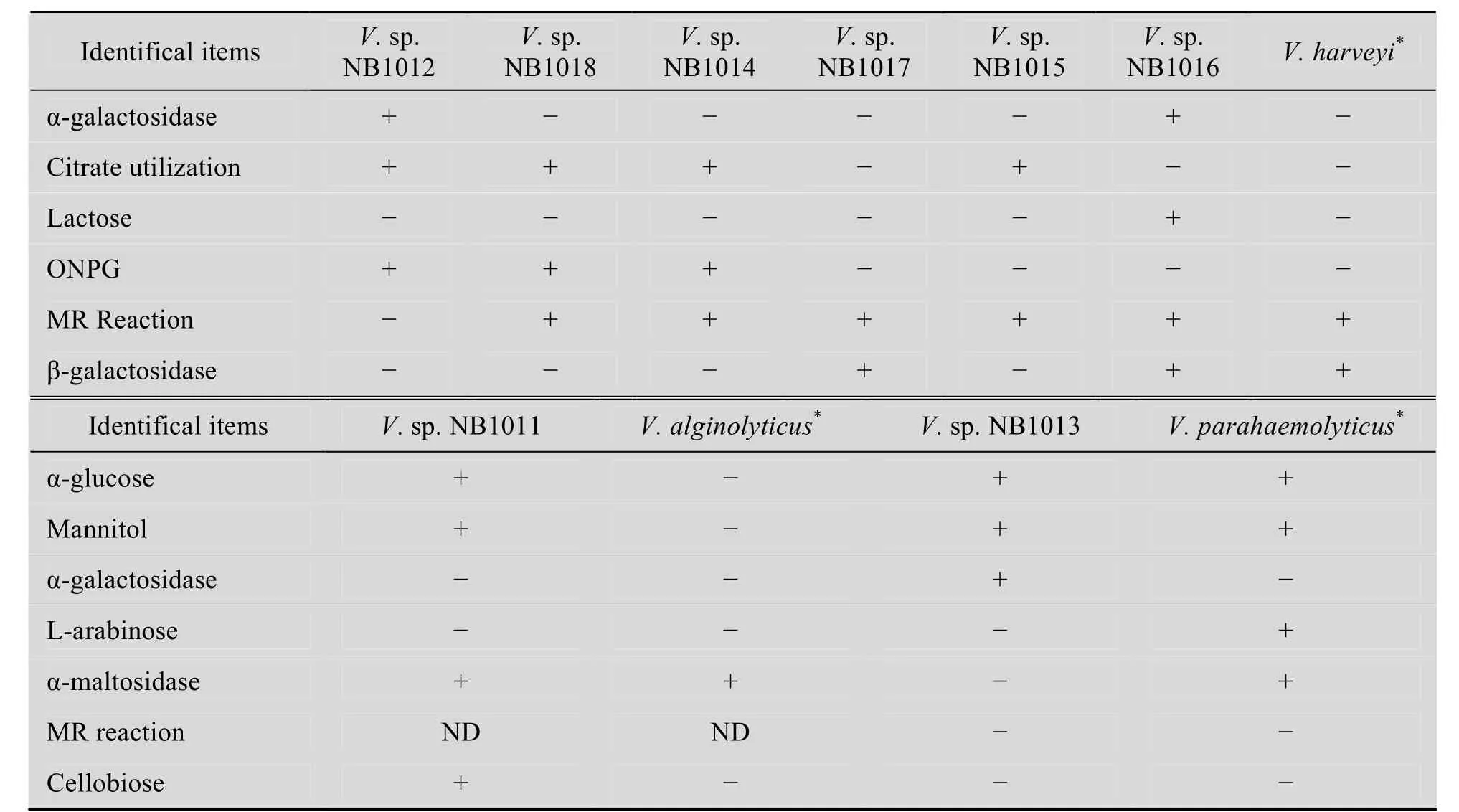
表1 API系统鉴定结果与相应模式菌株结果差异Table 1 Differences of results between API system identification and the corresponding model strains
至此,8株弧菌的分类地位最终得以确定,分别命名为:V. alginolyticusNB1011,V. parahaemolyticusNB1013,V. harveyiNB1012,V. harveyiNB1014,V. harveyiNB1015,V. harveyiNB1016,V. harveyiNB1017,V. harveyiNB1018,其中V. harveyiNB1018和V. harveyiNB1014系同种同株哈维氏弧菌。7株弧菌的HSP60基因部分序列在GenBank登录号为DQ279068-DQ279074。
2.3 哈维氏弧菌的灭活及抗血清效价检测
将哈维氏弧菌 (V. harveyiNB1017株) 用0.5%的福尔马林处理24 h,经检测充分灭活后,用无菌PBS洗涤3次,最后用PBS缓冲液悬浮,免疫新西兰大白兔。哈维氏弧菌全菌抗血清效价根据P/N值来确定,P/N=(被检血清的OD492−空白对照的OD492)/(阴性血清的OD492−空白对照的OD492)。当P/N≥2.1,该点处的最高稀释倍数即为抗血清效价。最终测得哈维氏弧菌全菌抗血清效价为1∶512 000。
2.4 凝胶电泳和免疫印迹
免疫印迹结果表明,多数哈维氏弧菌的外膜蛋白和兔抗哈维氏弧菌全菌多抗都有7~8条免疫印迹带。溶藻弧菌和副溶血弧菌的外膜蛋白分别大约在 45 kDa、35 kDa、22 kDa (图 2) 处出现了3条共同的反应条带,提示这3条蛋白条带包含有3种弧菌的交叉免疫反应条带。
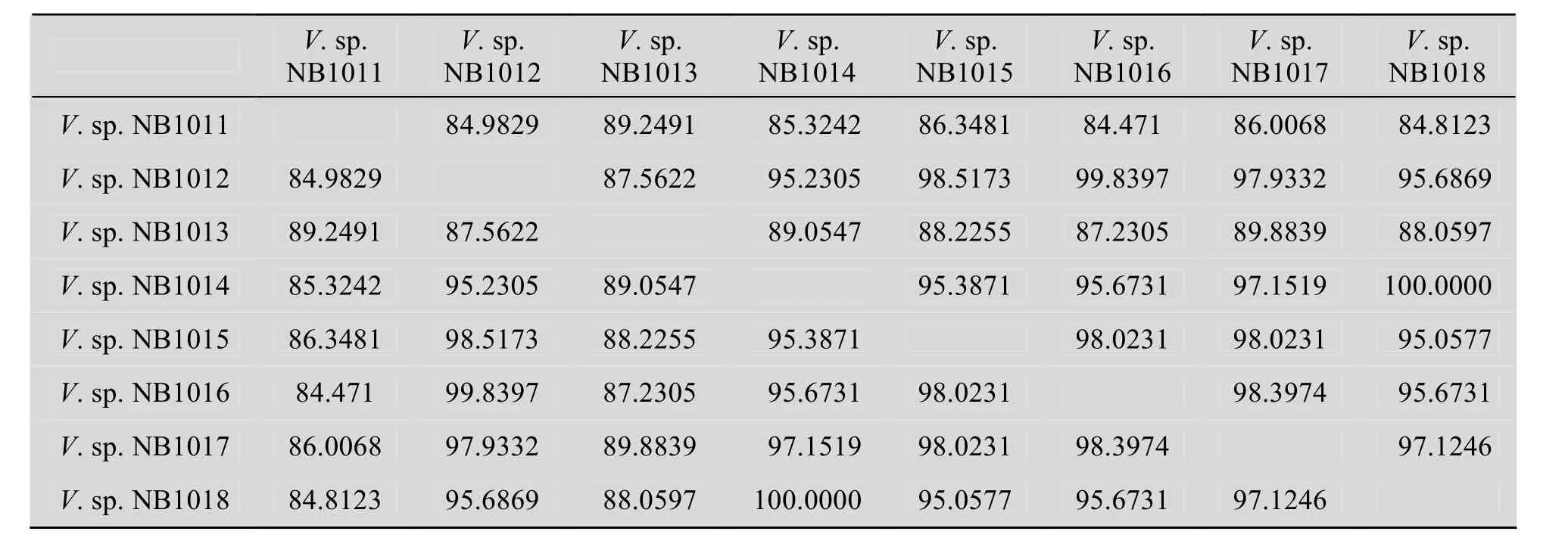
表2 8株弧菌部分HSP60基因序列差异性比对Table 2 Aligned scores of HSP60 partial sequences from 8 Vibrios by CLUSTAL 2.1 multiple sequence alignments
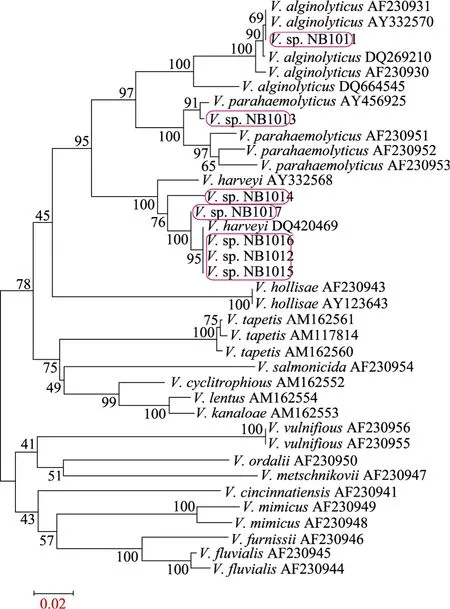
图1 邻接法构建的部分弧菌HSP60基因系统进化树Fig. 1 Neighbour-joining phylogenetic tree of partial Vibrios based on their HSP60 gene.
2.5 双向电泳及免疫印迹结果
从双向电泳结果 (图3、4) 可以看出,溶藻弧菌和副溶血弧菌外膜蛋白的等电点 (pI) 都极度偏酸,大部分集中于3.0~5.0的范围内。分子量大约在10.0~120.0 kDa之间。除去pI小于3.0或大于5.6的蛋白点不计,大概有30~40个蛋白点被按照等电点和分子量大小分开。将分析胶上的蛋白点转印到NC膜上后与兔抗哈维氏弧菌抗血清反应,发现除了分子量在 45 kDa、22 kDa处出现了预期的印迹条带,分别命名为AP1,AP2(溶藻弧菌) 和PP1,PP2 (副溶血弧菌) 。和图2中 SDS-PAGE电泳及 Western blotting结果相比,35 kDa处的印迹条带没有出现,代之以12 kDa左右的条带,命名为AP3 (溶藻弧菌) 和PP3 (副溶血弧菌),这一结果表明,分子量为35 kDa左右的蛋白很有可能是一个三聚体,在双向电泳的过程中三聚体解聚,变成单体形式,即12 kDa左右的条带。
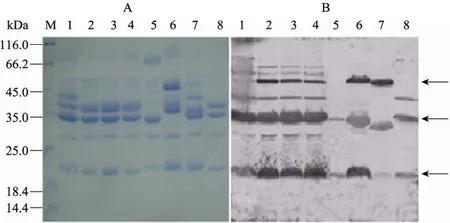
图2 8株弧菌外膜蛋白SDS-PAGE (A) 和Western blotting (B) 结果Fig. 2 SDS-PAGE (A) and Western blotting (B) for the OMPs extracted from eight Vibrios. The primary antibody (at a 1:1 000 dilution) was sera from rabbit vaccinated with the formalin killed V. harveyi NB1017; the secondary antibody(at a 1:1 000 dilution) was alkaline-phosphatase conjugated goat anti-rabbit IgG. M: molecular weight markers; 1:V. harveyi NB1017; 2: V. harveyi NB1012; 3: V. harveyi NB1018; 4: V. harveyi NB1014; 5: V. harveyi NB1015; 6:V. parahaemolyticus NB1013; 7: V. alginolyticus NB1011; 8: V. harveyi NB1016.

图3 副溶血弧菌外膜蛋白双向电泳图谱 (A) 及其与兔抗哈维氏弧菌抗血清的免疫印迹 (B) 结果Fig. 3 2-DE of the OMP from V. parahaemolyticus (A) and the result of Western blotting with anti-V. harveyi serum (B).
2.6 质谱分析结果
从制备胶上切下和免疫印迹相应的蛋白点,经一系列处理后上质谱仪分析,分别获得了溶藻弧菌和副溶血弧菌外膜蛋白AP1和PP1的肽质量指纹图谱。通过 MASCOT搜索相关数据库,结果表明外膜蛋白 AP1是溶藻弧菌的一种孔蛋白(Porin),其分子量为39 676 Da,等电点为4.46,GenBank的登录号为ZP_01260407。这是一种推测的孔蛋白,功能不详,肽质量指纹和它的匹配率达到了35%。外膜蛋白PP1是副溶血弧菌麦芽糖孔蛋白的前体蛋白 (Maltoporin precursor)。该蛋白分子量为46 933 Da,等电点为4.63,GenBank登录号为NP_801154,肽质量指纹和它的匹配率达到了31%。
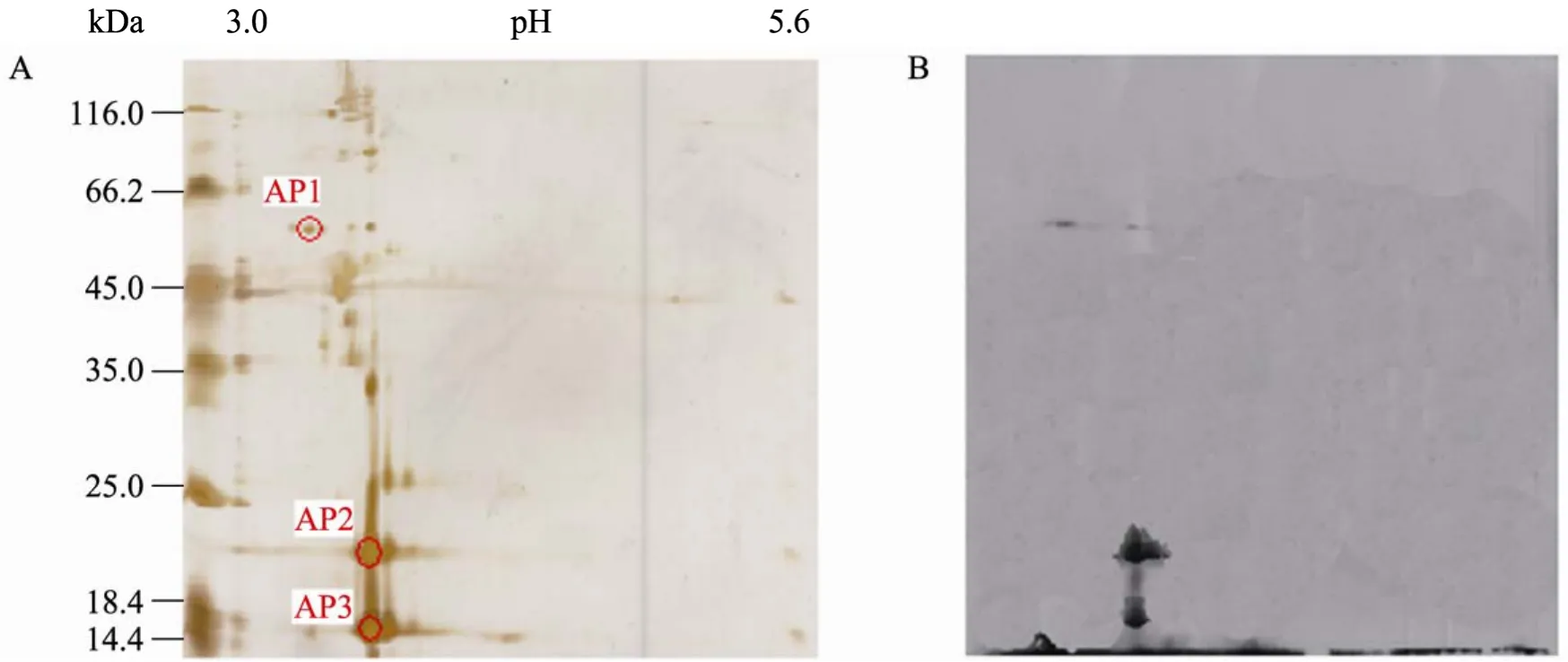
图4 溶藻弧菌外膜蛋白双向电泳图谱 (A) 及其与兔抗哈维氏弧菌抗血清的免疫印迹 (B) 结果Fig. 4 2-DE of the OMP from V. alginolyticus (A) and the result of Western blotting with anti-V. harveyi serum (B).
3 讨论
本研究从患病海水养殖鱼类体内分离了几种病原细菌,经传统的API系统鉴定,其生化谱与模式菌株均有一定的差异,不能有效鉴定到种的水平。近年来,借助于分子生物学的方法,对微生物进行种或种内不同株的区分,成为一种有效的细菌鉴定方法。最初,由于16S rRNA能够稳定遗传,能体现不同菌属之间的差异,且序列长度适中 (约1.5 kb),测序容易,被用于分子生物学分类鉴定,一度成为细菌种属鉴定和分类的国际标准方法[20]。但Stackebrandt等[21]认为16S rRNA序列同源性分析比较适合于属以上的分类介元亲缘关系的研究,而对于属以下的分类单位,其分辨率明显不足。近几年来的研究表明,HSP60 (Heat shock protein) 基因具有高度保守的一级结构,比16S rRNA基因携带更多的多态信息,是系统进化分析的有效分子标记,在近缘细菌间的系统发育关系的分析中显示优于 16S rRNA 基因序列[22]。因此,我们采用 HSP60基因部分序列比对的方法对分离到的海水鱼类致病性弧菌进行了更细致的分类,明确鉴定出8株弧菌分别属于溶藻弧菌、副溶血弧菌和哈维氏弧菌3种,其中哈维氏弧菌包括5个不同菌株。弧菌 HSP60序列分析表明,不同弧菌种类 HSP60基因的同源性低于 90.0%,同种弧菌间 HSP60基因的同源性大于 95.0%,与 Kwok等[23]利用HSP60基因部分序列研究葡萄球菌属系统发育时,发现种内序列的相似性为91%~98%,种间的序列相似性为74%~93% (平均为82%) 的结果基本相符。
外膜蛋白是革兰氏阴性细菌的特有成分,位于细胞的最外层。近年来,关于外膜蛋白免疫原性的研究取得了很大进展,同时发现不同种弧菌之间其外膜蛋白存在交叉保护。为了研究这3种8株弧菌的外膜蛋白的免疫反应性,首先制备了兔抗哈维氏弧菌全菌多抗,通过 SDS-PAGE和Western blotting分析,发现这8株弧菌的外膜蛋白出现了3~7条免疫反应条带,其中有3个条带为3种弧菌所共有,分别在22 kDa、35 kDa和45 kDa处,意味着这3条蛋白中有可能包含哈维氏弧菌、溶藻弧菌、副溶血弧菌3种弧菌的交叉保护性抗原。接着选择鉴定明确的溶藻弧菌、副溶血弧菌为典型株,采用双向电泳及免疫印迹相结合的方法,对它们的外膜蛋白的分子组成进行了分析,结果表明,两种弧菌的外膜蛋白包含分子量在10~120 kDa,等电点在3.0~5.0之间的蛋白约30~50个,其中分子量在12 kDa、22 kDa和45 kDa处的3条蛋白带能够跟异源抗体发生免疫反应,表明这3条带中含有能够和哈维氏弧菌发生交叉免疫反应的外膜蛋白。对比双向电泳免疫印迹结果和SDS-PAGE、Western blotting结果,发现SDS-PAGE中35 kDa处的印迹条带在双向电泳后并没有印迹点出现,而在12 kDa处却出现了明显的印迹点。这分明是由于,35 kDa处的蛋白可能是三聚体,在双向电泳的过程中解聚成为12 kDa左右的单体分子,该蛋白也具有交叉免疫反应性。已有相关研究显示,外膜蛋白在外膜上可以是三聚体也可以是单体分子[24-27]。哈维氏弧菌、溶藻弧菌的外膜蛋白OmpK,E. coli的OmpA是以单体形式形成孔道,而E. coli的OmpF,溶藻弧菌的OmpW是以3个单体构成一个具有特定功能的三聚体,通过许许多多暴露在外表面的环之间的相互作用而紧密地联系在一起,这种紧密的构型穿插在外膜当中,形成一个紧凑的分子结构,而将那些特异的且高度变异的结构域暴露于细胞表面,它们与外膜的各种生物活性有关。
外膜蛋白因其含有丰富的疏水性氨基酸,在一般溶液中很难完全溶解,这对外膜蛋白的双向电泳极为不利,因为样品能够被裂解液充分裂解是双向电泳成功的关键。为了解决这一难题,对裂解液的成分进行了改进,增加了硫脲等增进样品溶解的成分,并用两性离子去污剂CHAPS作为表面活性剂,在一定程度上改善了外膜蛋白溶解性,有利于等电聚焦的顺利进行。根据免疫印迹结果,从双向电泳制备胶上切取相对应的蛋白点 AP1、AP2、AP3 (溶藻弧菌) 和 PP1、PP2、PP3 (副溶血弧菌),经萃取、胰酶胶内酶解等一系列处理后,进行质谱分析。副溶血弧菌(V. parahaemolyticusRIMD 2210633,GenBank Accession No. BA000032) 和溶藻弧菌(V. alginolyticus12G01,GenBank Accession No.NZ_AAPS01000012) 的全基因组序列已经测序完成[28],因此来自副溶血弧菌V. parahaemolyticusNB1013外膜蛋白的肽质量指纹图谱搜索结果应该和副溶血弧菌 (V. parahaemolyticusRIMD 2210633,GenBank Accession No. BA000032) 关联度最高;来自溶藻弧菌 (V. alginolyticusNB1011) 外膜蛋白的肽质量指纹图谱搜索结果应该和溶藻弧菌 (V. alginolyticus12G01,GenBank Accession No. NZ_AAPS01000012) 最为匹配。我们将分别和溶藻弧菌AP1、副溶血弧菌 PP1唯一对应的肽质量指纹图谱通过MASCOT搜索相关数据库,结果表明外膜蛋白AP1和溶藻弧菌V. alginolyticus12G01的一种孔蛋白 (Porin) 十分匹配 (35%),其分子量为49 676 Da,等电点为4.46,GenBank的登录号为ZP_01260407。这是一种推测的孔蛋白,功能尚不清楚。外膜蛋白 PP1和数据库中副溶血弧菌V. parahaemolyticusRIMD 2210633的麦芽糖孔蛋白的前体蛋白 (Maltoporin precursor) 高度匹配 (31%)。该蛋白分子量为46 933 Da,等电点为4.63,GenBank登录号为NP_801154。麦芽糖孔蛋白是一个和麦芽糖-糊精的输送有关的孔蛋白,可以在外膜上形成通道并结合成三聚体结构,有利于麦芽糖-糊精及其他糖类顺利通过革兰氏阴性细菌的外膜。它和溶藻弧菌的推测孔蛋白同为弧菌的抗原蛋白,而且在不同弧菌之间具有交叉免疫反应性,可以作为弧菌的交叉保护性抗原候选成分。按照同样的方法可以鉴定出溶藻弧菌AP2和AP3,副溶血弧菌PP2和PP3,遗憾的是由于我们所用的质谱仪发生了故障影响了后续工作按计划进行。
我们的研究结果提示,采用异源血清来筛选弧菌外膜蛋白中具有交叉免疫反应性的抗原蛋白,作为开发多价疫苗的候选成分的方法是可行的。有人把仅针对微生物的某类特别成分的免疫蛋白质组学称为局部免疫蛋白质组学(Sub-immunoproteomics)[29],这种局部成分的双向电泳可以看作是整体双向电泳的有效补充。这种方法具有特异性好、快速、高通量的特点,在微生物的抗原蛋白筛选方面必将发挥更大的作用。当然,需要指出的是,这里筛选到的只是潜在可能的交叉保护性抗原,这些蛋白抗原在实际免疫预防中的保护率究竟怎样,需要通过以此构制多价疫苗 (抗原),免疫大黄鱼,再进行感染实验,方能最后确定其是否具有交叉保护的能力,甚至需要考虑如何通过辅以佐剂的方法增强其免疫原性,使其达到实际生产中真正有效可行的疫苗水平。致谢:本研究得到了浙江大学医学院余应年教授实验室的大力支持,特此致谢。
[1]Cai MY, Lu YY, Zhao YF. Bacterial Names. 2nd ed. Beijing: Science Press, 1996: 741−749.
蔡妙英, 卢运玉, 赵玉峰. 细菌名称. 2版. 北京:科学出版社, 1996: 741−749.
[2]Mao ZJ, Liu GY, Chen CF. Isolation and identification of pathogenic bacteria causing ulcerosis in large yellow croaker (Pseudosciaena crocea). J Anhui Agric Univ, 2002, 29(2):178−181.
毛芝娟, 刘国勇, 陈昌福. 大黄鱼溃疡病致病菌的初步分离与鉴定. 安徽农业大学学报, 2002,29(2): 178−181.
[3]Mao ZJ, Lou D, Wu XF, et al.Relationship between the serotype ofVibrio harveyiand the antigenicity of the bacterins. J Huazhong Agric,2003, 22(6): 588−590.
毛芝娟, 楼丹, 吴雄飞, 等. 哈维氏弧菌的血清型与菌苗抗原性的关系. 华中农业大学学报,2003, 22(6): 588−590.
[4]Xu BF, Lin NF, Yang JX, et al. Isolation,identification and pathogenicity analysis ofVibrio parahaemolyticusfromPseudosciaena crocea.Fujian J Agric Sci, 2002, 17(3): 174−177.
许斌福, 林能锋, 杨金先, 等. 大黄鱼副溶血弧菌的分离、鉴定及致病力分析. 福建农业学,2002, 17(3): 174−177.
[5]Jin S, Cai WQ, Yu H, et al.Study on cell pathology ofVibrio alginolyticusdisease to large yellow croakers. Marine Sci, 2003, 27(2): 59−62.
金珊, 蔡完其, 於宏, 等. 大黄鱼溶藻弧菌病细胞病理变化的初步研究. 海洋科学, 2003, 27(2):59−62.
[6]Wu HB, Pan JP. Virulence mechanisms of pathogenicVibrio. Acta Hydrobiol Sin, 2003,27(4): 422−426.
吴后波, 潘金培. 病原弧菌的致病机理. 水生生物学报, 2003, 27(4): 422−426.
[7]Xiong J, Guan RZ, Guo SL, et al.A review on the immunogenicity of fish pathogenic bacterial outer membrane proteins. Acta Hydrobiol Sin, 2011,35(1): 163−169.
熊静, 关瑞章, 郭松林, 等. 鱼类病原菌外膜蛋白及其免疫原性研究进展. 水生生物学报, 2011,35(1): 163−169.
[8]Kawai K, Liu Y, Ohnishi K, et al.A conserved 37KDa outer membrane pr otein ofEdwardsiella tardais an effective vaccine candidate. Vaccine,2004, 22(25/26): 3411−3418.
[9]Dong CF, Lin TL, Gong H, et al. Major outer membrane protein(MOMP) ofAeromonas hydrophilainduced protective immunity to European eels (Anguillia anguillia). Acta Hydrobiol Sin, 2005, 29(3): 285−290.
董传甫, 林天龙, 龚晖, 等. 嗜水气单胞菌主要外膜蛋白对欧洲鳗鲡的免疫保护试验. 水生生物学报, 2005, 29(3): 285−290.
[10]Huang ZJ, He JG. Immunogenicity and immunoprotection of outer membrane proteins ofVibrio alginolyticus. J Fisheri Chin, 2006, 30(4):538−543.
黄志坚, 何建国. 溶藻弧菌外膜蛋白(Va-OMP)的免疫原性及免疫保护性. 水产学报, 2006, 30(4):538−543.
[11]Koga T, Takumi K. Isolation and characterization of three porin-like proteins fromVibrio vulnificus:effect of different growth media on their production. Microbiol Immunol, 1994, 38(12):931−936.
[12]Tang XQ, Zhan WB, Zhou L, et al.Characterization of 36 kDa Outer Membrane Proteins of Six Pathogenic Vibrio Species. Period Ocean Univ China, 2009, 39(2): 197−202.
唐小千, 战文斌, 周丽, 等. 6种海洋致病性弧菌36kDa外膜蛋白特性分析. 中国海洋大学学报,2009, 39(2): 197−202.
[13]Zhang WN, Zhou L, Xing J, et al. Antigenicity of outer membrane proteins of a pathogenic Vibrio strain,Vibrio alginolyticus. J Fish Sci China, 2007,14(3): 419−424.
张伟妮, 周丽, 邢婧, 等. 大菱鲆致病性溶藻弧SR1的外膜蛋白及其抗原性分析. 中国水产科学,2007, 14(3): 419−424.
[14]Rahman MH, Kuroda A, Dijkstra JM, et al. The outer membrane fraction ofFlavobacterium psychrophiluminduces protective immunity in rainbow trout and ayu. Fish Shellfish Immunol,2002, 12(2): 169−179.
[15]Zhou L, Liu HM, Zhan WB, et al. Isolation and characteristics of major outer membrane proteins of aquatic pathogensVibrio anguillarumandVibrio alginolyticus. J Fish Sci Chin, 2003, 10(1): 31−35.
周丽, 刘洪明, 战文斌, 等. 鳗弧菌、溶藻胶弧菌外膜蛋白的分离及特性. 中国水产科学, 2003,10(1): 31−35.
[16]Mao ZJ, Yu L, You ZQ, et al. Cloning, expression and immunogenicity analysis of five outer membrane proteins ofVibrio parahaemolyticuszj2003. Fish Shellfish Immunol, 2007, 23(3):567−575.
[17]Xu CX, Wang SY, Zhang ZX, et al.Immunogenic cross-reaction among outer membrane proteins of Gram-negative bacteria. Int Immunopharmacol,2005, 5(7/8): 1151−1163.
[18]Tian D, Lin TL, Xu BF. Comparative characteristics of outer membrane proteins in bacteriaVibrio vulnificusandV. alginolyticus.Fisher Sci, 2011, 30(1): 27−30.
田丁, 林天龙, 许斌福. 创伤弧菌、溶藻弧菌外膜蛋白特性的比较研究. 水产科学, 2011, 30(1):27−30.
[19]Garrity GM, Bell JA, Lilburn TG. Taxonomic Outline of the Prokaryotes. Bergey's Manual of Systematic Bacteriology, 2nd Ed. Release 5.0. New York: Springer-Verlag,2004.
[20]Wang AJ, Ren NQ. Molecular Biology Diagnostic Techniques in the Environment. Beijing: Chemical Industry Press, 2004: 132−133.
王爱杰, 任南琪. 环境中的分子生物学诊断技术.北京: 化学工业出版社, 2004: 132−133.
[21]Stackebrandt E, Liesack W, Goebel BM. Bacterial diversity in a soil sample from a subtropical Australian environment as determined by 16S rRNA analysis. FASEB J, 1993, 7(1): 232−236.
[22]Viale AM, Arakaki AK, Soncini FC, et al.Evolutionary relationships among eubacterial groups as inferred from GroEL (chaperonin)sequence comparisons. Int J Syst Bacteriol, 1994,44(3): 527−533.
[23]Kwok AYC, Su SC, Reynolds RP, et al. Species identification and phylogenetic relationships based on partial HSP60 gene sequences within the genusStaphylococcus. Int J Syst Bacteriol, 1999, 49(3):1181−1192.
[24]Koebnik R, Locher KP, Van Gelder P. Structure and function of bacterial outer membrane proteins:barrels in a nutshell. Mol Microbiol, 2000, 37(2):239−253.
[25]Cowan SW, Schirmer T, Rummel G, et al. Crystal structures explain functional properties of two E.coli porins. Nature, 1992, 358(6389), 727−733.
[26]Weiss MS, Schulz GE. Structure of porin refined at 1. 8 Å resolution. J Mol Biol, 1992, 227(2):493−509.
[27]Nikaido H. Outer membrane. In: Neidhardt FC, ed.Escherichia coli and Salmonella, Cellular and Molecular Biology. Washington, DC: ASM Press,1996: 29−47.
[28]Xu CX, Ren HX, Wang SY, et al.Proteomic analysis of salt-sensitive outer membrane proteins ofVibrio parahaemolyticus. Res Microbiol, 2004,155(10): 835−842.
[29]Peng XX, Ye XT, Wang SY. Identification of novel immunogenic proteins ofShigella flexneri2a by proteomic methodologies. Vaccine, 2004,22(21/22): 2750−2756.
July 11, 2012; Accepted: November 7, 2012
Lian Yu. Tel/Fax: +86-571-88982242; E-mail: yulian@zju.edu.cn
浙江省科技计划重点科研社会发展项目 (No. 2005C23085) 资助。
Selection of cross-protective antigens from outer membrane proteins of three pathogenic vibrios isolated from infected large yellow croaker (Pseudosciaena crocea)
Chongwen Zhang, Zhijuan Mao, and Lian Yu
1Shanghai Fisheries Research Institute,Shanghai200433,China
2Zhejiang Wanli University,Ningbo315100,Zhejiang,China
3College of Animal Science,Zhejiang University,Hangzhou310058,Zhejiang,China
Vibrios are universal conditioned-pathogenic bacteria in marine culture environment, and the outbreak of vibrio disease resulted in a serious damage to aquaculture. Considering that vibrio disease in aquatic species, especially fishes, usually originated from mixed infection of different species (serotypes or subspecies) of vibrios, it is important to select the potential cross-protective protein antigens as candidates of polyvalent or combined vaccines. In present research,several strains of vibrios were isolated from infected large yellow croaker (Pseudosciaena crocea) and subsequently identified as six strains ofV. harveyi, oneV. parahaemolyticusand oneV. alginolyticusby physiological, biochemical and molecular biological methods. Their outer membrane proteins (OMPs) were extracted and the SDS-PAGE and Western blotting results show that three immuno-blots with common molecular weight presented at approximate 45 kDa, 35 kDa and 22 kDa on their OMP electrophoretogram, indicating the existence of antigens with cross-protection in their OMPs. With the aids of combination of two-dimensional electrophoresis (2-D) and Western blotting and matrix-assisted laser desorption/ionization time-of-flight mass spectrometry (MALDI-TOF-MS), a deduced porin (GenBank Accession No.ZP_01260407) fromV. alginolyticusand a maltoporin precursor (GenBank Accession No. NP_801154) fromV.parahaemolyticuswere able to react with polyclonal antibody to wholeV. harveyi,suggesting these two proteins could act as the cross-protective antigens and the vaccines prepared with these porins would be probable to bring cross protection to three different vibrios.
Vibrios, identification, outer membrane protein, cross-protective protein antigens
Supported by: Key Science Research and Society Development Programs of Zhejiang Province, China (No. 2005C23085).