重组大肠杆菌产蔗糖磷酸化酶的酶学性质及其催化合成α-熊果苷
2012-09-03万月佳马江锋徐蓉贺爱永姜岷陈可泉姜引
万月佳,马江锋,徐蓉,贺爱永,姜岷,陈可泉,姜引
南京工业大学生物与制药工程学院 材料与化学工程国家重点实验室,江苏 南京 211816
重组大肠杆菌产蔗糖磷酸化酶的酶学性质及其催化合成α-熊果苷
万月佳,马江锋,徐蓉,贺爱永,姜岷,陈可泉,姜引
南京工业大学生物与制药工程学院 材料与化学工程国家重点实验室,江苏 南京 211816
万月佳, 马江锋, 徐蓉, 等. 重组大肠杆菌产蔗糖磷酸化酶的酶学性质及其催化合成 α-熊果苷. 生物工程学报, 2012,28(12): 1450−1459.
Wan YJ, Ma JF, Xu R, et al. Properties of recombinant sucrose phosphorylase fromEscherichia coliand enzymatic synthesis of α-arbutin. Chin J Biotech, 2012, 28(12): 1450−1459.
利用重组大肠杆菌Escherichia coliRosetta(DE3)/pET-SPase发酵生产蔗糖磷酸化酶 (EC 2.4.1.7,Sucrose phosphorylase,SPase)。收集的菌体经高压破碎后离心得到粗酶液,通过镍NTA亲和层析、超滤除盐后得到电泳纯的SPase,纯化后的SPase的比酶活是原来的2.1倍,酶活回收率达到82.7%。经SDS-PAGE电泳测定,重组SPase的分子量约为59 kDa。该酶在不高于37 ℃,pH 6.0~6.7的条件下比较稳定,最适催化温度与最适催化pH分别为37 ℃,pH 6.7,该酶对蔗糖的米氏常数 (Km) 为7.3 mmol/L,最大反应速率 (Vmax) 为0.2 µmol/(min·mg)。此外文中还以蔗糖和氢醌为底物,利用重组SPase催化合成α-熊果苷。其最佳反应条件为:20%蔗糖,200 U/mL的酶液,1.6%氢醌,pH 6.0~6.5,25 ℃,反应21 h。α-熊果苷的摩尔产率为78.3%,α-熊果苷的产量为31 g/L。
重组蔗糖磷酸化酶,纯化,酶学性质,α-熊果苷
蔗糖磷酸化酶 (EC2.4.1.7,Sucrose phosphorylase,SPase) 属于糖基水解酶13家族,是一种催化转移葡萄糖苷键的酶,能够催化蔗糖和无机磷酸盐合成1-磷酸-葡萄糖[1-2]。该酶主要以蔗糖、1-磷酸-葡萄糖为供体,多类物质如多羟基的糖和糖醇、酚羟基、羧基等为受体,催化合成各种糖苷[3]。据报道,蔗糖磷酸化酶主要存在于肠膜明串珠菌Leuconostoc mesenteroides[4]、变异链球菌Stococcus mutans[5]、嗜糖假单胞菌Pseudomonas saccharophila[6]、长双歧杆菌Bifidobacterium longum[7]、青春双歧杆菌Bifidobacterium adolescentis[8]等微生物中,通过生物发酵获得,但由于产量和生产效率都比较低,因此通过基因工程手段构建重组菌株,过量表达蔗糖磷酸化酶对于进行工业化大量生产十分必要。
利用蔗糖磷酸化酶催化合成 α-熊果苷是该酶的重要应用之一。α-熊果苷是一种新型的皮肤增白剂,能够通过抑制酪氨酸酶的活性,从而减少黑色素的生成,而对表皮细胞的正常生长以及酪氨酸酶的表达没有影响,并且其美白效果是β-熊果苷10倍以上,是21世纪最有竞争力的美白添加剂之一[9-11]。研究表明,α-熊果苷只能通过不同的微生物的酶进行糖转移反应,让一分子葡萄糖和一分子的氢醌结合形成[12]。
本文利用重组菌株E.coliRosetta(DE3)/pET-SPase[13]发酵生产SPase,并对其进行分离纯化以及酶学性质的研究,此外还利用该酶以氢醌和蔗糖为底物催化合成 α-熊果苷,其反应式如图1所示。

图1 重组SPase催化合成α-熊果苷[14]Fig. 1 Synthesis of α-arbutin catalyzed by recombinant SPase[14].
1 材料与方法
1.1 材料
重组菌E. coliRosetta(DE3)/pET-SPase由本实验室构建和保藏。标准品α-熊果苷购自Sigma公司,其余试剂均为国产分析纯。
1.2 方法
1.2.1 大肠杆菌发酵产酶
发酵培养基:蛋白胨12 g/L,酵母粉24 g/L,K2HPO472 mmol/L,MgSO410 mmol/L,硫胺素0.034 g/L,微量元素 (CaCl2·6H2O 0.74 g/L,ZnSO4·7H2O 0.18 g/L , MnSO4·H2O 20 g/L ,Na2·EDTA 20.1 g/L,CuSO40.1 g/L,CoCl20.104 g/L,FeSO4·7H2O 2 g/L) 2 mL/L。发酵条件:初始温度37 ℃,当菌体生长至OD600=3时,连续流加乳糖 (2 g/(L·h)) 作为诱导剂,诱导温度为25 ℃。
1.2.2 重组蔗糖磷酸化酶的纯化
发酵液离心 (4 ℃,8 000 r/min,15 min) 得到的菌泥用0.5 mol/L磷酸钾缓冲液 (pH 6.5) 洗涤并浓缩。浓缩后的菌液经高压破碎后离心(4 ℃,12 000 r/min,30 min) 得到的上清液即为粗酶液。
粗酶液经镍 NTA琼脂糖凝胶色谱柱,采用含250 mmol/L咪唑的磷酸缓冲液洗脱,洗脱液用截留分子量为10 kDa的超滤离心管离心脱除咪唑,得到纯酶液。
1.2.3 酶的最适温度的测定
将纯化的重组SPase置于pH 6.7缓冲液中,在不同的温度 (4 ℃ ~ 45 ℃ ) 下测定酶活,以活力最高者为100%对照。
1.2.4 酶的最适pH的测定
经纯化的重组SPase在25 ℃条件下,在不同的pH (5.0~9.0) 缓冲液中测定酶活,以活力最高者为100%对照。
1.2.5 酶的温度稳定性的测定
将纯化的重组SPase置于pH 6.7缓冲液中,在不同的温度 (4 ℃~45 ℃) 下保温1 h,然后测定其剩余酶活。以活力最高者为100%对照。
1.2.6 酶的pH稳定性的测定
将纯化的重组Spase置于不同的pH (5.5~8.0)下,25 ℃保温1 h,然后测定其剩余酶活。以活力最高者为100%对照。其中pH 5~7为柠檬酸-Na2HPO4缓冲液,pH 7~8为Na2HPO4/NaH2PO4缓冲液,pH 8.5为甘氨酸-NaOH缓冲液。
1.2.7 酶动力学常数的测定
在pH 6.7,50 mmol/L的磷酸缓冲液中分别加入不同浓度的蔗糖 (2~10 mmol/L),约9 U/mL的酶液,25 ℃反应5 min,煮沸终止反应,利用高效液相色谱 (HPLC) 分析产物果糖的浓度。
1.2.8 α-熊果苷的合成

式中,M1:初始氢醌的摩尔质量,M2:残余氢醌的摩尔质量,M:生成的α-熊果苷的摩尔质量。
1.2.9 酶活力的检测
参照Silverstein等[6]的方法,通过测定反应过程中释放的NADPH的量来计算。标准的测定体系包括:50 mmol/L的磷酸二氢钾试剂 (pH 6.7),140 mmol/L蔗糖溶液,1 mmol/L EDTA-2Na,50 mmol/L MgCl2,1 mg 的 NADP+,l µg 的1,6-二磷酸葡萄糖,100 µg的葡萄糖磷酸变位酶,20 U 6-磷酸葡萄糖脱氢酶,20 µL的酶液,总体积为3.3 mL。25 ℃,340 nm测定NADPH的吸光值的变化。单位酶活的定义为在上述条件下每分钟消耗1 µmol的NADP+所需的酶量。
1.2.10 蛋白质含量以及分子量的测定
蛋白质含量的测定采用Brandford法[15],测定蛋白质的含量,标准蛋白为牛血清蛋白 (BSA)。
蛋白质分子量的测定采用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳 (SDS-PAGE)[16],分离胶浓度为12.5%,染色使用考马斯亮蓝R-250。
1.2.11 果糖的检测
高效液相色谱 (HPLC) 检测果糖,检测条件:色谱柱为氨基柱 (4.6 mm×250 mm),流动相∶乙腈:水=75∶25,流速为1 mL/min,示差折光检测器。
1.2.12 α-熊果苷的检测
高效液相色谱 (HPLC) 检测 α-熊果苷,检测条件:色谱柱为戴安 C18 (4.6 mm×250 mm)柱,流动相为5%的甲醇,柱温25 ℃,检测波长235 nm,流速为0.8 mL/min。
2 结果
2.1 蔗糖磷酸化酶的分离纯化
在1.2.1的条件下,发酵产重组SPase的酶活达到300 U/mL。该重组SPase在N端带有重组融合的 His-Tag,因此可以采用金属离子螯合的层析柱纯化酶蛋白。将重组SPase离心后进行镍NTA亲和层析,然后用超滤离心管脱除咪唑。经纯化后重组SPase的SDS-PAGE结果如图2所示。结果表明SPase纯度较高,并且该重组SPase的分子量约为 59 kDa (包括 4 kDa的组氨酸标签),与L. mesenteroidesATCC12291产的SPase的分子量接近[17]。蔗糖磷酸化酶的纯化倍数和回收率见表1,通过金属离子亲和层析和超滤离心除盐后,SPase的纯化倍数为原来的 2.1倍,酶活力回收率达到82.7%。

图2 重组SPase纯化样品的SDS-PAGE分析Fig. 2 SDS-PAGE analysis of purified recombinant SPase. M: molecular mass markers; 1: crude enzyme; 2:purified SPase.
2.2 pH和温度对酶活力和稳定性的影响
pH和温度对酶活力和稳定性的影响结果如图3。结果表明,酶的最适反应温度为37 ℃;当温度不高于37 ℃时,重组Spase的酶活力都比较稳定,置于相应的温度下1 h仍能保持90%以上的活力,温度超过37 ℃后,酶活力损失增加。酶的最适作用pH为6.7;pH在6.0~6.7的范围内,重组 Spase的酶活力都比较稳定。该重组 Spase与L. mesenteroidesATCC12291产的SPase的性质相似[18]。
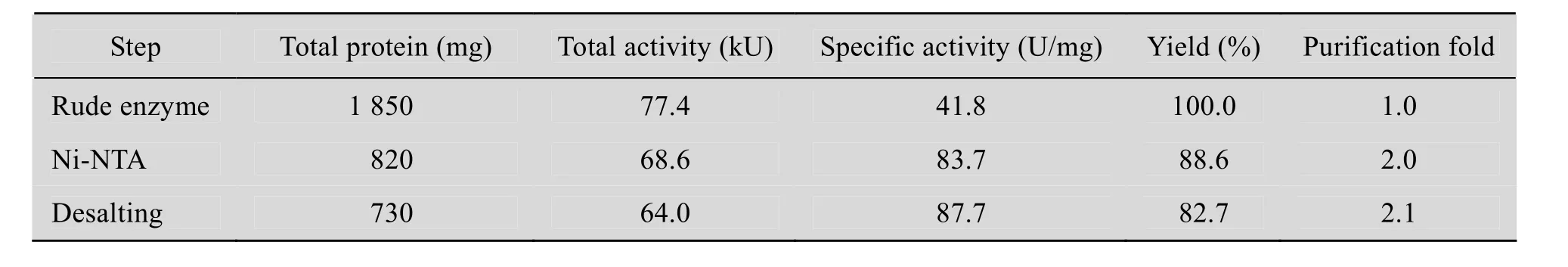
表1 重组SPase的纯化结果Table 1 Purif i cation of recombinant SPase
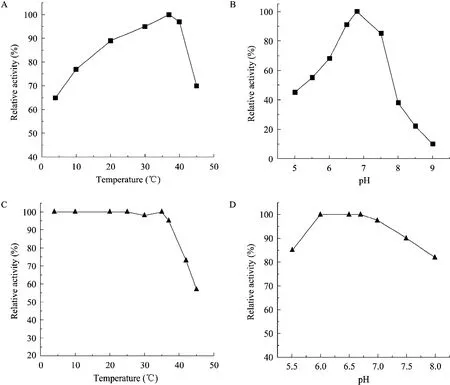
图3 温度和pH对酶活力和稳定性的影响Fig. 3 Effects of temperature and pH on activities and stabilities of recombinant SPase.: enzyme activity;:enzyme stability.
2.3 重组SPase的动力学参数
本研究在最适反应条件下,进行了重组SPase对蔗糖的转糖基反应动力学分析,并以Michaelis-Menten方程拟合得到重组SPase对蔗糖的反应动力学常数。通过双倒数作图法,以r−1对c−1作图,结果如图 4所示,可得重组 SPase对蔗糖的米氏常数 (Km) 为7.3 mmol/L,最大反应速率 (Vmax) 为 0.2 µmol/(min·mg)。
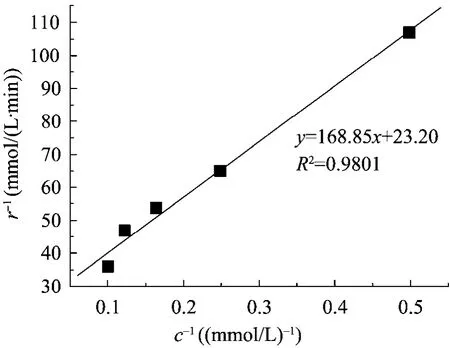
图4 重组SPase转糖基反应动力学Fig. 4 Kinetics of glucosyl transfer reaction catalyzed by recombinant SPase.
2.4 以蔗糖和氢醌为底物合成α-熊果苷的反应条件优化
2.4.1 温度对催化反应的影响
重组SPase在温度不高于37 ℃的条件下,均能保持较高的活力。为此在其他条件不变的情况下,只改变反应温度,观察其对氢醌转化率和选择性的影响,结果如图5所示。25 ~℃37 ℃条件下,氢醌的转化率变化不明显,但是温度高于25 ℃后,氢醌的选择性随温度升高而下降。此外重组SPase在25 ℃条件下能够维持较高的酶活力,因此选择25 ℃进行催化反应。
2.4.2 pH对催化反应的影响
重组SPase在pH 6.0~6.7的范围内均能保持较高的活力。为此在其他条件不变的情况下,只改变反应 pH,观察其对氢醌转化率和选择性的影响,结果如图6所示。在pH 6~7条件下,氢醌的转化率比较稳定,但pH高于6.5时,氢醌的选择性开始下降,此外重组SPase在pH 6~6.5条件下能够维持较高的酶活力,因此选择pH 6~6.5进行催化反应。
2.4.3 氢醌浓度对催化反应的影响
当初始蔗糖浓度为500 g/L时,反应结束后残留的蔗糖浓度过高,不仅造成了原料的浪费,而且为以后α-熊果苷的分离带来了困难,因此选择初始蔗糖浓度为 200 g/L,该浓度下对下游有机膜超滤分离无影响。理论上,蔗糖和氢醌合成α-熊果苷的摩尔比为1∶1,但该反应是一个可逆反应,并且氢醌成本相对蔗糖高、具有一定的毒性,因此反应中应使蔗糖过量,促使氢醌得到最高的转化率。在初始蔗糖浓度200 g/L的条件下,考察不同蔗糖氢醌浓度比对催化反应的影响,结果如图7所示。随着蔗糖氢醌浓度比的下降,氢醌的转化率和选择性均下降,这是由于氢醌浓度越低,蔗糖越过量,促进反应正向进行,使得氢醌更大程度地转化。因此选择 1.6%的氢醌 (对应蔗糖与氢醌的摩尔比为4∶1) 进行催化反应。
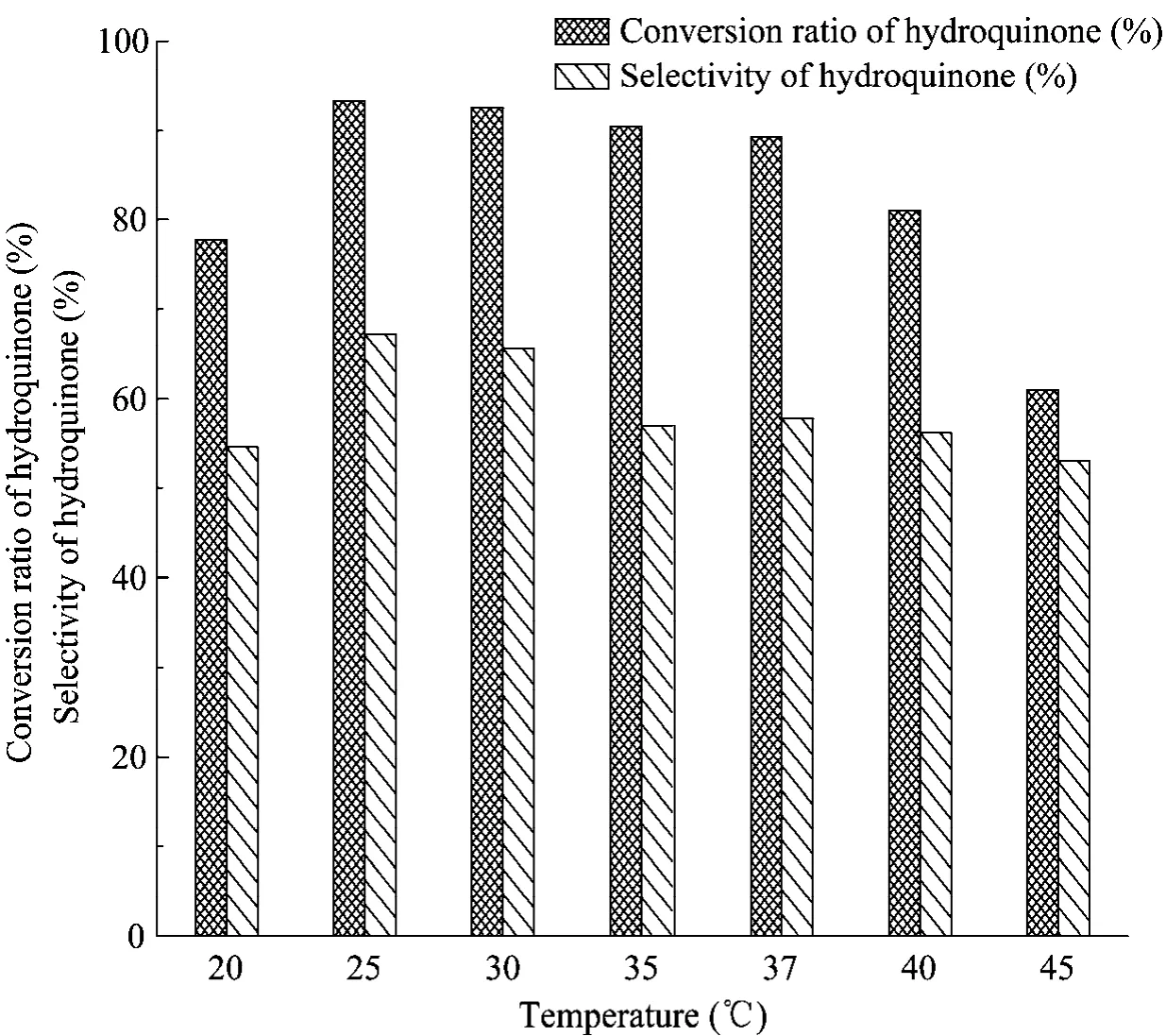
图5 温度对生产α-熊果苷的影响Fig. 5 Effect of temperature on production of α-arbutin.

图6 pH对生产α-熊果苷的影响Fig. 6 Effect of pH on production of α-arbutin.
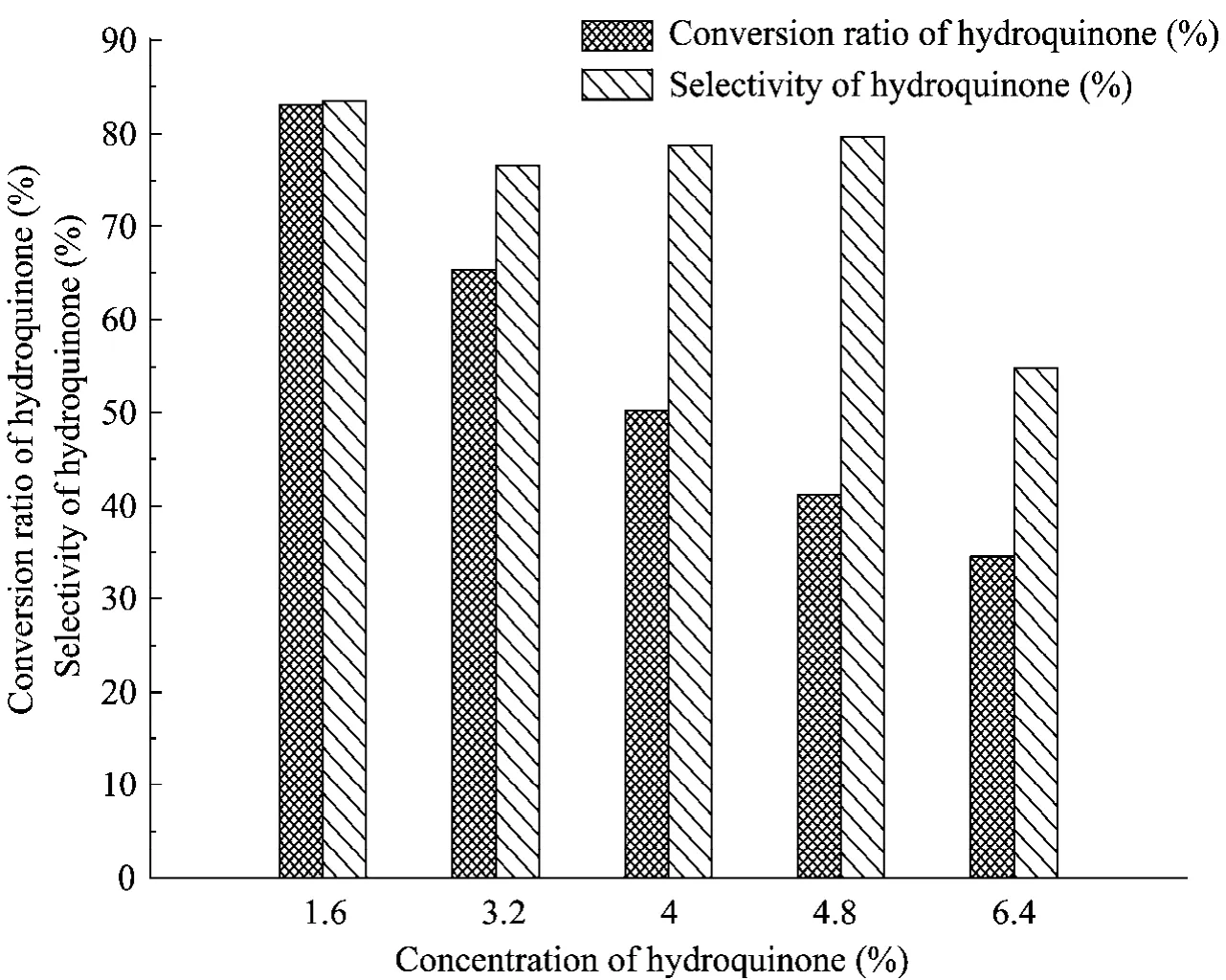
图7 氢醌浓度对生产α-熊果苷的影响Fig. 7 Effect of concentrations of hydroquinone on production of α-arbutin.
2.4.4 反应时间对催化反应的影响
反应时间对催化反应的影响如图8所示。随着反应的不断进行,氢醌的转化率逐渐上升,至21 h转化率基本达到最大,21 h后转化率变化不明显,一方面可能是由于反应达到平衡,另一方面可能是由于反应时间过长,酶活力下降,因此将反应时间控制在21 h。
3 讨论
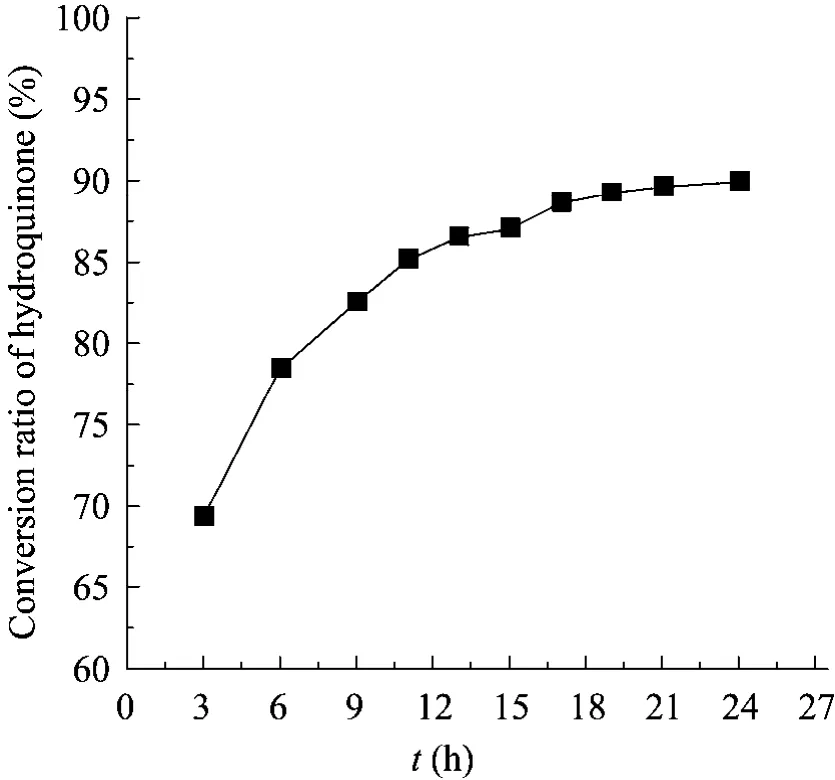
图8 反应生成α-熊果苷的进程Fig. 8 The process to produce α-arbutin.
SPase作为一种葡萄糖基转移酶,其重要作用在于能够以蔗糖或 1-磷酸-葡萄糖为供体,多类物质如多羟基糖和糖醇、酚羟基、羧基等为受体,催化合成其相应的多一个葡萄糖基的糖苷,因此SPase具有较高的研究价值。本文利用自行构建的重组E. coliRosetta(DE3)/pET-SPase进行发酵生产重组SPase,利用 Ni-NTA柱亲和层析来分离纯化重组SPase,纯化方法简单,得到的重组SPase酶活力较高,且酶活损失较少。同时对重组SPase的酶学性质进行研究,并在此基础上利用该重组SPase以氢醌和蔗糖为底物催化合成 α-熊果苷。在最适条件 (200 U/mL的重组SPase,蔗糖浓度 20% (W/V),氢醌浓度 1.6%(W/V),pH 6.0~6.5,25 ℃水浴,避光) 下,氢醌的转化率接近 90%,α-熊果苷的摩尔产率为78.3%,产量达到31 g/L。与已报道的其他生产α-熊果苷的方法相比,利用该法生产α-熊果苷的产量高,使用的原料蔗糖和氢醌的量均比较少。
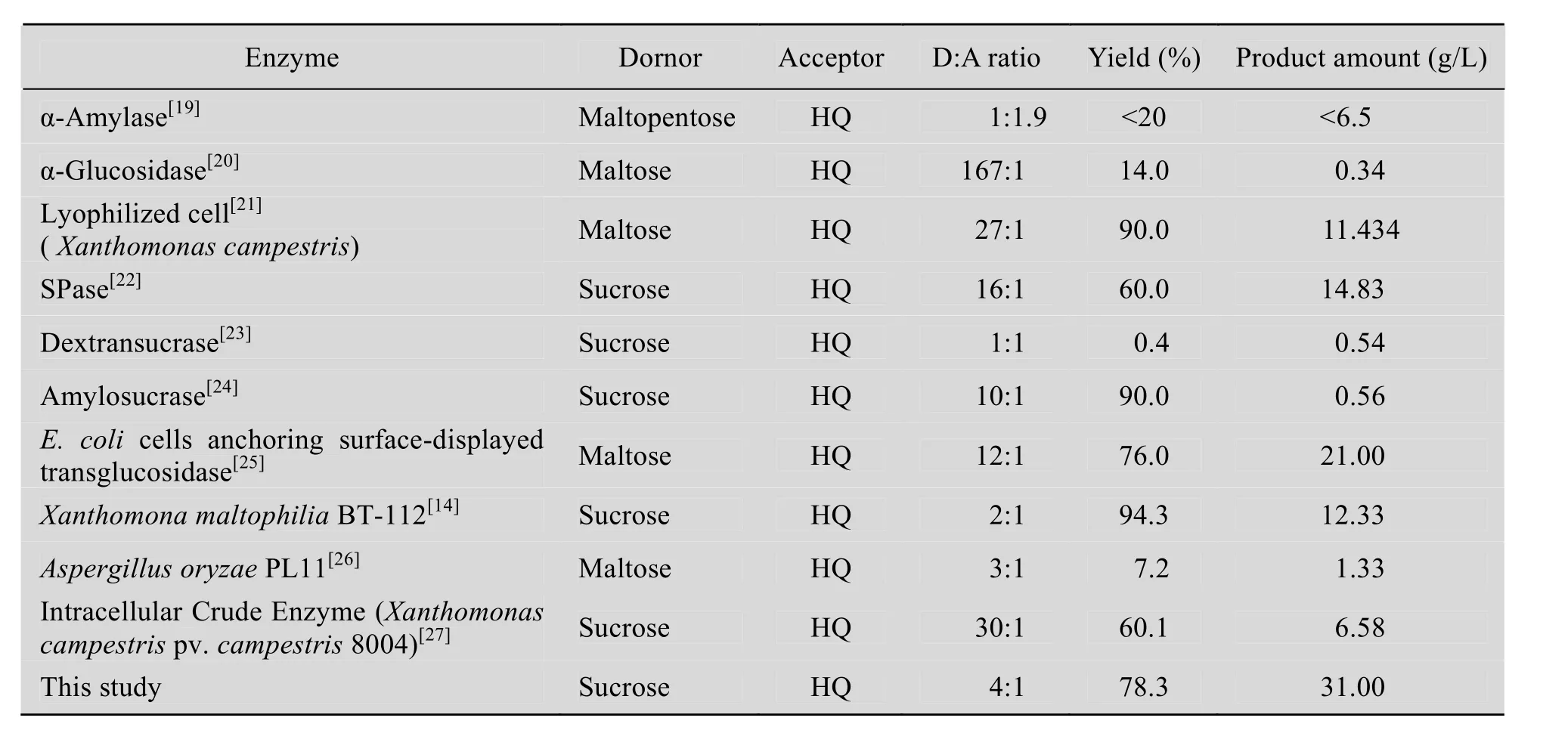
表2 各种合成α-熊果苷方法的比较Table 2 Comparison of α-arbutin synthesis by different methods
[1]Janecek S, Svensson B, Henrissat B. Domain evolution in the α-amylase family. J Mol Evol,1997, 45(3): 322−331.
[2]Lee JH, Yoon SH, Nam SH, et al. Cloning and expression of the sucrose phosphorylase gene fromLeuconostoc mesenteroidesinEscherichia coli.Biotechnol Lett, 2008, 30(4): 749−754.
[3]Goedl C, Sawangwan T, Wildberger P, et al.Sucrose phosphorylase: a powerful transglucosylation catalyst for synthesis of α-D-glucosides as industrial fine chemicals.Biocatal Biotransform, 2010, 28(1): 10−21.
[4]Vandamme EJ, Van LJ, Laporte AD. Dynamics and regulation of sucrose phosphorylase formation inLeuconostoc mesenteroidesfermentations.Biotechnol Bioeng, 1987, 29(1): 8−15.
[5]Russel R, Mukasa H, Shimamura A, et al.Streptococcus mutansgtfA gene specifies sucrose phosphorylase. Infect Immun, 1988, 56(10):2763−2765.
[6]Silverstein R, Voet J, Reed D, et al. Purification and mechanism of action of sucrose phosphorylase.J Biol Chem, 1967, 242(6): 1338−1346.
[7]Kullin B, Abratt VR, Reid SJ. A functional analysis of theBifidobacterium longumcscA and scrP genes in sucrose utilization. Appl Microbiol Biotechnol,2006, 72(5): 975−981.
[8]Van den Broek LA, Van Boxtel EL, Kievit RP, et al. Physico-chemical and transglucosylation propertiesof recombinant sucrose phosphorylase fromBifidobacterium adolescentisDSM20083.Appl Microbiol Biotechnol, 2004, 65(2): 219−227.
[9]Sugimoto K, Nishimura T, Nomura K, et al.Inhibitory effects of α-arbutin on melanin synthesis in cultured human melanoma cells and a three-dimensional human skin model. Chem Phys,2004, 27(4): 510−514.
[10]Funayama M, Arakawa H, Yamamoto R, et al.Enzymatic synthesis of hydroquinone-glucoside.Seihutsu Kogaku Kaishi, 1997, 75(3): 177−180.
[11]Liu F, Jiang T, Ren SM. Development in synthesis of arbutin. China Surfactant Detergent Cosmetics,2004, 34(4): 242−244.
刘锋, 江涛, 任素梅. 熊果苷合成研究进展. 日用化学工业, 2004, 34(4): 242−244.
[12]Yao B, Shen XL, Pan YJ. Progress of α-arbutin.Chin JMAP, 2005, 22(1): 32−33.
姚斌, 沈晓兰, 潘亚菊. α-熊果苷的研究进展. 中国现代应用药学, 2005, 22(1): 32−33.
[13]Sui SS, Ma JF, Hou GW, et al. Expressi on of sucrose phosphorylase gene fromLeuconostoc mesenteroi desinEscherichia coli. Biotechnol Bulletin, 2011, (5): 157−161.
隋姗姗, 马江锋, 侯顾伟, 等. 肠膜名串珠菌蔗糖磷酸化酶基因在大肠杆菌中的表达. 生物技术通报, 2011, (5): 157−161.
[14]Liu CQ, Zhang SR, Zhang P. Biocatalytic synthesis of α-arbutin byXanthomonasBT-112. Chin J Catal,2006, 27(4): 361−364.
刘春巧, 张淑荣, 张鹏. 黄单胞菌生物催化合成α-熊果苷. 催化学报, 2006, 27(4): 361−364.
[15]Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem, 1976, 72(1/2): 248−254.
[16]Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage.Nature, 1970, 227(259): 680−685.
[17]Koga T, Nakamura K, Shirokane Y, et al.Purif i cation and some properties of sucrose phosphorylase fromLeuconostoc mesenteroides.Agric Biol Chem, 1991, 55(7): 1805−1810.
[18]Kitaoka K, Takahashi H, Hara K, et al. Purification and characterization of sucrose phosphorylase fromLeuconostoc mesenteroidesATCC12291 cells, and disaccharides synthesis by the enzyme. Oyo Toshitsu Kagaku, 1994, 41(2): 165−172.
[19]Nishimura T, Kometani T, Takii H, et al.Purification and some properties of α-amylase fromBacillus subtilisX23 that glucosylates phenolic compounds such as hydroquinone. J Ferment Bioeng, 1994, 78(1): 31−36.
[20]Prodanović RM, Milosavić NB, Sladic D, et al.Synthesis of hydroquinone-α-glucoside by α-glucosidase from baker’s yeast. Biotechnol Lett,2005, 27(8): 551−554.
[21]Kurosu J, Sato T, Yoshida K, et al. Enzymatic synthesis of α-arbutin by α-anomer-selective glucosylation of hydroquinone using lyophilized cells ofXanthomonas campestrisWU-9701. J Biosci Bioeng, 2002, 93(3): 328−330.
[22]Kitao S, Sekine H. α-D-Glucosyl transfer to phenolic compounds by sucrose phosphorylase fromLeuconostoc mesenteroidesand production of alpha-arbutin. Biosci Biotech Bioch, 1994, 58(1):38−42.
[23]Seo ES, Kang J, Lee JH, et al. Synthesis and characterization of hydroquinone glucoside usingLeuconostoc mesenteroidesdextransucrase.Enzyme Microb Tech, 2009, 45(5): 355−360.
[24]Seo DH, Jung JH, Ha SJ, et al. High-yield enzymatic bioconversion of hydroquinone to α-arbutin, a powerful skin lightening agent, by amylosucrase. Appl Microbiol Biotechnol, 2012,94(5): 1189−1197.
[25]Wu PH, Nair GR, Chu IM, et al. High cell density cultivation ofEscherichia coliwith surface anchored transglucosidase for use as whole-cell biocatalyst for α-arbutin synthesis. J Ind Microbiol Biotechnol, 2008, 35(2): 95−101.
[26]Chen SM. Study on Microbe Biosynthesis of Arbutin[D]. Nanning: Guangxi University, 2007.
陈思名. 米曲霉PL11催化合成熊果苷的研究[D].南宁: 广西大学, 2007.
[27]Zhang XY, Yan W, Li LQ. Biocatalytic synthesis of α-arbutin by the intracellular crude enzyme fromXanthomonas campestris. Chem Bioeng, 2012,29(4): 64−67.
张欣英, 严伟, 李群良. 野油菜黄单胞菌胞内粗酶液催化合成α-熊果苷. 化学与生物工程, 2012,29(4): 64−67.
July 4, 2012; Accepted: September 11, 2012
Jiangfeng Ma. Tel: +86-25-83172078; Fax: +86-25-84172062; E-mail: bioengine@njut.edu.cn
国家自然科学基金 (No. 21076105),国家重点基础研究发展计划 (973计划) (No. 2009CB724701),江苏高校优势学科建设工程项目资助。
Properties of sucrose phosphorylase from recombinantEscherichia coliand enzymatic synthesis of α-arbutin
Yuejia Wan, Jiangfeng Ma, Rong Xu, Aiyong He, Min Jiang, Kequan Chen, and Yin Jiang
State Key Laboratory of Materials-Oriented Chemical Engineering,College of Biotechnology and Pharmaceutical engineering,Nanjing University of Technology,Nanjing211816,Jiangsu,China
Sucrose phosphorylase (EC 2.4.1.7, Sucrose phosphorylase, SPase) can be produced by recombinant strainEscherichia coliRosetta(DE3)/Pet-SPase. Crude enzyme was obtained from the cells by the high pressure disruption and centrifugation. Sucrose phosphorylase was purified by Ni-NTA aff i nity column chromatography and desalted by ultrafiltration. The specific enzyme activity was 1.1-fold higher than that of the crude enzyme, and recovery rate was 82.7%. The purified recombinant SPase had a band of 59 kDa on SDS-PAGE. Thermostability of the enzyme was shown at temperatures up to 37 °C, and pH stability between pH 6.0 and 6.7. The optimum temperature and pH were 37 °C and 6.7,respectively. TheKmof SPase for sucrose was 7.3 mmol/L, andVmaxwas 0.2 µmol/(min·mg). Besides, α-arbutin was synthesized from sucrose and hydroquinone by transglucosylation with recombinant SPase. The optimal conditions for synthesis of α-arbutin were 200 U/mL of recombinant SPase, 20% of sucrose, and 1.6% hydroquinone at pH 6−6.5 and 25 °C for 21 h. Under these conditions, α-arbutin was obtained with a 78.3% molar yield with respect to hydroquinone, and the concentration of α-arbutin was about 31 g/L.
recombinant sucrose phosphorylase, purification, properties, α-arbutin
Supported by: National Natural Science Foundation of China (No. 21076105), National Basic Research Program of China (973 Program)(No. 2009CB724701), the Priority Academic Program Development of Jiangsu Higher Education Institutions.