SCN5A基因变异与左心室肌致密化不全心力衰竭相关性研究
2012-09-03单丽沈于宪一邢艳琳市田蕗子
单丽沈,于宪一,邢艳琳,市田蕗子
(1.中国医科大学盛京医院 儿科,辽宁 沈阳 110004;2.日本富山大学附属医院 儿科,日本 富山 9300194)
心室肌致密化不全(left ventricular noncompaction,LVNC)是一种尚未分类的心肌疾病[1],其病理特征为左心室存在大量网状的肌肉柱形成的肌小梁及小梁间深深的间隙。目前认为,LVNC是胚胎时期心室肌致密化过程障碍所致[2]。该病可以兼有扩张性心肌病或肥厚性心肌病的临床特征,临床表现多样,可以从无症状到严重的心功能障碍以致需心脏移植,甚至死亡。多数LVNC患者存在各种心律失常及不同程度的心力衰竭[2]。
1984年Engberding等[3]报道了首例无合并其他心脏畸形的LVNC。近年来,有研究[4-6]报道了一些与LVNC相关的基因,如DTNA、TAZ和LDB3等,证实了LVNC也是一种具有遗传异质性的疾病。
现已证实,人类心脏钠通道alpha亚单位SCN5A基因突变与长 QT 综合征(LQTS)[7]、Brugada 综合征[8]、不明原因的夜间猝死综合征[9]、特发性心室颤动[10]、先天性病态窦房结综合征[11]、心脏传导缺陷(CCD)[12]及婴儿猝死综合征[13]等心律失常相关。最近发现SCN5A变异[14-15]和编码心肌钾通道基因KATPchannel gene(ABCC9)[16]与扩张性心肌病有关。钠通道在心肌细胞兴奋性中扮演重要角色。它建立除极与复极电流的精细平衡,从而决定动作电位间期。因此,SCN5A的变异可以影响这种平衡,甚至微弱的变化可以干扰通道亚单位水平的表达。SCN5A的单个核苷酸的变异所引起的DNA序列多态性Single nucleotide polymorphisms(SNPs)不仅是遗传性心律失常综合征的危险因素,也是获得性心律失常的危险因素[17-20]。
本研究拟通过对62例LVNC患者的SCN5A变异分析,了解编码离子通道基因变异对LVNC病理生理相关的心律失常及重症病例心力衰竭影响。
1 资料与方法
1.1 研究对象
全部病例均来自亚洲,共62例,其中包括17例家族病例及45例散发病例;男30例,女32例,年龄0~69岁。在明确基因型之前,首先对先证者及其相关的家族成员进行查体及摄胸部正侧位X线片、心电图检查,并应用二维及彩色多普勒心脏超声来评价心脏结构,左心室大小、功能(短轴缩短率、射血分数)和瓣膜反流的情况。本组病例从二维超声心动图可以清晰地看到由肌小梁及深深的小梁间隙构成的致密化不全层及其外部的致密层;彩色多普勒超声心动图显示左心室内的小梁间隙中持续有血流入(图1)。
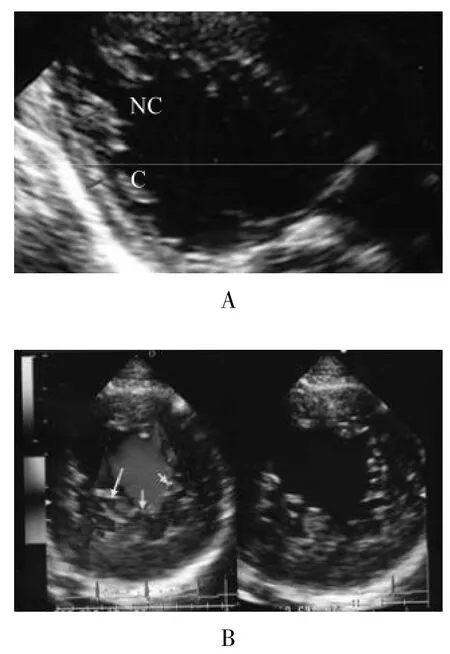
图1 二维超声心动图(A)及彩色多普勒超声心动图(B)Fig 1 Two-dimensional echocardiography(A)and color Doppler echocardiogrophy(B)
1.2 临床辅助检查及诊断依据
1.2.1 心脏超声 (1)肥大的左心室内至少有一侧壁的心内膜心肌密布肌小梁;(2)左心室收缩功能降低;(3)心内膜的致密化不全层与致密层厚度之比大于2.0;(4)从彩色多普勒上可以看到肌小梁间隐窝与左室有血流相通。
1.2.2 心电图 应用12导联同步心电图及动态心电图确诊[4]。
1.2.3 心力衰竭 根据Ross 1992年婴儿心衰诊断标准以及2001年Connolly等提出的小儿慢性心衰严重程度评分分级的新方法[21-22]。
1.3 分子遗传学研究
在签署知情同意书后,采外周静脉血,提取DNA(试剂盒Qiagen:Valencia,CA)并立即建立细胞系。
应用PCR方法对每名先证者的SCN5A基因进行扩增。根据NCBI及Celera数据库中的基因序列,运用在线程序Primer 3设计每段编码外显子及其侧翼内含子序列的PCR引物,PCR的具体方法详见文献[6]。在实验中,根据需要来调整PCR的引物序列及条件。将PCR扩增后的产物与变性缓冲液一起加热,进行SSCP 分析[5]。
将正常对照和异常的SSCP条带从已经干燥的胶片上切割下来纯化后,根据Applied Biosystems(ABI)Big Dye Terminator Cycle Sequencing的实验方案,并应用ABI 310自动基因序列分析仪对样本进行分析,得出的基因序列与公布在NCBI上的野生型基因序列进行对比。一旦发现变异,将从最原始的基因组DNA开始,重新扩增PCR,并将产物直接进行基因序列分析。
1.4 统计学处理
所有资料应用SPSS 11.5软件分析。两组SNP发生率比较采用χ2检验。对基因变异与心律失常关系的计算应用逻辑回归分析(logistic regression),P<0.05为差异有统计学意义。
2 结 果
2.1 基因序列分析
本研究队列62例LVNC的先证者,包括45例散发病例(S)和17例家族病例(F),并对8名相关的家族成员进行基因型-表型关系的分析。先证者性别、确诊时年龄、临床表型及其SCN5A变异情况见表1。

表1 LVNC先征者的临床及基因序列分析数据Tab 1 Clinical and molecular data for probands with LVNC

续 表
在7例家族病例和12例散发病例中,我们发现了6种杂合子和1种纯合子变异(表1、2)。其中rs6599230:G>A、rs1805124:A >G(p.H558R)、rs1805125:C >T(p.P1090L)和rs1805126:T>C已经公布在NCBI SCN5A SNP数据库,c.453C >T、c.1141-3C>A这2种 SNPs已经有报道[23-24]。本研究中,在合并完全性房室传导阻滞(AVB)的散发病例 S43的 DNA中,发现了c.3996C>T变异,未曾有过报道。
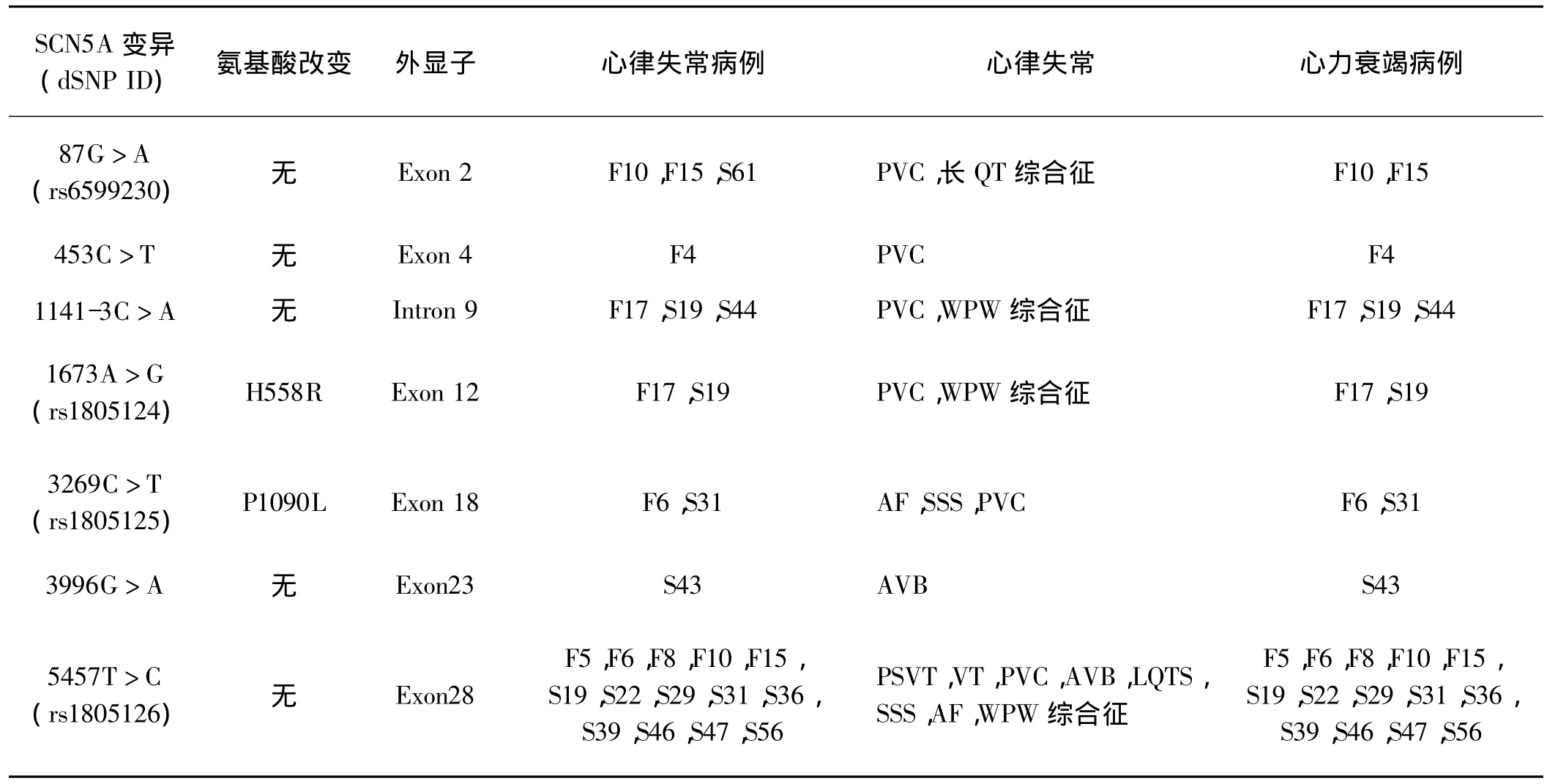
表2 本研究中的SCN5A变异Tab 2 SCN5A variants in our study
2.2 临床资料分析
在34例合并有心力衰竭的先证者中,18例存在SCN5A变异(52.9%),其中7例为家族病例,11例为散发病例;而28例无心力衰竭的先证者中只有1例有该基因的变异(3.57%)。经卡方检验,两者差异有统计学意义(χ2=15.36,P=0.000 2)。值得注意的是在合并有心力衰竭并且存在SCN5A变异的18例病例中,有17例同时存在多种类型的心律失常,如:房室传导阻滞(AVB,8例)、心房颤动(AF,2例)、LQTS(2例)、预激综合征(WPW,5例)、病态窦房结综合征(SSS,2 例)、室性心动过速(VT,7 例)、室性早搏(PVC,10例)、阵发性室上性心动过速(PSVT,3 例)。见图2。
换个角度来看,在本研究的全部病例中,有SCN5A变异的19例患者均合并有心律失常,并且18例合并心力衰竭(表2、3)。
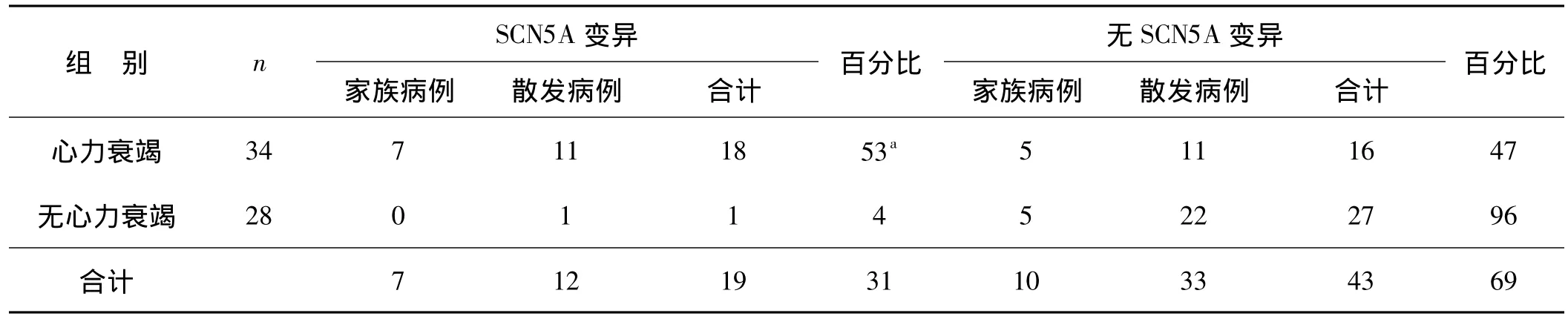
表3 LVNC心力衰竭组与无心力衰竭组SCN5A变异率的分析比较Tab 3 Incidence of SCN5A variants in the cases with heart failure and in those without heart failure
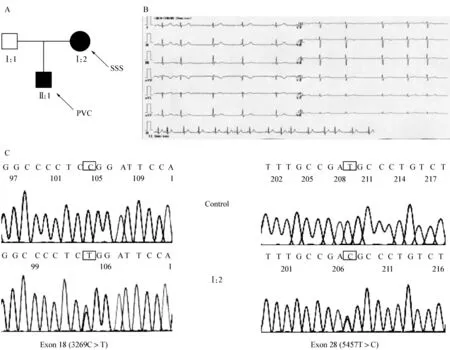
图2 家族病例6患者的临床资料及基因分析图Fig 2 The clinical and genetic information of case F6
3 讨 论
现已证实,SCN5A的基因变化与心律失常的病理生理及心肌病相关,可以影响抗心律失常药物的敏感性[7]。一些正常外显子的SNPs也可以引起钠通道生理功能的变化[14]。我们在 LVNC患者中发现了DTNA、TAZ和 LDB3这3种基因变异[4-6]。50%以上的LVNC患者合并有心律失常及心力衰竭[25],本研究结果与之相符。本研究将患者的SCN5A基因序列进行逐一扫描,深入分析离子通道基因变异与心力衰竭的关系。在患者群中,我们鉴定出极有意义的基因变异数字(包括同义的和非同义的核苷酸置换)。而且,在合并有心力衰竭的患者中有着更高的该基因变异率(53%vs4%,P=0.000 2)。因此,这些数据支持编码离子通道的基因可以潜在地决定LVNC患者预后的观点。
本研究发现的变异中,H558R碱基置换位于细胞质的Na+通道Ⅰ-Ⅱ干扰区域的链接处。以往的功能性研究证实,编码R558的微小等位基因可以显著地改变致病性SCN5A变异的表型,可以对其他变异所引起的钠通道的功能变化进行调节,起到基因内的修复作用。H558R在不同的基因变异背景中对基因功能的影响大不相同,甚至致使“基因缺失”[26]。本研究中2例H558R变异者QT间期是正常的,但是他们均有很严重的心律失常(PVC、WPW综合征)及重度心力衰竭。在合并有AF的散发病例31、合并PVC的家族病例6(先证者)及有SSS(先证者母亲)家族病例6的母亲中,我们均发现了P1090L变异。P1090位于细胞质的Na+通道Ⅱ-Ⅲ干扰区域的链接处,P1090L是一个亚洲人常见的多态现象,在Q1077缺失的情况下,P1090L可以导致一个激活中间点的显著负面转换[26]。
除c.3996C>T之外,其他的变异可在正常人群中发现。不管这些变异是否影响到氨基酸序列,显著数量的单核苷酸置换可以改变mRNA剪接的效能或精确度[5]。这些剪接改变可以是不完全的,可导致钠通道表达的细微变化,在病理条件下可以导致心脏的复极化,因此,可以影响潜在LVNC致病性突变的临床表型,对LVNC患者潜在的病理的基因变异起到修饰作用。据报道[18],Rs1805126:T>C与短 QT间期有关。本研究发现,Rs1805126:T>C与LVNC患者的心律失常及心力衰竭的高风险性相关。
LVNC合并心力衰竭者SCN5A的变异率明显高于无心衰者,提示心衰发病与该基因有密切的关系。如前所述大多数的SCN5A变异者均与多种形式的心律失常及心力衰竭相关,而且在同一个家族里,可以发现有多种心律失常表现型。例如,严重心力衰竭的第6号先证者(图2)是一位LVNC合并PVC患者,其存在两种变异,即rs1805126:T>C和p.P1090L,这两种变异均来源于其患有LVNC并合并SSS的母亲。应用回归分析,患者带有rs1805126:T>C变异的有着明显增高的心律失常及心力衰竭的风险性[OR=5.69(1.05,30.84),P=0.044]。心律失常,如多源多形性室早、室速,可继发室颤甚至猝死,加重心肌缺血,使心脏的血液动力学产生改变,严重影响该病的预后。而心室扩张和张力增高可产生早期后除极、有效不应期不均一缩短及复极不均一性。在心肌的缺血及炎性反应等因素作用下,心肌细胞间出现微小纤维化引起传导延缓、单向阻滞及心率增快并引起心室肌电传导重构。
综上所述,对LVNC患者及早进行SCN5A基因分析,应用电生理技术及时发现各种心律失常并予以早期控制,对提高LVNC的治疗效果及预后判断具有重要意义。
由于PCR-SSCP分析的敏感性相对低,本研究所报道的SNPs要低于实际值。此外,在血样分析的过程中,分析者不了解患者的临床表现,因此,避免了人为的差异。然而,由于技术及实验仪器的原因,还存在着一定的假阴性率。因此,进一步的研究期望通过细胞内酸中毒或诱导的钙超载以获得更多的新发现。
LVNC合并心律失常的患者中,SCN5A变异的发生率显著高于没有合并心律失常的患者,证实了SCN5A的变异可以增加LVNC患者心律失常发生的假设。此外,心律失常发生率提高也增加了心力衰竭的风险。由此,我们推测那些能恢复钠通道功能的药物可能为LVNC患者提供新的治疗方法。
[1]RICHARDSON P,MCKENNA W,BRISTOW M,et al.Report of the 1995 World Health Organization/International Society and Federation of Cardiology Task Force on the definition and classification of cardiomyopathies[J].Circulation,1996,93(5):841-842.
[2]CHIN T K,PERLOFF J K,WILLIAMS R G,et al.Isolated noncompaction of left ventricular myocardium:a study of eight cases[J].Circulation,1990,82(2):507-513.
[3]ENGBERDING R,BENDER F,Identification of a rare congenital anomaly of the myocardium by two-dimensional echocardiography:persistence of isolated myocardial sinusoids[J].Am J Cardiol.1984,53(1):733-1734.
[4]ICIHIDA F,TSUBATA S,BOWLES K R,et al.Novel gene mutations in patients with left ventricular noncompaction or Barth syndrome[J].Circulation,2001,103(9):1256-1263.
[5]CHEN R,TSUJI T,ICHIDA F,et al.Mutation analysis of the G4.5 gene in patients with isolated left ventricular noncompaction[J].Mol Genet Metab,2002,77(4):319-325.
[6]XING Y,ICHIDA F,MATSUOKA T,et al.Genetic analysis in patients with left ventricular noncompaction and evidence for genetic heterogeneity[J].Mol Genet Metab,2006,88(1):71-77.
[7]WANG Q,SHEN J,SPLAWSKI I,et al.SCN5A mutations associated with an inherited cardiac arrhythmia,long QT syndrome[J].Cell,1995,80(5):805-811.
[8]BEZZINA C,VELDKAMP M W,VAN D B,et al.A single Na(+)channel mutation causing both long-QT and Brugada syndromes[J].Circ Res,1999,85(12):1206-1213.
[9]VATTA M,DUMAINE R,VARGHESE G,et al,Genetic and biophysical basis of sudden unexplained nocturnal death syndrome(SUNDS),a disease allelic to Brugada syndrome[J].Hum Mol Genet,2002,11(3):337-345.
[10]CHEN Q,KIRSCH G E,ZHANG D,et al.Genetic basis and molecular mechanism for idiopathic-ventricular fibrillation[J].Nature,1998,392(6673):293-296.
[11]BENSON D W,WANG D W,DYMENT M,et al.Congenital sick sinus syndrome caused by recessive mutations in the cardiac sodium channel gene(SCN5A)[J].J Clin Invest,2003,112(7):1019-1028.
[12]SCHOTT J J,ALSHINAWI C,KYNDT F,et al.Cardiac conduction defects associate with mutations in SCN5A[J].Nat Genet,1999,23(9):20-21.
[13]WANG D W,DESAI R,CROTTI L,et al.Cardiac sodium channel dysfunction in sudden infant death syndrome volume[J].Circulation,2007,115(3):368-376.
[14]MCNAIR W P,KU L,TAYLOR M R,et al.SCN5A mutation associated with dilated cardiomyopathy,conduction disorder,and arrhythmia[J].Circulation,2004,110(15):2163-2167.
[15]OLSON T M,MICHELS V V,BALLEW J D,et al.Sodium channel mutations and susceptibility ot heart failure and atrial fibrillation[J].JAMA,2005,293(4):447-454.
[16]BIENENGRAEBER M,OLSON T M,SELIVANON V A,et al.ABCC9 mutations identified in human dilated cardiomyopathy disrupt catalytic KATPchannel gating[J].Nat Genet,2004,36(4):382-387.
[17]SPLAWSKI I,TIMOTHY K W,TATEYAMA M,et al.Variant of SCN5A sodium channel implicated in risk of cardiac arrhythmia[J].Science,2002,297(5585):1333-1336.
[18]GOUAS L,NICAUD V,BERTHET M,et al.Association of KCNQ1,KCNE1,KCNH2 and SCN5A polymorphisms with QTc interval length in a healthy population[J].Eur J Hum Genet,2005,13(11):1213-1222.
[19]BEZZINA C R,SHIMIZU W,YANG P,et al.Common sodium channel promoter haplotype in asian subjects underlies variability in cardiac conduction[J].Circulation,2006,113(3):338-344.
[20]MAKITA N,TSUTSUI H.Genetic polymorphisms and arrhythmia susceptibility[J].Circ J,2007,71(Suppl A):A54-A60.
[21]ROSS R D,BOLLINGER R O,PINSKY W W.Grading the severity of congestive heart failure in infants[J].Pediatr Cardiol,1992,13(2):72-75.
[22]CONNOLLY D,RUTKOWSKI M,AUSLENDER M,et al.The New York university pediatric heart failure index:a new method of quantifying chronic heart failure severity in children[J].Pediatr,2001,138:644-648.
[23]MAEKAWA K,SAITO Y,OZAWA S,et al.Genetic Polymorphisms and Haplotypes of the Human Cardiac Sodium Channel α Subunit Gene(SCN5A)in Japanese and their Association with Arrhythmia[J].Ann Hum Genet,2005,69(PT4):413-428.
[24]SCHULZE-BAHR E,ECKARDT L,BREITHARDT G,et al.Sodium channel gene(SCN5A)mutations in 44 index patients with Brugada syndrome:different incidences in familial and sporadic disease[J].Hum Mutat,2003,21(6):651-652.
[25]ICHIDA F,HAMMAMICHI Y,MIYAWAKI T,et al.Clinical features of isolated noncompaction of the ventricular myocardium:long-term clinical course,hemodynamic properties,and genetic background[J].J Am Coll Cardiol,1999,34(1):233-240.
[26]TAN B H,VALDIVIAL C R,ROK B A,et al.Common human SCN5A polymorphisms have altered electrophysiology when expressed in Q1077 splice variants[J].Heart Rhythm,2005,2(7):741-747.
