不同生长阶段细鳞鲑(Brachymystax lenok)消化酶活性比较研究
2012-08-08徐革锋牟振波
徐革锋,刘 洋,谷 伟,牟振波
(中国水产科学研究院黑龙江水产研究所,哈尔滨 150070)
硬骨鱼类的新陈代谢是其生命活动的重要特征之一,其主要的机能表现在机体对食物的消化与吸收利用方面,而机体的消化-吸收机能与消化道结构以及相应的消化酶分布和特性的关系紧密[1]。因此,了解鱼类消化酶的分布及特性是研究其食性和代谢机能的重要途径。鱼类消化道主要呈细长的膜质管道结构,其中不同区段的消化腺分泌的消化酶类,能催化营养物质分解为可被机体吸收利用的小分子物质,从而使其获得用于维持生命、生长及繁殖等活动所需的能量与营养[1]。
细鳞鲑(Brachymystax lenok)属鲑形目、鲑科、细鳞鲑属;为易危,国家二级保护动物[2]。该鱼为肉食性鱼类,早期阶段生长较快,但对于该鱼肠道酶类分布及特性的研究较少,尤其在其幼鱼、鱼种和亲鱼阶段。由于在不同时期肠道结构组成、生理机能等都会发生很大的变化,而各种消化酶的发生也随着消化器官的发育而逐步变化完善。因此,本文研究细鳞鲑3个主要生长阶段的消化酶变化趋势以及不同消化器官内的消化酶分布规律,为细鳞鲑的消化生理和营养需求研究提供理论依据。
1 材料与方法
1.1 实验鱼
细鳞鲑幼鱼、鱼种和亲鱼均来自于黑龙江水产研究所渤海冷水性鱼类实验站,试验前暂养于水族箱,适应期1周。3个阶段的实验鱼各10尾,幼鱼、鱼种和亲鱼的平均体长分别为(18.80±4.51)、(33.50±3.57)和(42.50±5.75)cm,平均体重分别为(105.50±15.78)、(320.50±57.00)和(935.00±77.85)g。幼鱼、鱼种和亲鱼阶段投喂的饲料粗蛋白含量分别为42%、22%和52%,粗脂肪含量分别为20%、55和15%。
1.2 样品制备
各生长阶段分别挑取5尾体质健康,且体表无损伤的细鳞鲑个体进行深度麻醉(麻醉剂:苯氧乙醇),之后将实验鱼放置于碎冰上解剖,取出整个消化道,分成食道、胃、幽门盲囊、前肠、中肠和后肠5个部分,剔出内容物与肠系膜,采用0~4℃生理盐水冲洗干净,迅速放入液氮中冷冻,之后将冷冻样品置于-80℃超低温冰箱内保存。
1.3 粗酶液制备
粗酶液的提取[3]:取出冷冻样品,置于4℃下解冻,用滤纸轻轻拭干黏膜表面,称重。将各部分组织样品剪碎后移入玻璃匀浆杯内,按样品重的10倍加入预冷的去离子水,在0~4℃条件下,将匀浆液转入冷冻离心机离心15 min(3 000 r·min-1),取其上清液(4℃下保存),用作酶活测定,在24 h内完成。
1.4 酶活力测定
蛋白酶活性测定采用Folin酚试剂法[3],定义在37℃下每分钟水解干酪素产生1 μg酪氨酸的酶量为一个酶比活力单位:
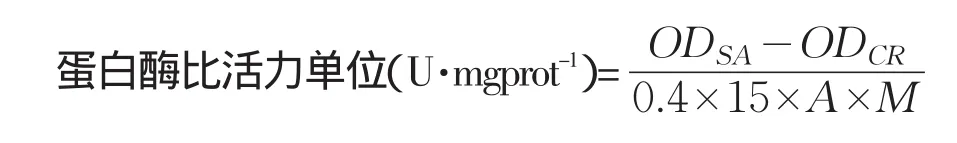
式中,ODCR:对照管吸光度;ODSA:测定管吸光度;0.4:样品量(mL);15:反应时间(min);
A:由标准曲线求出的系数;M:蛋白浓度(mg·mL-1)。
淀粉酶活性测定采用常规方法[3],定义在25℃条件下每分钟催化淀粉生成1 μg麦芽糖的酶量为一个酶比活力单位:

式中,3:反应时间(min);0.5:样品量(mL)。
脂肪酶活性测定采用聚乙烯醇橄榄油乳化液水解法[3],定义在37℃下每克组织在本反应体系中与底物反应1 min,每消耗1 μmol底物为一个酶比活力单位:

式中,ODS:标准管吸光度;454:标准管的浓度(μmol-1);4:测定管底物毫升数(mL);
0.05:样本毫升数(mL);10:反应时间(10 min)。
1.5 统计分析
所得数据用SPSS11.5统计软件处理,进行单因子方差分析(one-way ANOVA)和Duncan's多重比较,以P<0.05作为差异显著水平。
2 结果与分析
2.1 细鳞鲑不同生长阶段的消化酶活性
在幼鱼、鱼种和亲鱼3个主要生长阶段,细鳞鲑的蛋白酶、淀粉酶和脂肪酶活性呈现不同的变化趋势(见图1~3)。各生长阶段的细鳞鲑蛋白酶活性差异不显著(P>0.05)(见图1);淀粉酶活性的变化趋势是幼鱼、鱼种期逐渐增大,亲鱼期达最大值(见图2);脂肪酶活性在细鳞鲑各个消化区段均有体现,但幼鱼和鱼种的消化系统的脂肪酶活性最高,亲鱼期的脂肪酶活性较低(见图3)。
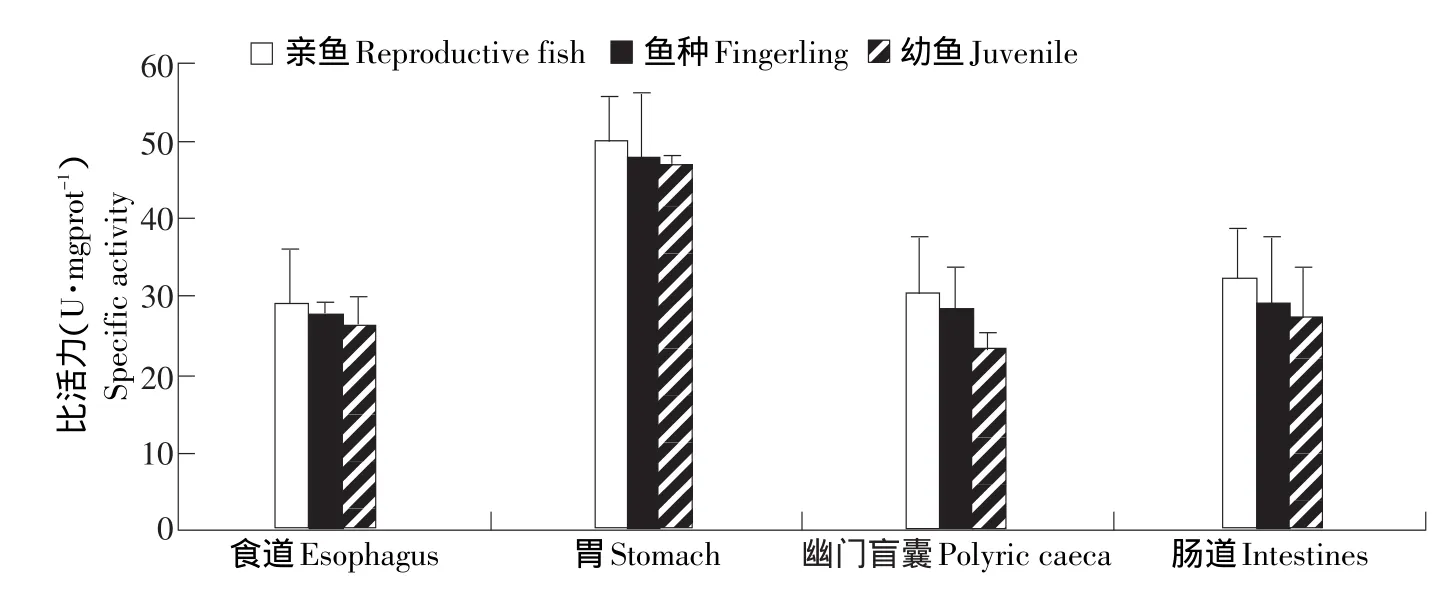
图1 蛋白酶在不同器官的活性分布Fig.1 Distribution of protease activity in the organs
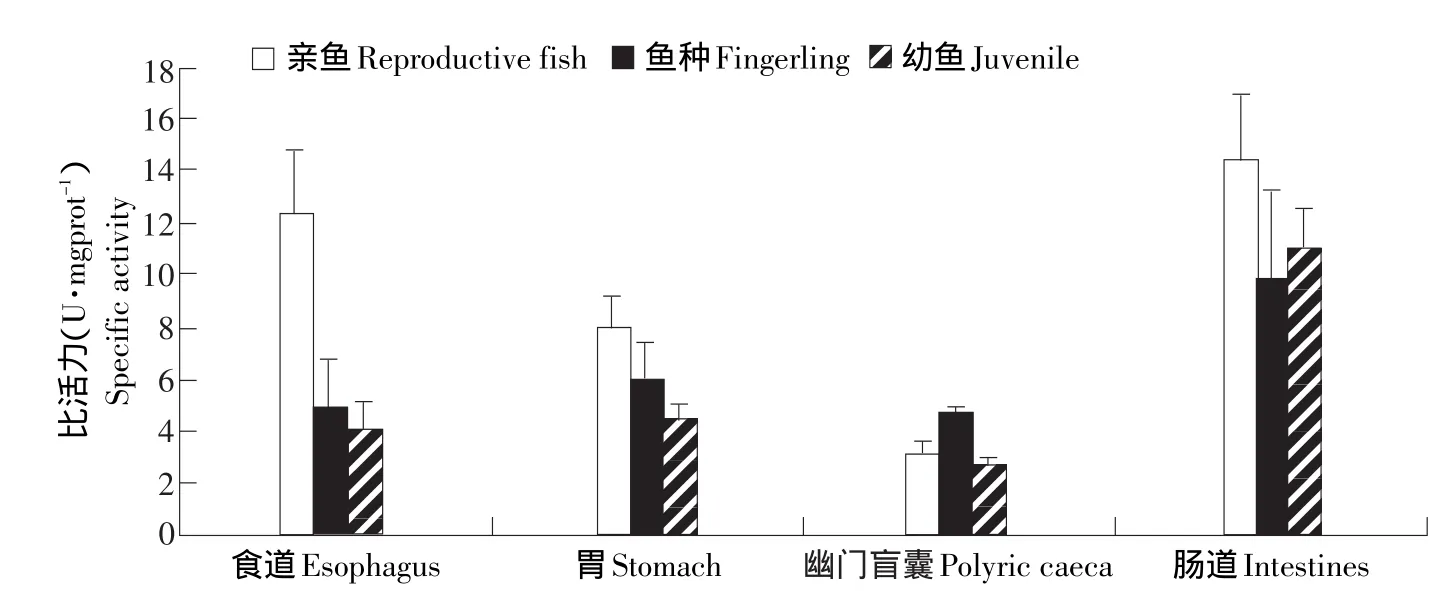
图2 淀粉酶在不同器官的活性分布Fig.2 Distribution of amylase activity in the organs

图3 脂肪酶在不同器官的活性分布Fig.3 Distribution of lipase activity in the organs
2.2 细鳞鲑不同消化道部位的消化酶分布特点
在不同消化器官中,蛋白酶主要分布在细鳞鲑的胃部,且亲鱼阶段肠道内蛋白酶活性较鱼种和幼鱼高,分布趋势为食道<幽门盲囊肠<道<胃;淀粉酶在各个消化区段均有分布,且活性并不高,但在前肠部位活性最高,在幽门盲囊和后肠处活性最低;脂肪酶主要分布在细鳞鲑的胃部,而且从胃向后的消化道各主要部位的脂肪酶活性变化呈递减趋势,发育到亲鱼阶段,各消化器官(除胃以外)的消化酶活性变化不大(见表1)。
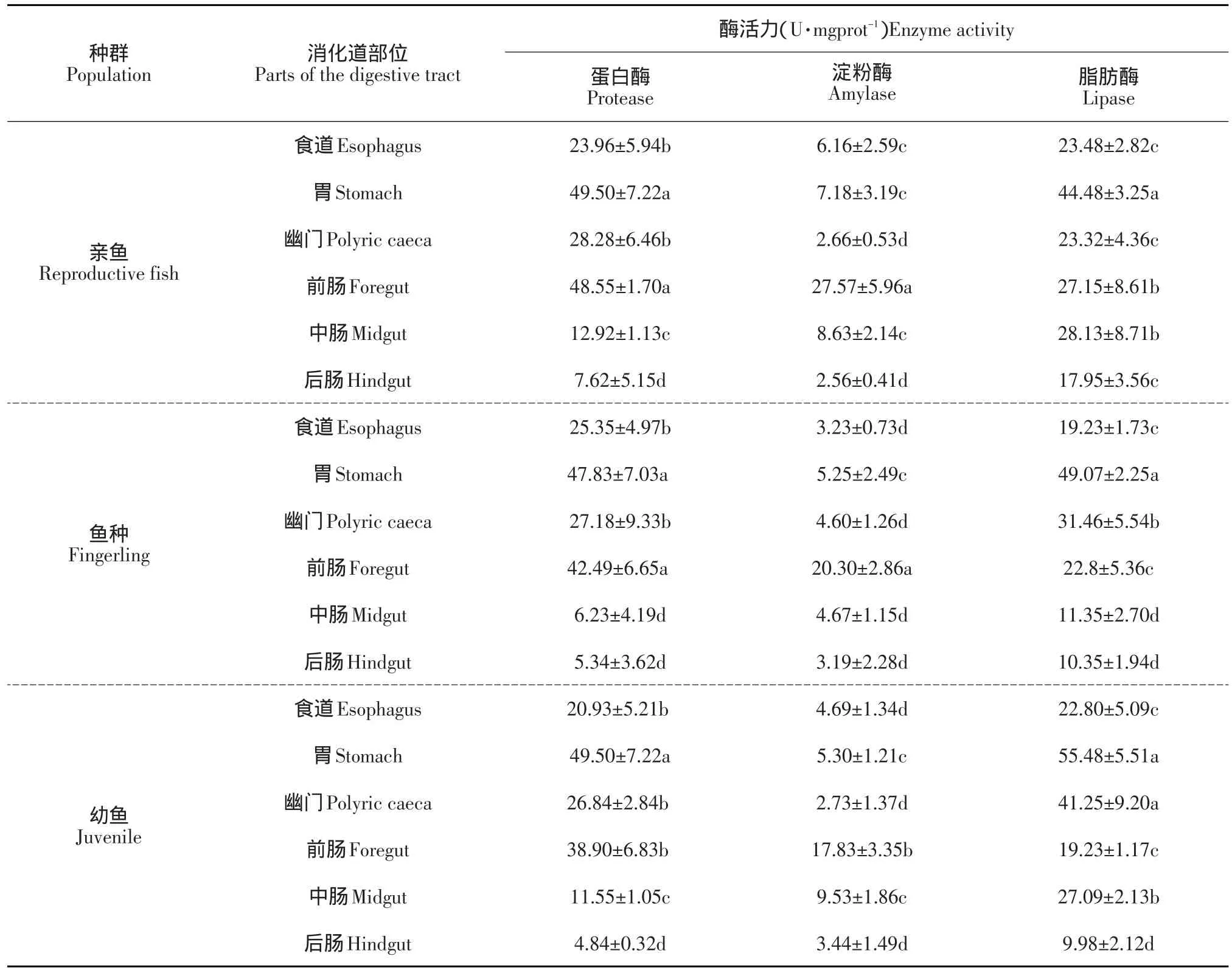
表1 不同生长阶段细鳞鲑消化系统各主要器官的消化酶活力比较Table 1 Comparison of digestive enzyme activity of B.lenok in the alimentary system at different growth stages
3 讨 论
3.1 细鳞鲑不同生长阶段的消化酶活性差异
Das认为,在鱼类生长发育过程中其主要消化酶活性的变化与食性极其相关[4]。在现代水产养殖过程中,绝大数商业养殖品种均摄食全价颗粒饲料,其食性已发生本质改变,尽管各生长阶段投喂不同营养效价的饲料,但这些饲料影响鱼类消化酶活性变化。试验结果表明,在细鳞鲑幼鱼期、鱼种期和亲鱼期的消化道内的蛋白酶活性存在不同程度的差异,但鱼种和亲鱼阶段的蛋白酶活性较高,幼鱼期略低。沈文英等的研究表明,杂食性鱼类的亲鱼期肠道淀粉酶活性最低,而幼鱼和成鱼生长阶段淀粉酶的活性较高[5]。这与本研究结果不同,淀粉酶活性在细鳞鲑鱼种和亲鱼期最高,幼鱼期的活性最低,这可能与细鳞鲑肉食食性有关。淀粉酶活性在鱼类不同生长发育阶段存在差异,这不但与发育时期有关,而且与鱼类的种属以及其食性的不同有关。脂肪酶活性在细鳞鲑不同生长发育阶段的变化较为规律,随着鱼体生长其脂肪酶活性呈递减趋势。这种规律性的变化与细鳞鲑摄食的饲料组成有极大关系,因为细鳞鲑在幼鱼和鱼种阶段主要摄取高能饲料(高脂肪饲料),而细鳞鲑在亲鱼期的培育饲料脂肪添加量相对较低。
3.2 细鳞鲑不同消化道部位的消化酶分布特点
3.2.1 蛋白酶
Das等对硬骨鱼类黑鲈(Micropterus sp.)、丁鱼岁(Phoxinus tinca)和鲤(Cyprinus carpio)的肝胰脏研究发现[4],胰脏主要分泌蛋白酶原,在肠激活酶的作用下,不但激活蛋白酶原,而且肠液还能增强蛋白酶的作用,促进蛋白酶对肠道食泥中蛋白质的消化与吸收。但本研究发现,蛋白酶主要分布于细鳞鲑的胃部,肠道蛋白酶以前肠分布最为广泛,中肠次之,这与王常安等对哲罗鲑(Hucho taimen)的研究结果[6]相一致。谭北平认为,胃蛋白酶的活性随食物性质不同而变化,凶猛鱼类胃中蛋白酶活性极高,因此认为肉食性鱼类的胃是主要消化食物中蛋白质的器官[7]。由于细鳞鲑为肉食性鱼类,以无脊椎动物、小鱼等为主要食物[8],因此其蛋白质的消化吸收主要在胃中,刘洋等研究[9]与本研究也获得相同结果。
3.2.2 淀粉酶
淀粉酶的分布因鱼种类和消化器官不同而差异较大,其活力大小随食物组成的变化也有一定的相关性,这种对生态环境的适应源自鱼类本身,一般草食性和杂食性鱼类肠道里的淀粉酶活性高于肉食性鱼类[10-12]。倪寿文等对鲤(Cyprinus carpio)、草(Ctenopharyngodon idellus)、鲢(Hypophthalmichthys molitrix)、鳙(Aristichthys nobilis)和尼罗罗非鲫(Tilapia nilotica)的研究认为,淀粉酶主要是由散布在肝脏内的胰组织分泌,并且在进入肠道后进一步被激活[13];Dhage对印度鲤科主要鱼类的研究发现,淀粉酶是由全肠分泌,且活力极高[14]。本研究结果表明,淀粉酶的分布特点为递减趋势,由高到低依次为前肠、中肠、胃、食道、幽门盲囊和后肠,说明淀粉酶主要在细鳞鲑肠道发挥高效的催化特性,由于淀粉酶原在肠道是从前至后被分泌的,因此该酶的分布特点为,前肠>中肠>后肠。比较发现,鱼类的淀粉酶活性远低于畜禽类动物,在今后的养殖管理过程中有必要在饲料中添加外源性淀粉酶,提高淀粉利用率,不但能有效降低有机物排泄量,而且还能减轻有机物对水体的污染[15]。
3.2.3 脂肪酶
Das等研究表明,鱼类的脂肪酶主要在其肝胰脏进行合成[4],而消化系统的各个部分均存在脂肪酶的分布,但脂肪酶的活性与鱼饵料的脂肪含量呈正相关性[16]。本研究发现,到亲鱼期之前细鳞鲑消化道各主要部位的脂肪酶活性变化从前至后呈递减趋势,胃内最高,幽门部次之,肠道最低。在细鳞鲑的养殖过程中,主要投喂的是进口鳟鱼饲料,这种饲料的特点是,不同生长阶段的饲料的脂肪含量不同,即幼鱼期>鱼种期>亲鱼期。这种高能饲料可能对细鳞鲑的消化道脂肪酶分布产生了影响,因此使细鳞鲑在性成熟之前,脂肪酶在消化道各个区段的活性均较高,且成规律性分布。但到了亲鱼期,由于饲料中的脂肪含量减少,使其消化道各区段的脂肪酶活性降低,且分布不明显。
4 结论
本文对细鳞鲑3个主要生长阶段消化道各种酶类活性及其分布的研究表明,蛋白酶在鱼种和亲鱼期的胃部活性最高,幼鱼期蛋白酶活性略低,细鳞鲑各生长阶段的肠道蛋白酶活性以前肠最高,中肠次之,进而说明胃内是蛋白的只要消化场所。淀粉酶活性的变化趋势是幼鱼、鱼种期逐渐增大,亲鱼期达到最大值,淀粉酶活性由高到低依次为前肠、中肠、胃、食道、幽门盲囊和后肠,说明淀粉酶主要在肠道发挥高效的催化特性;脂肪酶活性在幼鱼和鱼种期最高,且消化道各主要部位的脂肪酶活性变化从前至后呈递减趋势,胃内最高,幽门部次之,肠道最低,细鳞鲑对脂肪的消化主要在胃部,但脂肪酶活性与摄食饲料的脂肪含量密切相关。
[1] 徐革锋,陈侠君,杜佳,等.鱼类消化系统的结构、功能及消化酶的分布与特性[J].水产学杂志,2009,22(4):49-55.
[2] 汪松主编.中国濒危动物红皮书[M]:鱼类(乐佩琦,陈宜瑜分主编)(第一版),北京:科学出版社,1998:29-37.
[3] 李建武,萧能赓,余瑞元,等.生物化学实验原理和方法[M].北京:北京大学出版社,1994:311-312.
[4] Das K M,Tripathi S D.Studies on the digestive enzymes of grass carp,Ctenopharyngodon idella(Val.)[J].Aquac,1991,92(1):21-32.
[5] 沈文英,寿建昕,金叶飞,等.银鲫消化酶的研究[J].上海水产大学学报,2002,11(3):193-198.
[6] 王常安,徐奇友,畅雅萍,等.不同促摄食物质对哲罗鲑生长、体成分、消化酶和血液生化指标的影响[J].安徽农业大学学报,2011,38(1):65-71.
[7] 谭北平.太湖沿岸区几种肉食性鱼类蛋白酶活性的研究[J].湖北农学院学报,1995,15(2):96-98.
[8] 董崇智,李怀明,牟振波,等.中国淡水冷水性鱼类[M].哈尔滨:黑龙江科学技术出版社,2001:51-53.
[9] 刘洋,牟振波,徐革锋,等.水温对细鳞鱼幼鱼消化酶活性的影响[J].水产学杂志,2011,24(3):6-9.
[10] Kenji takil,Sadao Shimeno.The effect of feeding stimulant indied on digestive enzymes in carp intestine[J].Bull Japan Soc Science Fish,1986,52(8):1449-1454.
[11] 吴莉芳,吴亚男,陈玉珂,等.2种大豆蛋白源替代鱼粉对埃及胡子鲇蛋白酶和淀粉酶活力的影响[J].上海交通大学学报:农业科学版,2010,28(2):119-123.
[12] 吴莉芳,赵晗,秦贵信,等.2种大豆蛋白替代鱼粉蛋白对鲤蛋白酶和淀粉酶活力的影响[J].吉林农业大学学报,2011,33(2):222-226.
[13] 倪寿文,桂远明,刘焕亮.草鱼、鲤、鲢、鳙和尼罗罗非鲫淀粉酶活性的比较研究[J].大连水产学院学报,1992,7(1):24-31.
[14] Dhage K P.Studies of the digestive enzymes in the three species of major carps of India[J].Biol Sci,1968(11):63-74.
[15] 周景祥,陈勇,黄权,等.鱼类消化酶的活性及环境条件的影响[J].北华大学学报,2001,2(1):70-73.
[16] 尾崎久雄.鱼类消化生理学(上、下册)[M].吴尚忠译.上海:上海科技出版社,1985.
