林蛙油灌胃对小鼠肝组织中Cu/ZnSOD基因表达的影响
2012-09-20杜智恒王慰慰白秀娟
杜智恒,王慰慰,白秀娟
(东北农业大学动物科学技术学院,哈尔滨 150030)
中国林蛙(Rana chensinensis)作为一种药用动物,其输卵管的干燥物即林蛙油是我国传统名贵药材,具有补血壮体安神、美容养颜抗衰老、补肾延年益寿、平喘润肺抗疲劳等功效。人体衰老是由于体内产生过量自由基而没有得到及时清除引起的,而超氧化物歧化酶(Superoxide dismutase,SOD)则是清除这些自由基的重要酶之一[1],SOD广泛存在于生物体内,能够催化超氧阴离子发生歧化反应,专门清除生物体内超氧阴离子,平衡机体氧自由基,防止机体发生各种生理病变[2-4]。例如由于机体某些病理或生理(如衰老)原因,常常会出现因SOD骤减而导致自由基剧增等现象的发生[5]。目前已发现林蛙油能够显著延长果蝇平均寿命和最高寿命,其机制为升高SOD活性,降低过氧化脂质生成[6]。
根据SOD结合金属离子不同,将其分为FeSOD、MnSOD、Cu/ZnSOD、NiSOD、MnFeSOD和Fe/ZnSOD六种类型[7],目前研究较多的是Cu/ZnSOD和MnSOD。MnSOD主要存在原核生物和真核生物线粒体中,在甲壳类细胞质中也有存在[8],而Cu/ZnSOD广泛存在于细胞内,是集体防御氧化损伤的一种重要金属酶,能转移性地清除超氧阴离子自由基,在维持氧自由基平衡方面起着重要作用[9],并且占总SOD的90%。杜金芳等进行猪Cu/ZnSOD基因mRNA表达对肌肉抗氧化及肉质特性影响的研究,结果表明Cu/ZnSOD基因的mRNA表达存在品种和组织差异,品种间Cu/ZnSOD基因mRNA的差异表达通过影响肌肉中SOD活性,进而参与调控肉质特性形成[10]。Yuan等研究豚鼠(Cavia porcellus)不同组织中不同发育时期的抗氧化酶基因Cu/ZnSOD和MnSOD mRNA的表达水平。结果表明青春期豚鼠CuZnSOD mRNA表达由强至弱顺序:肝>肾>肺>脾>心;MnSOD mRNA表达在心中最高,其组织特异性表达顺序:心>肾>肝>肺>脾。说明在不同发育阶段Cu/ZnSOD和MnSOD发挥着不同的作用[11]。
本研究以小鼠为动物模型,通过直接灌胃方法,验证林蛙油抗氧化、抗衰老作用;利用Realtime PCR的方法分析小鼠肝脏组织中与抗氧化相关基因Cu/ZnSOD时空表达规律。
1 材料与方法
1.1 材料
1.1.1 实验分组
雌性5周龄鼠和雌性15月龄鼠各120只,分别随机分为4组,其中每组各30只,分笼饲养,每笼5只[1]。
1.1.2 林蛙油的处理
本试验所用林蛙油为经过烘焙碾碎的林蛙油细粉(由哈尔滨大通集团有限公司提供),每次灌胃前用豆油稀释林蛙油细粉,豆油添加量为每只鼠0.3~0.6 mL。
1.1.3 林蛙油给药剂量及时间
根据人和小鼠用药剂量的换算方法,小鼠用药剂量是人用药剂量的9倍[12],换算出小鼠每天的用药剂量应为0.45 g·kg-1。本试验共分3个剂量组,其中低剂量组给药量为0.45 g·kg-1,中剂量组给药量为1.35 g·kg-1,高剂量组给药量为2.25 g·kg-1;最后一组为对照组,该组小鼠只以豆油灌胃。
给药时间为每天1次,连续45 d。每天下午3点灌胃,试验期每间隔7 d称体重1次。
1.1.4 组织样品采集
本实验所用组织样品为小鼠肝脏组织,采集时间分别在灌胃小鼠15、30和45 d时,通过屠宰小鼠采集肝脏组织。每次所采集的肝脏组织样品均置于-80℃冰箱中保存待用,用于提取总RNA。
1.2 方法
1.2.1 总RNA的提取
每个样品取约400 mg肝脏组织放入坩埚,立即倒入液氮进行充分研磨,按海基RNA提取试剂盒说明书推荐方法提取总RNA。将经紫外分光光度计和琼脂糖凝胶甲醛变性电泳检测合格的RNA,按照北京天根生物工程公司反转录试剂盒说明书要求将其反转录成cDNA备用。
1.2.2 引物设计
在NCBI中检索小鼠目的基因序列,根据引物设计原则,设计实时荧光定量PCR引物。引物序列见表1。
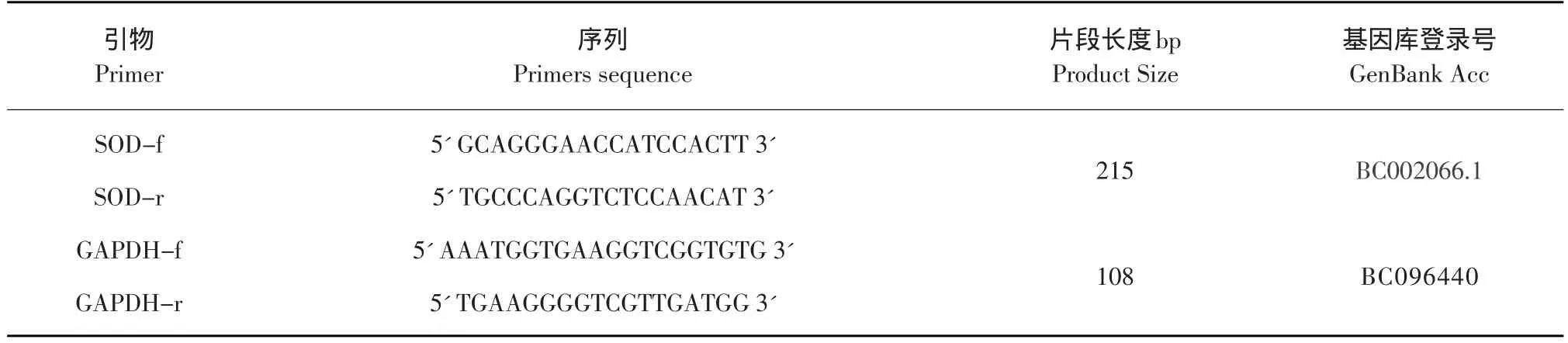
表1 Real time PCR引物序列Table1 Real time PCR primers sequence
1.2.3 RT-PCR反应条件
反应物组成:共25 μL体系,其中包括:灭菌去离子水,cDNA模板1 μg·μL-1,10× PCR Buffer,dNTP 2.5 mmol·L-1,特异引物10 pm·μL-1,rTaq聚合酶0.5 U·μL-1。反应体系为水16.3 μL,Buffer2.5 μL,dNTP2.0 μL,上下游引物各1 μL,cDNA模板2.0 μL,rTaq酶0.2 μL。
PCR扩增的循环参数为94℃5 min;94℃30 s,59℃30 s,72℃30 s循环次数为35;72℃延伸7 min。
1.2.3 标准曲线的制作
将同一组织cDNA混合作为标准品,以5×梯度稀释:5-4,5-3,5-2,5-1,1,共 5 个梯度。引物分别为管家基因GAPDH和SOD基因的引物。每个基因的每个梯度做3次重复。SOD基因在各胁迫处理中表达的检测与标准曲线均在同一次PCR循环中进行,以保证标准曲线和样品扩增的PCR条件的一致性。PCR结束后,由7500PCR仪所得数据进行计算分析,根据某一基因标准曲线所得的线性计算公式,将该基因在各样品中的Ct值代入线性公式,得到相对浓度。同一模板中SOD基因和GAPDH基因相对浓度比值即为SOD基因的相对表达水平。其中,SOD基因在灌胃豆油的对照组表达量设定为1.0。
1.2.4 Real time PCR反应条件
按照哈尔滨海基生物科技有限公司荧光定量PCR试剂盒(SYBR Green)说明书操作:
1.50μL标准PCR定量反应体系:

2.混匀定量体系,切忌剧烈震荡。
3.分装。
4.Real-Time PCR反应条件,采用两步法:

5.将PCR管放入热循环仪并启动循环程序。
6.进行PCR产物融解曲线的分析。
1.2.5 统计分析方法
所有数据均以均数±标准差(X±S)表示,运用SPSS 17.0软件采用f检验进行统计分析。P<0.05或P<0.01有统计学意义。
2 结果与分析
2.1 总RNA的分离
获得小鼠肝脏组织的总RNA经紫外分光光度计测定,A260/A280比值均为1.8~2.0之间,甲醛凝胶电泳后可清晰见到18S和28S两条核糖体RNA条带(见图1),说明本试验肝脏组织在保存和提取过程中无明显RNA降解发生,总RNA是完整的。
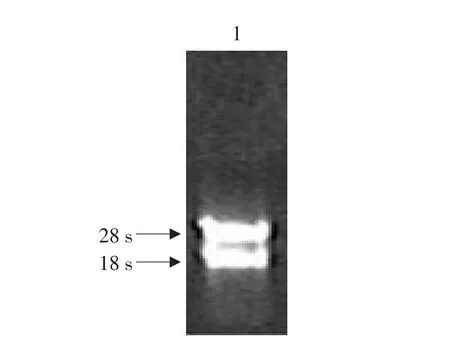
图1 小鼠肝脏组织总RNA 1%甲醛琼脂糖凝胶电泳分析Fig.1 1%formaldehyde agarose gel electrophoresis analysis of liver total RNA from mice
2.2 RT-PCR扩增结果
根据小鼠(BC096440)GAPDH基因和(BC002066.1)SOD基因的DNA序列各设计一对引物,均得到一条特异性扩增条带,与预期扩增片段大小相一致,大约为108 bp(见图2)和215 bp(见图3)。

图2 引物GAPDH RT-PCR扩增片段Fig.2 PCR amplify results of primer GAPDH

图3 引物SOD RT-PCR扩增结果Fig.3 PCR amplify results of primer SOD
2.3 GAPDH基因标准曲线的制作
利用Real time PCR的标准曲线法,GAPDH基因在肝脏组织中的标准曲线和融解曲线如图4、5所示。

图4 肝脏中GAPDH基因的标准曲线Fig.4 Standard curve of GAPDH gene in the liver

图5 肝脏中GAPDH基因的融解曲线Fig.5 Dissociation curve of GAPDH gene in the liver
2.4 SOD基因在肝脏中的表达
2.4.1 SOD基因标准曲线的制作
以GAPDH基因作参照,用引物SOD扩增,每个梯度重复3次。SOD基因在肝组织中的标准曲线和融解曲线见图6、7。

图6 肝脏中SOD基因的标准曲线Fig.6 The standard curve of SOD gene in the liver
图7 肝脏中SOD基因的融解曲线Fig.7 Dissociation curve of SOD gene in the liver
2.4.2 SOD基因在不同龄小鼠肝组织中的表达
根据标准曲线计算出SOD基因相对表达量,检测不同剂量林蛙油灌胃后肝组织中SOD基因表达差异(见图8、9)。
经数据统计分析发现,5周龄鼠灌胃第15天时0.45 g·kg-1剂量组肝组织中SOD基因表达量增加,与对照组差异极显著(P<0.01),2.25 g·kg-1剂量组SOD基因表达量有增加的趋势,但不显著;灌胃30和45 d时,各剂量组与对照组基本一致,2.25 g·kg-1剂量组有一个抑制SOD基因表达的趋势。说明5周龄鼠灌胃0.45 g·kg-1剂量15 d时,肝组织中SOD基因表达量最高(见表2、图8)。
15月龄鼠灌胃15 d时,1.35g·kg-1剂量组与对照组相比肝组织中SOD基因表达量有增加的趋势;灌胃第30天和45天时1.35 g·kg-1剂量组肝脏SOD基因表达量增加,与对照组差异极显著(P<0.01),其他剂量组与对照组比较差异不显著。因此15月龄鼠在灌胃1.35 g·kg-1剂量30 d时,肝组织中SOD基因表达量最高(见表3、图9)。

表2 SOD基因在不同灌胃剂量组5周龄鼠肝脏组织中的表达量Table2 SOD genes expression with different amounts of gastric lavagethe in youth rat liver
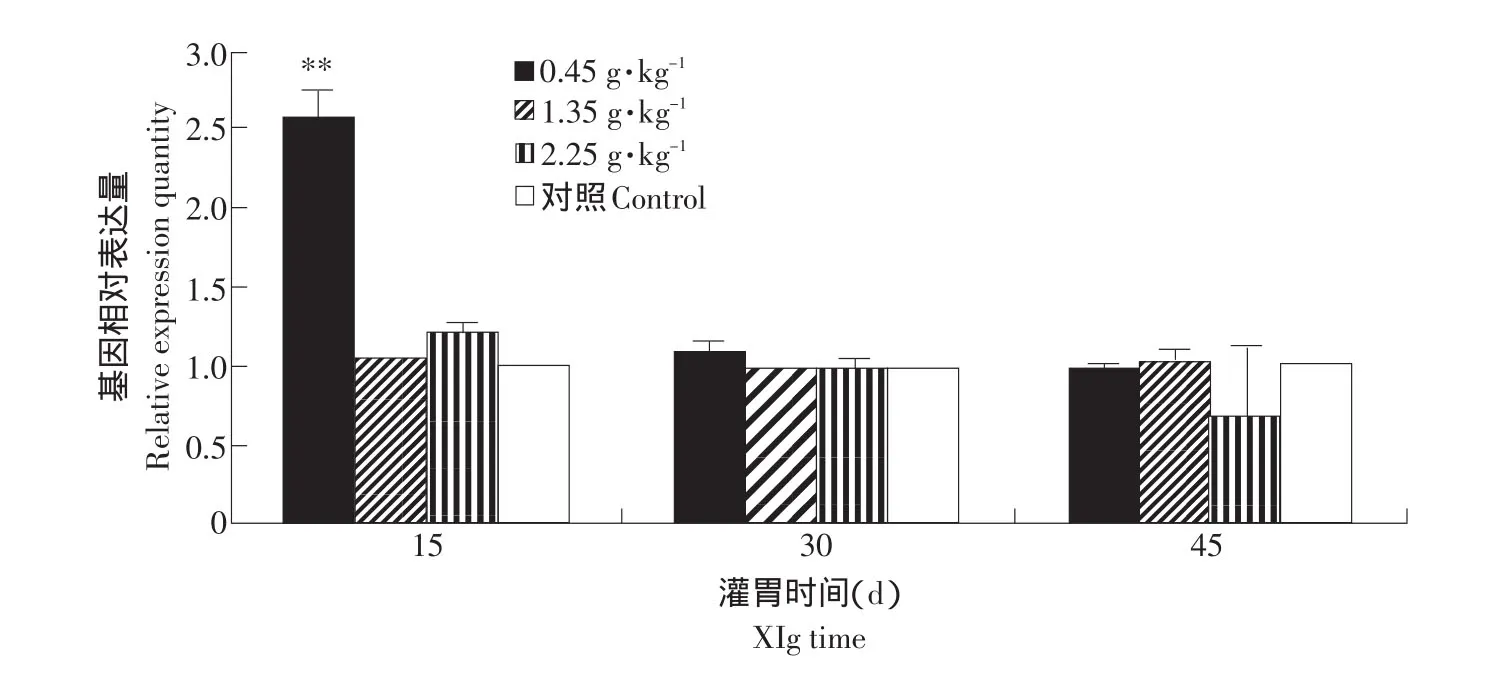
图8 SOD基因在不同灌胃剂量组5周龄鼠肝脏组织中表达量的变化Fig.8 Volume changes of SOD gene fed the liver tissue in the different dose groups of young rats

表3 SOD基因在不同灌胃剂量组15月龄鼠肝脏组织中的表达量Table3 SOD genes expression with different amounts of gastric lavagethe in old rat liver

图9 SOD基因在不同灌胃剂量组老年鼠肝脏组织中表达量的变化Fig.9 Volume changes of SOD gene fed the liver tissue in the different dose groups of old rats
3 讨论与结论
据研究,一定剂量林蛙油可以增加卵巢、红细胞及血清中SOD活性,降低肝脏及脑组织中MDA含量[13]。本试验通过对小鼠灌胃不同剂量的林蛙油,检测其肝组织中Cu/ZnSOD基因的表达规律。结果表明,5周龄组和15月龄组小鼠灌胃林蛙油后,肝组织中Cu/ZnSOD基因表达量显著增加,但总体上看,5周龄鼠0.45 g·kg-1剂量组Cu/ZnSOD基因表达增加量要普遍高于2.25 g·kg-1剂量组,但与1.35 g·kg-1剂量组差异不显著;而15月龄鼠1.35 g·kg-1剂量组Cu/ZnSOD基因表达增加量要显著高于0.45 和2.25 g·kg-1剂量组,但0.45和2.25 g·kg-1剂量组差异不显著;15月龄组Cu/ZnSOD基因表达量升高的速度较慢,一般在灌胃第30天或第45天才出现显著差异。高浓度与低浓度林蛙油对Cu/ZnSOD基因表达影响的差异,可能是由于过高浓度的林蛙油已经超过了小鼠身体所能接受的极限值,从而引起机体的一些不适反应,对目的基因mRNA转录有一定的抑制作用。并且15月龄鼠与5周龄鼠相比,体内SOD酶活性已经降低、SOD基因表达量亦下降,林蛙油的活性物质作用于靶器官时对自由基造成的损伤需要时间修复,因此15月龄鼠的Cu/ZnSOD基因表达量上调缓慢。表明SOD在衰老过程中扮演着重要角色。Orr曾将Cu/ZnSOD基因导入果蝇,导致转基因株具有多个复制的Cu/ZnSOD基因,从而寿命比野生型长1/3[14]。另外,2004年王春花研究发现,不同月龄快速老化模型鼠肝细胞中Cu/ZnSOD基因表达随年龄的增加其mRNA的表达量具有明显的下降趋势(P<0.01)[15]。
本研究证明林蛙油具有明显的抗氧化抗衰老作用。在衰老过程中SOD基因随年龄的增长,其表达量呈下降趋势。其机制是自由基直接与核酸反应引起RNA主链断裂,碱基降解及氢链破坏,对热的稳定性发生改变。由于MDA引起交联,使遗传物质破坏,从而影响传递信息的功能以及转录与复制的特性,导致以mRNA为直接模板的蛋白质合成能力下降并产生合成差错,从而引起酶的减少和失活。随着分子生物学技术的日趋发展,衰老机制的研究达到基因水平,本研究为从分子水平上阐明抗氧化抗衰老作用机制奠定初步理论基础。
[1]Kakarla P,VadluriG,Reddy K S,et al.Vulnerability of themid aged rat myocardium to the free age2 induced oxidative stress:Influence of exercise training on antioxidant defense system[J].Radic Res,2005,39:121-127.
[2]傅晓龙,刘洪珍.运动性肾组织氧化损伤与抗氧化能力[J].中国临床康复,2006,10(36):123-125.
[3]Carter A B,Tephly L A,Venkataraman S,et al.High levels of catalase and glutathione peroxidase activitydampen H2O2signaling in human alveolar macrophages[J].Am J Resp Cell Mol Biol,2004,31(1):43-53.
[4]Crack P J,Taylor J M.Reactive oxygen species and the modulation of stroke[J].Free Radical Biol Med,2005,38(11):1433-1444.
[5]曾庆平,郭勇.SOD基因的组织结构、表达与分子克隆[J].药物生物技术,1995,2(2):46-51.
[6]姚晖,姚锐,原海晓,等.哈蟆油对D-半乳糖致衰老模型雌性大鼠的实验研究[J].时珍国医国药,2010,2(5):1148-114.
[7]张克烽,张子平,陈芸,等.动物抗氧化系统中主要抗氧化酶基因的研究进展[J].动物学杂志,2007,42(2):153-160.
[8]Winton Cheng,Ying-Hsiu Tung,Tzu-Ting Chiou,et al.Cloning and characterisation of mitochondrial manganese superoxide dismutase(mtMnSOD)from the giant freshwater prawn Macrobrachium rosenbergii[J].Fish Shellfish Immunol,2006,21(4):453-466.
[9]Noor R,Mittal S,Iqbal J.Superoxide dismutase-applications and relevance to human diseases[J].Med Sci Moint,2002,8(9):210-215.
[10]杜金芳,曾勇庆,陈伟,等.猪CuZnSOD基因的克隆、表达及功能分析[J].遗传,2010,32(10):1037-1042.
[11]Yuan H T,Bingle C D,Kelly F J.Differential patterns of antioxidant enzyme mRNA expression in guinea pig lung and liver during development[J].Biochim Biophys Acta,1996,1305(3):163-171.
[12]黄继汉,黄晓晖,陈志扬,等.药理试验中动物间和动物与人体间的等效剂量换算[J].中国临床药理学与治疗学,2004,9(9):1069-1072.
[13]金莉莉,刘德文,王秋雨.中国林蛙卵卵油及输卵管对红细胞SOD活性的影响[J].中国公共卫生,2002,18(5):607.
[14]Orr W C,Sohal R S.Extension of life-span by overexpression of superoxide dismutase and catalase in Drosophila melanogaster[J].Science,1994,263(5150):1128-1130.
[15]王春花,刘克明,刘玉清.SOD基因表达与衰老的相关性[J].中国公共卫生,2004,20(8):953-954.
