斑点叉尾鮰hepcidin抗菌肽在大肠杆菌中的融合表达
2012-08-08赵冬梅
赵冬梅,陶 妍
(上海海洋大学食品学院,上海 201306)
Boman首先从惜古比天蚕蛹(Hyalophora cecropia)的免疫血淋巴细胞中分离到高效抗菌肽cecropin以来[1],至今已经有约2 000多种抗菌肽被分离,主要来自于两栖动物、甲壳动物、鸟类、鱼类、哺乳动物和人类[2]。抗菌肽一般为富含带正电荷氨基酸的碱性小分子,氨基端亲水、羧基端疏水,具有两性性质及广谱抗菌性[3],被认为是抗生素的最佳替代品。此外,部分抗菌肽对胰蛋白酶或胃蛋白酶稳定,并对某些真菌、原虫、病毒和癌细胞具有杀伤作用[4]。
Hepcidin又称LEAP-1(Liver-expressed antimicrobial peptide 1),是一种主要由肝细胞产生和分泌的小分子阳离子肽,具有较广谱抗菌活性。它是由Kruase等[5]于2000年首次从人血清中分离出,次年又由Park等[6]从人尿液中分离,以后从哺乳动物、两栖类动物和鱼类中亦发现类似于hepcidin的同源基因[7]。hepcidin的成熟肽存在三种形式,分别为25个氨基酸(Hepc 25)、22个氨基酸(Hepc 22)和20个氨基酸(Hepc 20)的小肽,Hepc 25是主要存在形式。机体细胞中的hepcidin含量甚微,提取纯化困难,而化学合成成本高,根本无法大量获得。因此,基于重组DNA表达的基因工程技术无疑是制备hepcidin抗菌肽的最佳方法[8-10]。
近年来关于抗菌肽重组DNA表达方面的研究报道不少,但主要集中于哺乳类、昆虫类和两栖动物等[7]。相比之下,关于鱼类抗菌肽基因克隆方面的研究报道较少,Bao等通过对斑点叉尾鮰(Ictalurus punctatus)进行细菌感染试验,从其肝脏中分离和克隆了hepcidin的全长cDNA,并考察了该基因在不同组织中的表达水平[11]。重组DNA技术在鱼类抗菌肽制备中的应用则甚少。据此,本文以斑点叉尾鮰肝脏组织为材料,以成熟肽为25个氨基酸的hepcidin为研究对象,通过RT-PCR对编码其原前体肽(包括前体肽和成熟肽)的cDNA进行克隆;选择pET32a(+)为表达质粒、E.coliBL21(DE3)为工程菌,构建原核表达系统,在IPTG诱导下,实现hepcidin原前体肽在大肠杆菌中的融合表达。
1 材料与方法
1.1 材料
斑点叉尾鮰(体重800 g,体长35 cm)1尾购自上海市浦东果园农贸市场。鲜活鱼运至实验室后,立即用钝器击杀取其肝脏分割成0.5 cm见方小块,保存于-80℃冰箱待用。
1.2 总RNA提取和第一股cDNA合成
采用 Trizol试剂(Invitrogen,Carlsbad,CA,USA),按照说明书对斑点叉尾鮰的肝脏组织进行总RNA提取(100 mg∶1 mL),经75%乙醇纯化后的总RNA溶解于10 μL DEPC·H2O中。
第一股cDNA的合成根据M-MLV RTase cDNA Synthesis Kit(Takara,Otsu,Japan)说明书进行。2 μL总RNA、5 μL AP(Adapter Primer)通用引物、2 μL ddH2O混匀,70℃保温10 min,冰浴1~2 min;依次 加 入 4 μL 5 × First strand buffer、 4 μL dNTP mixture(2.5 mmol·L-1)、 2 μL DTT(0.1 mol·L-1),42℃保温2 min,再加入1 μL Reverse Transcriptase M-MLV(RNase H-)(200 U·L-1)保温 70 min;70 ℃保温15 min、冰上冷却后得到第一股cDNA。
1.3 Hepcidin原前体肽基因的PCR扩增和测序
参考斑点叉尾鮰hepcidin的全长cDNA序列(GenBank:AY834209)设计一对引物,正向引物和反向引物分别为H-F(5'ATGAGGGCAATGAGC ATCGCG 3')和H-R(5'TTAGAACCTGCAGCAGAA CCC 3'),用于扩增hepcidin全长cDNA。以斑点叉尾鮰肝脏的第一股cDNA为模板,PCR反应体系和条件如下:2.5 μL 第一股 cDNA、各 4.0 μL 10 μmol·L-1的正向和反向引物、1.0 μLTaqplus DNA polymerase(5 U·μL-1)(TaKaRa,Otsu,Japan)、10 μLTaqplus Buffer、8.0 μL dNTP Mixture,用无菌水将反应液调至100 μL;94℃预变性3 min、94℃变性30 s、57℃退火30 s、72℃延伸1 min、最终72℃延伸5 min,反应共进行30个循环。将该DNA片段经DNA纯化试剂盒(天根生物科技公司,北京)纯化后,作为第二次PCR的模板,设计一对分别含EcoR I和HindIII酶切位点的引物H-MQF(5'CGGAATTCTTACCATCTGAGGTACGGCTC 3')和HMQR(5'CCCAAGCTTTTAGAACCTGCAGCAGAAC CC 3'),用于扩增编码hepcidin原前体肽的cDNA片段。PCR反应体系和条件同上,除了退火温度改为58℃。目的片段“pIH”与pMD19-T simple质粒(TaKaRa,Otsu,Japan)按3:1比例、在T4DNA连接酶的作用下,16℃保温2 h,转化感受态细胞DH5α,37℃培养过夜;挑取5个阳性克隆由上海生工生物工程有限公司进行DNA测序。
1.4 pET32a-pIH重组表达质粒的构建
上述含“pMD19-pIH”重组质粒的阳性克隆经LB液体培养过夜后,进行质粒提纯(天根生物科技公司,北京),然后对其进行EcoRI和HindⅢ双酶切,酶切产物经1%琼脂糖凝胶电泳检验后,切下目的片段“pIH”进行DNA纯化。另一方面,对pET32a(+)表达质粒(Novagen,Darmstadt,Germany)进行同样的双酶切,酶切产物经0.5%琼脂糖凝胶电泳检验后,切下线性质粒条带进行DNA纯化。将含酶切位点的目的片段“pIH”与线性的pET32a(+)表达质粒按7:1比例、在T4DNA连接酶的作用下,16℃保温16 h;然后转化感受态细胞DH5α同上进行DNA测序确证。
1.5 Hepcidin原前体肽的原核表达及表达产物的纯化
上述含“pET32a-pIH”重组表达质粒的阳性克隆经LB液体培养后,进行质粒提纯。5 μL重组表达质粒转化工程菌E.coliBL21(DE3),37℃培养过夜;挑选阳性克隆接种于20 mL含氨苄青霉素(100 mg·mL-1)的LB培养液中,37 ℃、150 r·min-1培养至OD600为0.6~1.0后,按1:50转接到1 000 mL抗性LB培养液中,37℃、220 r·min-1培养至OD600为0.6~0.8;加入诱导剂IPTG至终浓度为1 mmol·L-1,37℃、110 r·min-1培养12 h后,将菌液离心10 min(4 ℃,8 000 r·min-1);用1/10培养液体积的1×PBS缓冲液(pH 7.4)重悬沉淀,冰上进行超声波细胞破碎后,离心10 min(4 ℃,12 000 r·min-1);上清液通过Profinia蛋白纯化系统(Bio-rad,Laboratories,Inc.,USA),经固化金属离子亲和层析(IMAC)纯化得到目的“融合蛋白”。
1.6 Tricine-SDS-PAGE分析
Tricine-SDS-PAGE分析参照Schagger的方法[12]。浓缩胶浓度4%,分离胶浓度16%,各样品的上样量为20 μL。电泳结束后用0.1%的考马斯亮蓝R-250对凝胶进行染色,用25%的甲醇和7%的醋酸混合液脱色。低分子质量标准蛋白由天根生物科技公司提供。
2 结果与分析
2.1 斑点叉尾鮰hepcidin原前体肽的cDNA克隆及其推断的氨基酸序列
以斑点叉尾鮰肝脏的第一股cDNA为模板,扩增得到编码hepcidin全长氨基酸序列的约291 bp的片段(见图1A);进一步以该片段为模板,根据巢式PCR的原理,通过设计添加EcoRI和HindIII酶切位点的引物,扩增得到编码hepcidin原前体肽(除去信号肽的氨基酸序列)的约236 bp的片段“pIH”(见图1B)。由图2可见,根据推断的氨基酸序列,该片段编码了由72个氨基酸残基组成的hepcidin原前体肽(47个残基组成的前体肽+25个残基组成的成熟肽),且在成熟肽区域存在8个保守的半胱氨酸残基,它们在空间结构上可形成四对二硫键。本文克隆的编码原前体肽的cDNA序列与参考序列相比存在2个核苷酸差异,因而导致前体肽的2个氨基酸差异。经DNA测序,证明两个酶切位点已成功引入该片段(见图3A)。
2.2 斑点叉尾鮰与其他生物之间的hepcidin原前体肽氨基酸序列比较
图2显示斑点叉尾鮰与其他鱼类及哺乳动物之间的hepcidin原前体肽的氨基酸序列比较。结果表明,斑点叉尾鮰与长鳍叉尾鮰、黄颡鱼之间的序列同源性分别为96%和72%,与斑马鱼的2个同工型之间显示47%~48%的同源性;而与哺乳动物之间显示很低的同源性,只有10%~15%。另一方面,不同生物之间在hepcidin原前体肽的氨基酸序列上存在多个保守性位点或区域,其中8个半胱氨酸残基是高度保守的,证明它们与hepcidin的抗菌活性密切相关。
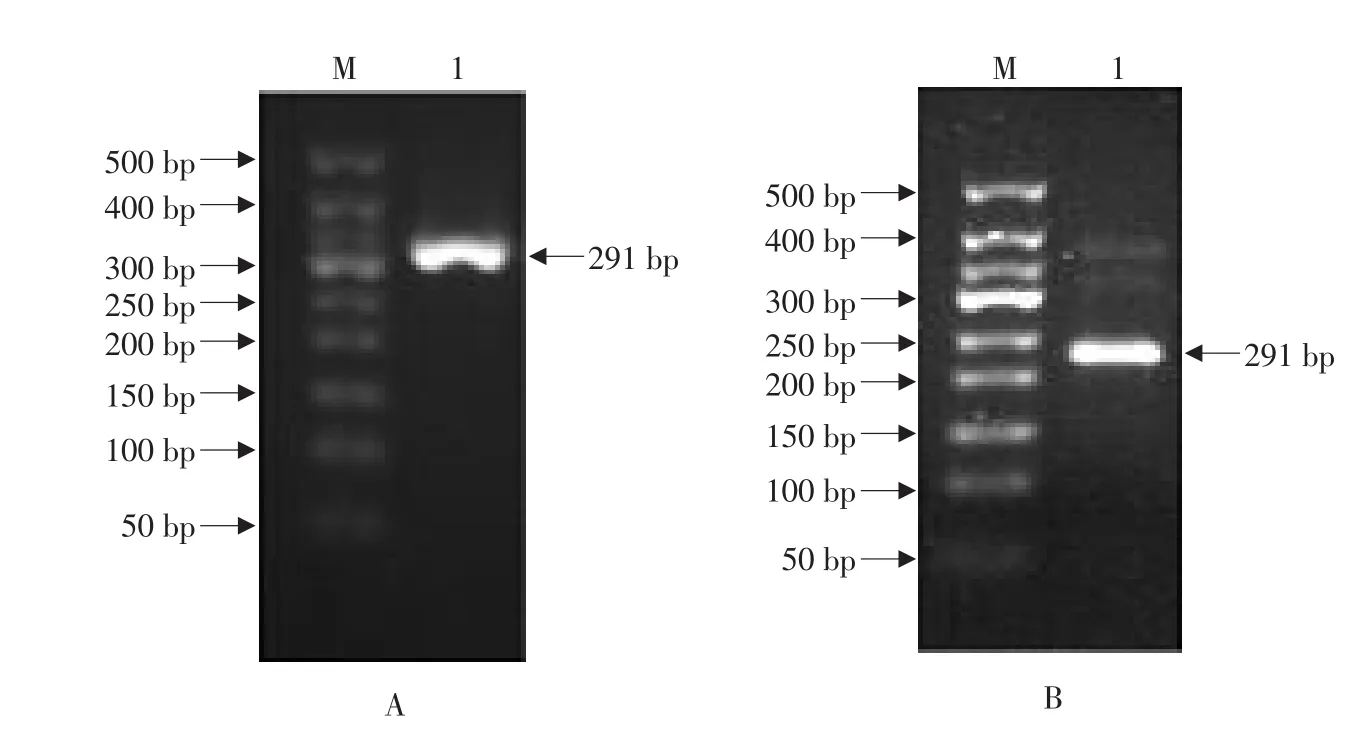
图1 斑点叉尾鮰hepcidin全长(A)和原前体肽(B)cDNA的PCR扩增Fig.1 PCR amplification of cDNAs encoding the full-length hepcidin(A)and prepro-peptide(B)of channel catfish

图2 斑点叉尾鮰与其他生物之间hepcidin原前体肽的氨基酸序列比对Fig.2 Comparison of the amino acid sequences for hepcidin prepro-peptides among channel catfish and other species
2.3 “pET32a-pIH”重组表达质粒的构建及鉴定
将含EcoR I和HindIII酶切位点的“pIH”片段与事先用这两种酶处理过的pET32a(+)连接,得到重组表达质粒“pET32a-pIH”(见图3B)。
在该重组表达质粒中,pET32a(+)所带的高溶解性的硫氧还蛋白“trxA”的编码基因与目的片段融合,形成的融合基因有利于高溶解性的融合蛋白的表达。通过菌落PCR鉴定,发现在约824 bp处有清晰条带(见图4A),与理论相符,初步确定为阳性菌落;进一步对阳性菌落中的质粒进行提纯,通过EcoR I和HindIII对质粒进行双酶切处理,经1%琼脂糖凝胶电泳后,发现存在大、小分子质量的两条谱带,其中一条约219 bp的小分子质量谱带属于目的片段(见图4B)。最终通过对阳性克隆的测序,证明目的片段“pIH”已正确连接到pET32a(+)表达载体上,并且核苷酸序列未发生任何碱基突变。

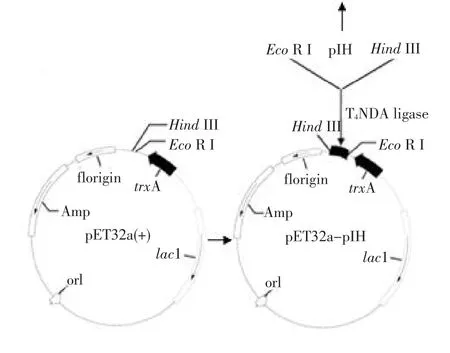
图3 克隆的原前体肽序列(A)和重组表达质粒“pET32a-pIH”构建图(B)Fig.3 Cloned prepro-peptide sequence(A)and construction of recombinant expression plasmid“pET32a-pIH”(B)
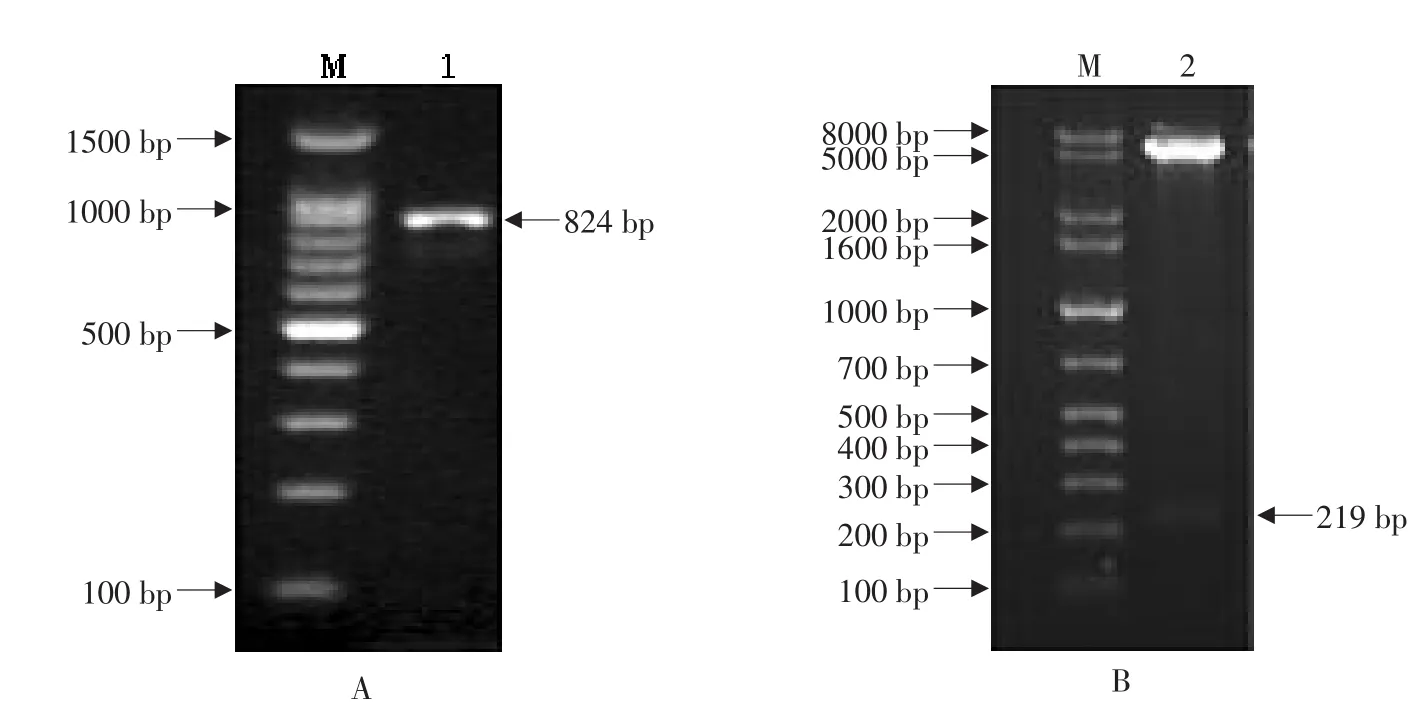
图4 重组表达表质粒的PCR插入检验(A)和双酶切鉴定(B)Fig.4 Identification of recombinant expression plasmid by colony PCR(A)and restriction enzyme digestion(B)
2.4 重组hepcidin原前体肽在E.coli BL21(DE3)中的融合表达及表达产物的纯化
含重组表达质粒“pET32a-pIH”的工程菌E.coliBL21(DE3)在含氨苄青霉素的LB培养液中生长至OD600为0.6~0.8,经1 mmol·L-1IPTG诱导,在37 ℃培养12 h后,成功表达了融合蛋白“trxA-pIH”(见图5,泳道5)。细胞经超声破碎离心后,对上清和沉淀(包涵体)进行Tricine-SDS-PAGE分析,发现目的蛋白存在于上清(见图5,泳道6)和沉淀(见图5,泳道7)中,但前者较后者显示更深的谱带;经Quantity One software,Version 4.4.0(Bio-Rad,Laboratories,Inc.,USA)对凝胶进行分析,发现融合蛋白的70%以上是可溶的,并且表达的融合蛋白约占细胞总蛋白的22.5%。而在阴性对照组中无任何表达(见图5,泳道1-4)。通过IMAC进一步对上清中的含6xHis标签的融合蛋白进行纯化,经Tricine-SDS-PAGE分析,可见分子质量约为33 ku的融合蛋白“trxA-pIH”的条带,与预期的分子质量相符(见图6)。
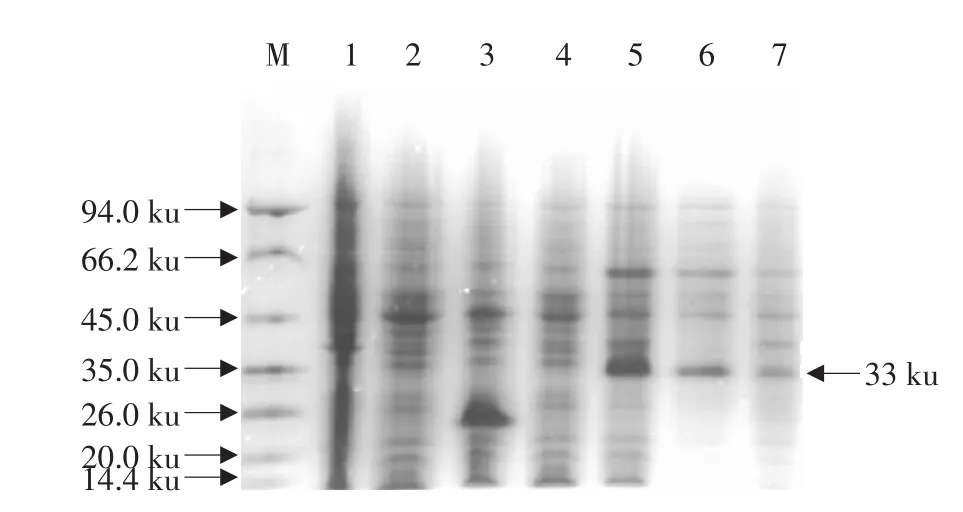
图5 在E.coli BL21(DE3)中表达的融合蛋白的Tricine-SDS-PAGE分析Fig.5 Tricine-SDS-PAGE analysis for fusion proteins expressed in E.coli BL21(DE3)
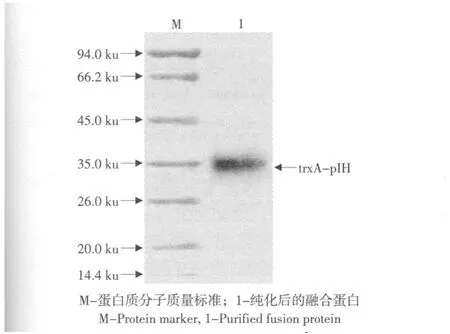
图6 纯化的融合蛋白的Tricine-SDS-PAGE分析Fig.6 Tricine-SDS-PAGE analysis for the purified fusion protein
3 讨论与结论
通常在肝脏中合成的hepcidin抗菌肽的氨基端含有一段信号肽,在蛋白质翻译后的修饰中该肽段被蛋白酶切除,剩下包括前体肽和成熟肽的原前体肽转运进入血液中,再由前体肽转化酶酶切掉前体肽后,形成具有生物活性的小分子成熟肽[18]。因成熟肽仅由20~25个氨基酸残基组成,分子质量较小,可能不利于其在大肠杆菌中的表达,因此,本文以斑点叉尾鮰hepcidin原前体肽为研究对象,参考Bao等报道的斑点叉尾鮰hepcidin全长cDNA序列[11],通过RT-PCR从其肝脏克隆到编码hepcidin原前体肽的cDNA序列。然而,与参考序列相比,该cDNA序列显示了2个不同的核苷酸残基,进而导致了原有的缬氨酸和精氨酸由丙氨酸和亮氨酸取代。据报道,Hepcidin基因在一些鱼类中具有多个拷贝,例如,黑鲷(Acanthopagrus schlegelii)含七种hepcidin序列[19];Huang等从莫桑比克罗非鱼(Oreochromis mossambicus)中分离到三种编码hepcidin 的 cDNA 序列(TH1-5、TH2-2、TH2-3)[20]。因此,本文获得的hepcidin原前体肽也可能属于斑点叉尾鮰hepcidin抗菌肽的另外一种同工型。虽然来自不同生物的hepcidin原前体肽之间显示了在氨基酸序列上的差异,但在它们的成熟肽区域均存在8个高度保守的半胱氨酸残基,以致在空间构象上形成的4对二硫键决定了hepcidin的抗菌活性[21-22]。
本文选择pET32a(+)作为表达质粒,它所携带的高溶解性的硫氧还蛋白“trxA”的编码基因与目的片段“pIH”形成的融合基因有利于目的蛋白以高溶解性的融合蛋白的形式表达。事实证明,本文在E.coliBL21(DE3)中表达的“trxA-pIH”融合蛋白的70%以上是可溶的。通常,由于大肠杆菌细胞基质的还原环境,使得在大肠杆菌中直接表达的大部分含半胱氨酸的阳离子抗菌肽是没有活性的,初步的抑菌试验也证实了这一点。进一步的研究将关注于表达产物的复性,以使目的蛋白形成正确折叠的三维空间结构而具生物学活性。尝试对于hepcidin成熟肽区域的重组DNA表达,也是进一步研究的目标。
[1] Boman H G,Nilsson I,Rasmuson B.Inducible antibacterial defense system inDrosophila[J].Nature,1972,237:232-235.
[2] 朱勇,徐建雄.抗菌肽饲料添加剂的研究进展[J].饲料工业,2006,27(3):14-16.
[3] 张虹,陶妍.斑点叉尾鮰肝脏表达的抗菌肽-2(LEAP-2)在E.coli中的融合表达[J].上海交通大学学报,2010,28(1):70-75.
[4] 黄平,章怀云.鱼类抗菌肽研究进展[J].中南林业科技大学学报,2009,29(2):170-174.
[5] Krausea A,Neitz S,Magerth J,et al.LEAP-1,a novelhighly disulfide-bonded human peptide,exhibits antmi icrobial activity[J].FEBS Letters,2000,480:147-150.
[6] Park C H,Valore E V,Waring A J,et al.Hepcidin,a urinary antimicrobial peptide synthesized in the liver[J].Biological Chemistry,2001,276(11):7806-10.
[7] 党晓伟,李梦云,常娟,等.Hepcidin的研究进展[J].安徽农业科学,2010,38(7):3351-3353.
[8] Douglas S E,Gallant J W,Liebscher R S,et al.Identification and expression analysis of hepcidin-like antimicrobial peptides in bony fish[J].Developmental and Comparative Immunology,2003,27(6-7):589-601.
[9] Huang P H,Chen J Y,Kuo C M.Three different hepcidins from tilapia,Oreochromis mossambicus:Analysis of their expressions and biological functions[J].Molecular Immunology,2007,44(8):1922-1934.
[10] Huang W S,Li S J,Cai L,et al.Cloning sequence analysis and gene organization of antimicrobial peptide hepcidin gene from Nile Tilapia(Oreochromis niloticus)[J].Journal of Xiamen University(Natural Science),2007,46(3):390-395.
[11] Bao B L,Peatman E,Li P,et al.Catfish hepcidin gene is expressed in a wide range of tissues and exhibits tissue-specific upregulation afterbacterialinfection[J].Developmentaland Comparative Immunology,2005,29:939-950.
[12] Schagger H,Von Jagow G.Tricine-sodium dodecyl sulfatepolyacrylamide gel electrophoresis for the separation of protein in the range from 1 to 100 ku[J].Analytical Biochemistry,1987,166:368-379.
[13] Gibert Y,Lattanzi V J,Zhen A W.BMP signaling modulates hepcidin expression in zebrafish embryos independent of hemojuvelin[J].Public Library of Science One,2011,6(1):372-379.
[14] Shike H,Shimizu C,Lauth X,et al.Organization and expression analysis of the zebrafish hepcidin gene,an antimicrobial peptide gene conserved among vertebrates[J]. Developmental and Comparative Immunology,2004,28(7-8):747-754.
[15] Harrison-Findik D D,Schafer D,Klein E,et al.Alcohol metabolism-mediated oxidative stress down-regulates hepcidin transcription and leads to increased duodenal iron transporter expression[J].Biological Chemistry,2006,281(32):22974-22982.
[16] Gordeuk V R,Miasnikova G Y,Sergueeva A I.Chuvash polycythemia VHLR200W mutation is associated with downregulation of hepcidin expression[J].Blood,2011,118(19):5278-5282.
[17] Mural R J,Adams M D,Myers E W.A comparison of whole-genome shotgun-derived mouse chromosome 16 and the human genom[J].Science,2002,296(5573):1661-1671.
[18]Shike H,Lauth X,Westerman M E,et al.Bass hepcidin is a novel antimicrobial peptide induced by bacterial challenge[J].European Journal of Biochemistry,2002,269:2232.
[19] Yang M,Wang K J,Chen J H,et al.Genomic organization and tissue-specific expression analysis of hepcidin-like genes from black porgy(Acanthopagrus schlegeliiB.)[J].Fish and Shellfish Immunology,2007,23:1060-1071.
[20] Huang P H,Chen J Y,Kuo C M.Three different hepcidins from tilapia,Oreochromis mossambicus:Analysis of their expressions and biological functions[J].Molecular Immunology,2007,44:1922-1934.
[21] 李华,安利国.鲤鱼抗菌肽hepcidin的基因克隆、表达及其功能的研究[D].济南:山东师范大学,2010.
[22] Papagianni M.Ribosomally synthesized peptides with antimicrobial properties:Biosynthesis,structure,function and applications[J].Biotechnology Advances,2003,21(6):465-499.
