BALB/C小鼠不同组织RNA提取方法的比较
2012-09-20曲娟娟
于 敏,曲娟娟,王 征,朱 超
(1.东北农业大学资源与环境学院,哈尔滨 150030;2.黑龙江中医药大学药物安全性评价中心,哈尔滨 150040)
BALB/C小鼠特别是在单克隆抗体制备及免疫学试验中应用广泛,高纯度及完整的总RNA提取及纯化对后续的分子生物学试验重要。小鼠组织总RNA提取的方法一般采用传统的高浓度强变性剂异硫氰酸胍或蛋白质变性剂十二烷基硫酸钠以及Invitrogen公司TRIpure商品化试剂盒[1]。传统提取方法将裂解细胞的核蛋白体解离,并通过酸性苯酚使RNA进入水相,在离心后使RNA与仍留在有机相中的蛋白质和DNA分离,此类方法成本较低但步骤繁琐[2]。商品化总RNA提取试剂盒具有方法简单、RNA质量可靠的优点,但RNA产品中常伴有大分子质量染色体DNA污染,特别是以复杂的动物组织为原材料时,这一问题显得特别突出[3]。商品化的核酸提取试剂盒在该实验领域中有广泛应用,一些比较知名的国外公司,其生产的试剂盒有较高的回收效率,与传统的核酸提取方法相比,操作更简单,更快速,并且大大降低样品污染的可能性。本试验主要以某公司的TRIzol试剂、氯化锂和某公司商品化的试剂盒分别提取了BALB/C小鼠心脏、肝脏和肾脏组织的基因组RNA,通过紫外分光光度计测定光吸收值、琼脂糖凝胶电泳及RT-PCR方法,比较不同方法和组织中提取的RNA质量,为后续的试验工作奠定基础。
1 材料与方法
1.1 动物
清洁级,体重20~25 g的雄性健康BALB/C小鼠(购自黑龙江中医药大学药物安全性评价中心)。
1.2 主要试剂及仪器
RNA提取试剂盒、TRIzol试剂、氯化锂、氯仿(分析纯)乙醇等;离心机、1.5 mL无酶离心管、微量移液器及吸头等。
1.3 组织前处理
BALB/C小鼠饥饿24 h后颈椎脱臼法处死,取出心脏、肝脏和肾脏,放入预冷的0.8%生理盐水中漂洗掉多余的血液。分别剪取各组织约0.1 g的组织块放入预冷的研钵中,加液氮研磨。
1.4 TRIzol提取
按100 mg·mL-1的比例加入T试剂,冰上裂解15 min。样品移入1.5 mL离心管中,4℃12 000 g离心10 min。取离心后的上清,室温静置5 min,按每mL TRIzol加200 μL氯仿的比例加入氯仿溶液,颠倒混匀15 s,室温静置3 min。4℃12 000 g离心15 min。取样品离心后的上清,重复此步。将离心后的上清移入1.5 mL离心管中,加入2.5倍体积的预冷无水乙醇,颠倒混匀,冰浴15 min,4℃12 000 g离心15 min。弃去上清,用75%乙醇漂洗沉淀,并涡旋数秒,4℃7 500 g离心10 min。弃去上清,室温干燥沉淀,加入适量DEPC水溶解,-70℃保存。
1.5 RNA kit提取
按60 mg·mL-1的比例加入裂解液15 000 g室温离心5 min,转移上清至离心柱中,13 000 g室温离心3 min。将离心收集的流出液转移到新的EP管中。加入5倍体积的1×buffer ERL(样品体积不能超过1 mL),涡旋混匀,冰浴15 min,冰浴时涡旋数次。4℃450 g离心10 min,弃去上清,2倍样品体积的buffer ERL重悬沉淀,4℃450 g离心10 min。完全弃去上清,100 μL DEPC水重悬沉淀,加入350 μL(样品小于500 μL时加入350 μL,0.5~1 mL时加入600 μL)buffer MRC(1 mL MRC加入 20 μL二巯基乙醇,室温保存2周),再加入等体积70%乙醇,涡旋数秒。取一RNA结合柱,放入2 mL收集管中,将样品全部转移到柱内(可以分多次),4 ℃ 10 000 g离心30 s。加入700 μL WBI,4 ℃ 10 000 g离心30 s,换新收集管,加入500 μL WBII,4℃10 000 g离心30 s,重复此步骤。4℃13 000 g离心2 min(空离),加入适量DEPC水,10 000 g离心1 min。弃去上清,室温干燥沉淀,加入适量DEPC水溶解,-70℃保存。
1.5 氯化锂法
按100 mg·mL-1的比例加入氯化锂-尿素溶液,匀桨器高速匀桨2 min并转移至Eppendof管中,匀桨液0~4℃放置4h后,12 000 g离心30 min取沉淀,加入原匀桨液0.5体积的氯化锂-尿素溶液复溶,重复上述步骤;加入等体积酚/氯仿/异戊醇在室温放置15~30 min并不时摇动混匀,4 000 g离心5 min;取上层水相,加1/10倍体积的3 mmol·L-1乙酸钠(pH 5.2)及2倍体积的乙醇,-20℃放置1 h,5 000 g离心。弃去上清,室温干燥沉淀,加入适量DEPC水溶解,-70℃保存。
1.6 RNA质量检测
将2 μL RNA样品,用Nanodrop定量分析仪测定RNA的浓度和纯度。计算A260/280、A260/230的比值。取各组织总RNA样品0.5 μg,1%的琼脂糖凝胶电泳检测。
1.7 小鼠组织总RNA的RT-PCR检测
RT-PCR方法检测小鼠组织溶酶体标志蛋白的mRNA表达,用以检测所提取的RNA质量。将提取的RNA模板8 μL,加入Oligo(dT)15(20 μmol·μL-1)1 μL以及dNTP混合物(各自浓度为2.5 m mol·L-1)4 μL,在65℃温浴5 min,立即放入冰盒,然后依次加入5×第一链缓冲液 4 μL,0.1 mol·L-1DTT 2 μL,40 U·μL-1RNA酶抑制剂0.5 μL,SuperscriptTMII RNase H-反转录酶(200 U·μL-1)0.5 μL,DEPC水调终体积为20 μL,混匀,42℃温浴1 h。此反转录产物在70℃灭活15 min后,-20℃保存备用,也可立即进行PCR扩增。PCR引物序列为:sense 5'CTGGAAGTTTATTCATCTATCA 3',antisense 5'GA ATGTAACCTTGATTG TTATC 3'。PCR反应条件:95℃ 5 min,94℃ 40 s,56℃30 s,72℃ 30 s,30个循环最后72℃延伸10 min。PCR反应程序为反应产物长度为104 bp,PCR产物用1.5%的琼脂糖凝胶电泳检测。
2 结果与分析
2.1 小鼠组织总RNA的纯度检测
Nanodrop定量分析仪分析结果显示(见表1),提取的小鼠心脏总RNA A260/A280比值介于1.83~1.94之间A260/A230比值介于1.67~2.13之间;提取的小鼠肝脏组织总RNA A260/A280比值介于1.89~1.95之间,A260/A230比值介于2.00~2.14之间;提取的小鼠肾脏组织总RNA A260/A280比值介于1.83~1.97之间,A260/A280比值介于1.91~2.03之间;与其他两种组织相比,肾脏组织RNA提取效果最好。用氯化锂提取的总RNA A260/A280比值介于1.83~1.89,A260/A230比值介于1.67~2.14;用TRIzol试剂提取的总RNA A260/A280比值介于 1.94~1.97,A260/A230比值介于 1.93~2.12之间;用试剂盒提取的总RNAA260/A280比值介于1.84~1.90,A260/A230比值介于1.94~2.13之间;与其他两种方法相比,用TRIzol试剂提取得到的RNA纯度较高。
2.2 琼脂糖凝胶电泳检测结果

表1 不同方法提取不同组织RNA的浓度、纯度及样品用量Table1 Concentration,purity and amount of different tissue RNA by different extraction method
肝脏、肾脏和心脏样品提取的总RNA电泳结果见图1,三者比较电泳结果无明显差别。在小鼠肝组织总RNA提取过程中,两种方法提取的总RNA产品均为白色或透明状,说明其中有多酚类物质基本被全部除去。提取的小鼠不同组织总RNA均可见3条清晰的条带,分别为5S、18S和28S rRNA,且28S rRNA的亮度为18S rRNA的两倍,证明所提取的RNA未降解,可用于后续试验。
2.3 总RNA的RT-PCR检测
以上述提取的小鼠肝脏、肾脏和心脏总RNA为样品,RT-PCR方法扩增小鼠主要组织相容性复合体蛋白H-2K编码基因。扩增结果如图2所示,3个样品均可扩增出104 bp的特异性条带,扩增效率较好。说明利用本研究各方法提取的小鼠肝脏、肾脏和心脏总RNA质量较好,可满足RT-PCR试验的要求。
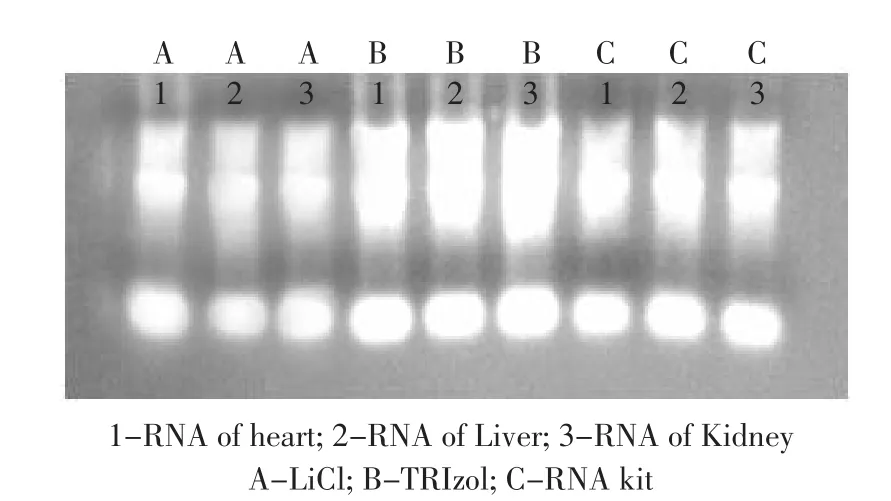
图1 小鼠不同方法提取的不同组织RNA结果Fig.1 Results of RNA from different tissue of BALB/C mouse by different extration method
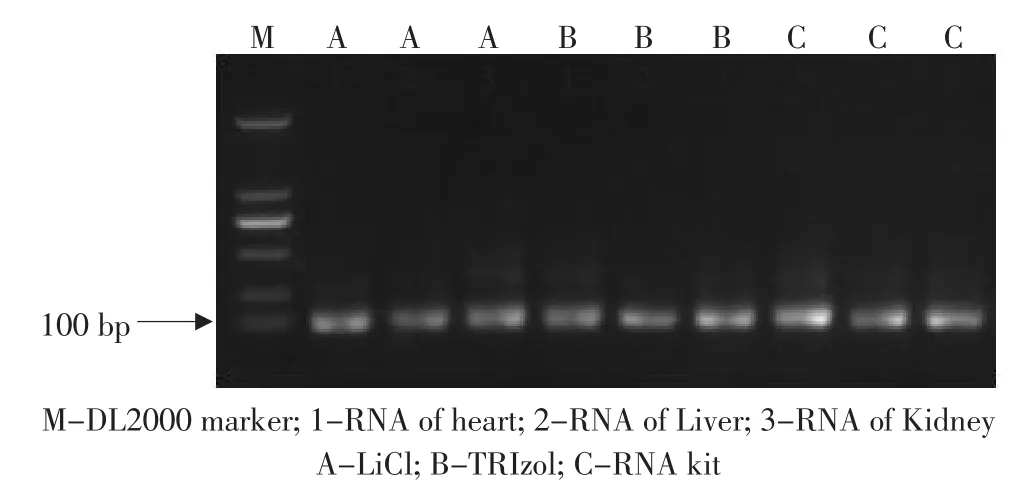
图2 小鼠不同方法提取的不同组织RNA RT-PCR扩增结果Fig.2 Results of RT-PCR with RNA from different tissue of BALB/C mouse by different extration method
3 讨论与结论
RNA提取过程中,RNase是主要的降解源,因此所有用到的物质都要进行去RNase处理,主要方法用DEPC处理,试验整个过程须戴一次性手套操作。任广睦等研究发现肝脏、脾脏、肾脏等因富含内源性Rnase,即使应用电动匀浆仪匀浆也不能避免RNA的降解,最好的方法是在液氮条件下将组织研碎,然后再低温匀浆,且匀浆时应加大裂解液使用量[4]。张宏山等发现提取小鼠肝、肾组织时,因其组织块较大,需要研磨,而RNA容易降解,因此需在低温下进行[5]。本试验选用液氮研磨的方法,而一般的试剂盒都是在室温下使用的,考虑到低温使用可能会影响效果,决定使用TRIzol试剂。TRIzol试剂的特点是在低温下有良好的裂解效果,能够充分裂解组织,得到较高浓度的RNA。但是TRIzol试剂有一定毒性,因此在试验过程中因采取保护措施。结果表明在本次试验涉及到的几种组织中,小鼠肝脏RNA含量最高。
与DNA相比RNA更容易降解,因此在RNA提取过程中要特别注意温度及时间控制,RNA含量较低的样品提取时,适量加入一些RNA酶抑制剂[6]。同时要确保环境的稳定,操作人员应使用口罩及一次性手套操作,以确保将环境中RNase酶的影响降到最低,从而保证RNA提取的质量[7]。试验应用不同的方法,成功提取BALB/C小鼠不同组织RNA,经紫外分光光度计检测用TRIzol试剂在小鼠肾脏组织中获得的核酸片段均具有更高的纯度及浓度,而1%琼脂糖凝胶电泳检测发现三种来源的RNA均具有较好的完整性。RT-PCR方法扩增小鼠主要组织相容性复合体蛋白H-2K编码基因,3个样品均可扩增出104 bp特异性条带。验证各个方法可行性,为相关研究提供参考。
[1]郭俊良,胡靖扬,高顺玉.昆明小鼠不同组织RNA提取方法的比较[J].楚雄师范学院学报,2011,26(3):84-88.
[2]郑晓飞.RNA实验技术手册[M].北京:科学出版社,2004:24-42.
[3]王晋,王建民,苟元彬,等.改进Tripure法提取鉴定小鼠组织总RNA[J].中国临床康复,2006,10(25):156-157.
[4]任广睦,潘一民,刘季,等.死亡大鼠组织中总RNA提取的质量控制及方法评价[J].中国法医学杂志,2009,24(5):318-320.
[5]张宏山,许明,张阳,等.小鼠心肌组织3种总RNA提取方法比较[J].临床心血管杂志,2010,26(2):149-150.
[6]易尚辉,吕媛,陈文丽,等.一步法和离心柱法提取小鼠肝组织RNA的比较研究[J].湖南师范大学:自然科学学报,2007,30(4):119-121.
[7]曹廷兵,叶治家,巩燕,等.一种快速鉴定RNA质量的方法[J].第三军医大学学报,2002,24(8):992-993.
