锂电池电解质草酸二氟硼酸锂水解过程及其对理化性能的影响
2012-08-01周宏明刘芙蓉李荐李艳芬朱玉华方珍奇
周宏明 ,刘芙蓉,李荐 ,李艳芬,朱玉华,方珍奇
(1.中南大学 材料科学与工程学院,湖南 长沙,410083;2.湖南正源储能材料与器件研究所,湖南 长沙,410083)
草酸二氟硼酸锂(LiODFB)是一种近年来被广泛研究的锂电池电解质盐,与现有商用的锂电池电解质六氟磷酸锂(LiPF6)相比,LiODFB能够在石墨负极表面形成更加稳定的SEI膜来提高电池的循环性能[1-2],具有优异的高低温性能,更宽的适用温度范围[3-4],具有大电流和大倍率充放电能力,合成工艺相对简单[5-6],一直备受研究人员的关注。已有的研究主要集中在LiODFB电解液的电化学性能[1-2,5-6]以及LiODFB与各种电极的匹配性[7-9]。Zhang等[5,10]研究了LiODFB基电解液的优异的电化学性能和高低温温性能;Gao等[6,11]分析了LiODFB的红外图谱,测定了核磁共振谱,确定了13C,19F和11B的化学位移;陈凤凤[12]通过XRD,FTIR,NMR和TG-DSC等表征了LiODFB,并且提供了LiODFB的XRD曲线;Sandra等[13]通过核磁测定了ODFB-在水中B和F的变化。迄今为止,关于LiODFB对水分的敏感度以及在水分中暴露后对LiODFB基电解液做成的电池性能的影响、与LiPF6的水分敏感性的对比等均尚未见报道。在此,本文作者以草酸锂和三氟化硼乙醚为原料、硫酸二甲酯(DMC)为溶剂和催化剂合成LiODFB[2],通过重结晶的方法制备出高纯LiODFB,借助元素分析、红外(FTIR)、核磁共振等方法对LiODFB的化学成分、结构进行分析和表征,通过水分暴露实验和电池性能测试综合对比分析LiODFB和LiPF6的水分敏感性和理化性能,以便为LiODFB的定性、定量分析和制备提供参考依据。
1 实验
1.1 实验原料
实验原料为:LiPF6(电池级,日本森田化工有限公司生产),草酸锂(化学纯,国药集团化学试剂有限公司生产);三氟化硼乙醚(化学纯,国药集团化学试剂有限公司生产);碳酸二甲酯DMC、碳酸乙烯酯EC、碳酸甲乙酯EMC(电池级,张家港国泰华荣新材料有限公司生产)。
1.2 样品制备
LiODFB是以草酸锂和三氟化硼乙醚为原料在干燥反应容器中恒温反应24 h,然后,经DMC萃取、重结晶提纯后[14],获得样品用作下步分析。本实验有关样品LiODFB的所有操作都在MIKROUNA公司生产的手套箱(箱内水氧指标均小于20×10-6)中进行。
1.3 电解液配制及电池制作
以LiPF6和自制的LiODFB分别暴露0,2,3,4,48 h后再干燥得到的样品为溶质,以EC,DMC和EMC为溶剂,在手套箱中分别配制1 mol/L LiODFB样品/(EC+DMC+EMC)、LiPF6样品/(EC+DMC+EMC)的电解液(其中EC,DMC和EMC质量分数比w(EC):w(DEC):w(EMC)=1:1:1)。
磷酸铁锂(LiFePO4)、碳黑(SP)、羧甲基纤维素钠(CMC)按照一定比例在真空搅拌机中搅拌均匀,在涂布机上涂布,压片切片;负极料为石墨、SP和CMC,制片方法同上;将制备的极片与Celgard隔膜一起卷成柱式电池,真空干燥箱中脱气,手套箱中注液,然后,取出封口,得到电池。
1.4 水分暴露实验
自制LiODFB和LiPF6在25 ℃,湿度为50%的高低温箱中分别暴露0,2,3,4,48 h,每隔一段时间记录样品质量变化情况,在真空干燥箱(60 ℃,-0.01 MPa)中干燥,取部分干燥后的样品做XRD检测,剩下的配成电解液,做成电池,测试电池的电化学性能。
1.5 理化性质分析
采用北京瑞利分析仪器公司的原子吸收分光光度计分析样品中锂硼元素的含量,分析条件为:波长670.8 nm,灯电流3.0 mA,光谱通带0.2 nm,载气为V空气:V乙炔=1:4的混合气体;采用有机元素分析仪分析样品中碳和氧元素的含量,分析条件为:Chromosorb色谱柱,5A分子筛色谱柱,燃气为氧气,载气为氦气;采用氟离子选择电极法分析样品中氟元素的含量,用NaF配制氟化物标准溶液;
采用美国Nicolet 6700傅里叶红外光谱仪分析样品各原子之间的化学键,测试的范围为400~4 000 cm-1,分辨率为4 cm-1;
采用日本mgaku D/MAX-rC型衍射仪分析暴露样品的物相,测量条件为Cu靶,管压为40 kV,扫速为5 (°)/min,2θ=5°~80°。
采用BTS0105C8电池测试系统(宁波拜特电池有限公司)对电池进行性能测试,在0.5C倍率进行充放电,充电终止电压为3.6 V,放电终止电压为2.5 V。
2 结果与讨论
2.1 成分分析
自制的LiODFB样品的元素分析的理论值和实际值见表1。由表1可知:样品中锂、碳、氧、氟、硼元素的实际含量和LiODFB的理论含量基本吻合,通过计算得出样品的纯度为99.93%,可见纯度很高。
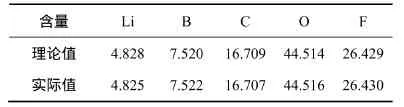
表1 LiODFB元素的含量(质量分数)Table1 Element content of LiODFB %
2.2 红外分析
采用红外光谱对样品的官能团进行分析,结果如图1所示。
在结构上可以认为LiODFB是由LiBOB和LiBF4各自的一半组成。F—B—F键取代了LiBOB结构中B元素一侧的草酸根,改变了键的取向,致使B元素两边的原子量和化学键发生变化,B元素两边的原子结构及体积改变,不再成对称状态,LiBOB中的键与键之间的吸引力与排斥力变化,导致LiODFB的键相对LiBOB的键出现振动峰的位移,O—C—C的不对称伸缩振动峰从在LiBOB红外图谱中的1 223.9 cm-1处移动到1 246.06 cm-1处,而C—O—O的伸缩振动峰在1 446.26 cm-1处[6,15],1 812.52 cm-1和1 769.71 cm-1处的峰反映了样品的C=O键面内摇摆和面外摇摆,1 372.14 cm-1处是B—O键的伸缩振动峰,而B—O键的对称伸缩振动吸收峰在947.22 cm-1处,变形振动峰位于596.06 cm-1处[6];1 124.31 cm-1处的峰是O—B—O键的伸缩振动峰;LiODFB中相当于用1个草酸根取代了LiBF4中的F—B—F键,参考LiBF4的图谱[16],LiODFB的F—B—F的对称伸缩振动吸收峰从1 034.59 cm-1处移动到了1 096.66 cm-1处,同时,在1 637.96 cm-1处新出现了B—F键的不对称伸缩振动吸收峰。
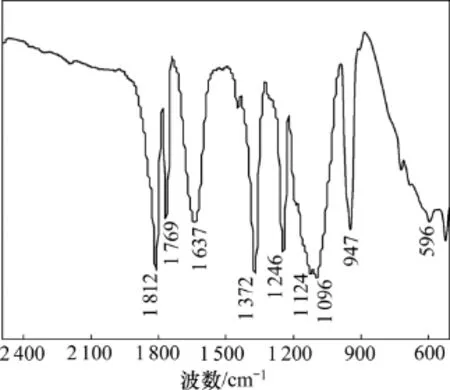
图1 LiODFB的红外图谱Fig.1 Infrared spectra of LiODFB
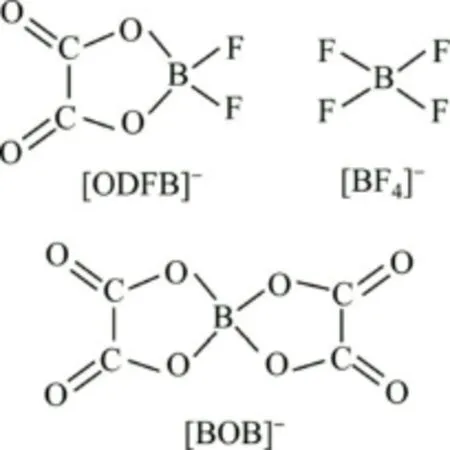
图2 分子结构图Fig.2 Molecular structures
2.3 水分敏感度分析
图3所示为LiODFB和LiPF6样品在25 ℃和50%湿度下暴露过程中的质量变化曲线。图4和图5所示分别为LiODFB和LiPF6在温度为25 ℃和50%湿度下暴露0,2,3,4和48 h的XRD图谱。

图3 样品暴露过程重量变化曲线Fig.3 Mass change curve of exposed samples
从图3可以看出:LiODFB样品暴露在空气中质量会迅速增加,而LiPF6样品质量会迅速减小,从1.5 h开始,质量迅速增加,5 h后是质量缓慢的增加的过程。LiODFB样品在0~5 h之间曲线有最大的斜率,样品质量有最大的增长率,在5~48 h质量变化相对缓慢,这是由于在暴露初期,LiODFB样品容易潮解,主要发生吸潮反应,吸附水的速率较快,在后期主要发生缓慢的水解反应,样品质量的增长速率降低,这与图4的XRD分析结果是一致的。LiPF6在暴露后质量直线下降,并伴随有白色烟雾HF产生。这主要是由于LiPF6暴露发生分解反应,反应式为LiPF6+H2O→LiF+HF+POF3[17];暴露1.5 h后,LiPF6的质量损失小于分解产物LiF吸潮的质量增加,此时分解产物迅速吸潮,曲线快速上升;在暴露3 h左右,已经没有白烟产生,主要发生分解产物的水解反应,质量的增加持续5 h后进入缓慢期。
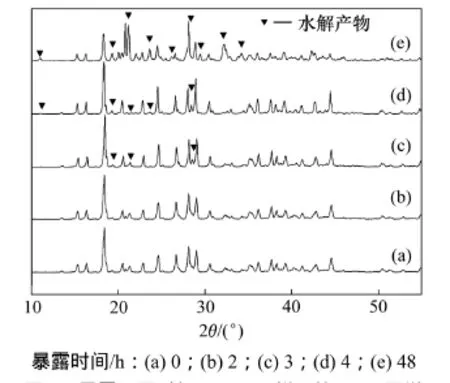
图4 暴露不同时间LiODFB样品的XRD图谱Fig.4 XRD patterns of LiODFB samples exposed at different time
从图4可以看出:LiODFB样品在25 ℃和50%湿度的空气氛围中暴露2 h的图谱与暴露0 h的图谱基本一致。这是由于LiODFB与LiBOB类似,是一种螯合物,其中Li+是五重配位结构,易与其他分子结合,暴露在潮湿的空气中会直接与空气中的H2O形成更加稳定的六重配位结构LiODFB·H2O,Li会与H2O形成无限的“—Li—H2O—”链,部分O会与H2O形成氢键[18],因此,LiODFB在空气中暴露2 h,快速吸收空气中的水分,质量快速增加,主要发生LiODFB吸潮反应,形成LiODFB·H2O。所以,X线图谱与未暴露的图谱基本无变化。
从图4还可看出:与暴露2 h的XRD图谱相比较,LiODFB样品暴露3 h后的XRD图谱中在23.6°,19.4°和28.6°出现了几个杂质峰;样品暴露4 h时的XRD图谱与暴露3 h的基本一致,只是杂质峰的衍射强度增大,此时LiODFB继续发生水解反应;随暴露时间进一步延长至48 h,杂质峰大大增多,而且其衍射强度很大。这主要是由于LiODFB随着暴露时间延长,生成的LiODFB·H2O会进一步会发生水解反应,生成HBO3,LiBF4,LiBOB,LiBF(OH)3,LiBF2(OH)2和LiBF3(OH)等物质[13];而且水解产生的LiBOB会进一步水解缓慢生成LiBO2和LiOOCCOOH[19],LiBF4会形成LiBF4·H2O或者LiBF4·3H2O[20],在水解过程中没有HF产生。由于水解产物比较复杂,杂质峰的物相组成需做进一步分析。
图5表明:LiPF6未暴露的峰与暴露的峰差异很大,在25.3°和51.8°的主峰随着暴露时间延长而逐渐消失,暴露2 h后在15.4°,26.8°,23°,3°和44.9°等处出现水解产物P2O5和Li3PO4的峰,这说明LiPF6在25 ℃和50%湿度下迅速发生分解反应,随后发生水解反应,而LiODFB则先发生吸潮,然后缓慢进行水解反应。
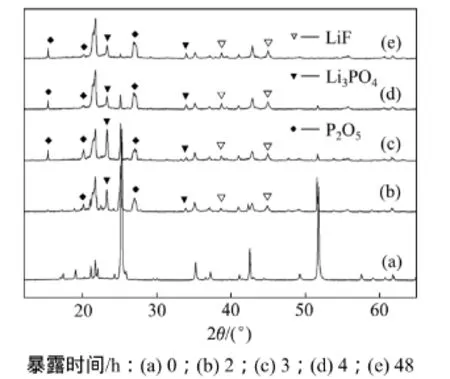
图5 暴露不同时间LiPF6样品的XRD图谱Fig.5 XRD patterns of LiPF6 samples exposed at different time
LiODFB和LiPF6在25 ℃和50%湿度的高低温箱中暴露不同时间后配成电解液,图6和图7所示分别为以此制成电池的放电容量和容量保持率。
由图6和图7可知:未暴露样品做成电池的性能明显优于暴露过的样品电池性能,同时,电池性能随着样品暴露时间延长而变差。LiODFB样品做电解液的电池未暴露的原样首次放电容量为239 mA·h,第12次放电容量为241 mA·h,其容量保持率基本在100%,LiPF6的放电容量分别为245 mA·h和220 mA·h,容量保持率在90%以上;暴露2 h样品的首次放电容量和第12次放电容量分别为214 mA·h和185 mA·h,容量保持率为86.4%;LiPF6的首次放电容量和第12次放电容量分别为149 mA·h和105 mA·h,容量保持率为70%。暴露2 h时LiPF6已经发生水解反应,反应产物在有机溶剂中不溶解,传递电荷的Li+减少导致容量降低,而LiODFB暴露2 h后形成了LiODFB.H2O,水分增加导致电池容量少量衰减。随暴露时间进一步增加,LiPF6进一步发生水解反应,自由Li+继续减少,电池容量和容量保持率均快速降低;此时,LiODFB样品也开始发生缓慢水解反应,导致自由移动的Li+减少,致使电池容量和容量保持率也缓慢降低。暴露48 h后的LiODFB和LiPF6样品已经完全反应,分别生成HBO3,LiBO2,LiOOCCOOH,LiF,P2O5和Li3PO4等物质,几乎没有可以自由移动传递电荷的Li+,电解液的导电性能极差。
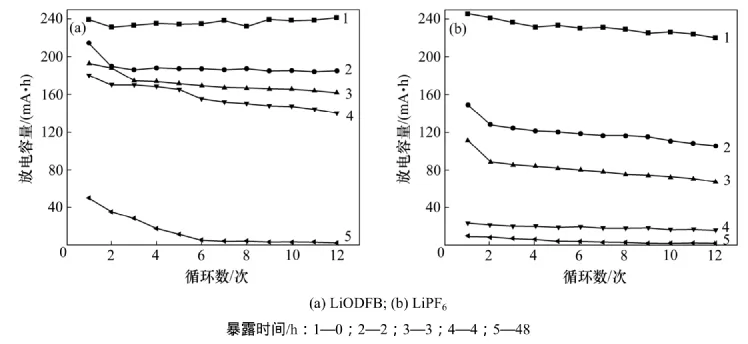
图6 LiODFB和LiPF6为电解液的电池的放电容量Fig.6 Discharge capacity of battery with LiODFB and LiPF6 electrolyte
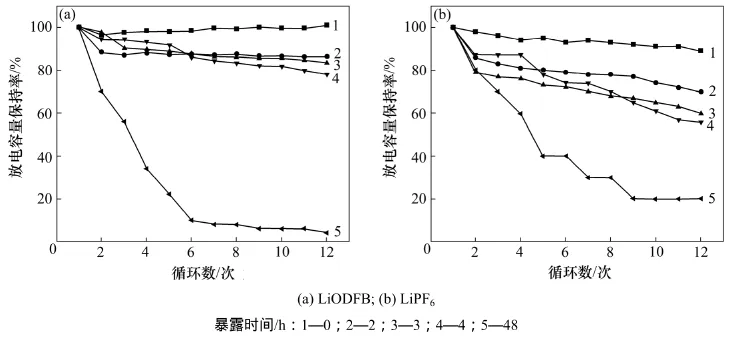
图7 LiODFB和LiPF6为电解液的电池的容量保持率Fig.7 Capacity retention of battery with LiODFB and LiPF6 electrolyte
以上分析表明,LiODFB在空气暴露不会像LiPF6一样迅速发生分解反应,而是先发生吸潮反应形成LiODFB.H2O,2 h后发生缓慢水解反应,其水分敏感性明显比LiPF6的低。
3 结论
(1)自制LiODFB样品的核磁共振分析的化学位移与相关文献结果一致;各化学键的红外吸收峰都存在,并且未见其他杂质峰。
(2)LiODFB在温度为25 ℃和湿度为50%下暴露2 h会吸潮,会形成LiODFB·H2O;随暴露时间延长,LiODFB·H2O会进一步发生水解反应变成LiBF4·H2O,LiBOB,LiBO2,LiBF(OH)3,HBO3和LiOOCCOOH等;LiPF6在温度为25 ℃、湿度为50%下暴露迅速反应,生成LiF,Li3PO4,P2O5等,同时有白色HF烟雾产生。
(3)电池的放电容量和容量保持率均随着暴露时间增加而变差。用暴露2,3,4 h后的LiODFB制成的电池容量保持率明显优于LiPF6电池,LiODFB具有良好的抗水分敏感性。
[1]Zhang S S, Xu K, Jow T R.Understanding formation of solid electrolyte interface film on LiMn2O4electrode[J].Journal of the Electrochemical Society, 2002, 149(12): 1521-1526.
[2]Zhang S S.Electrochemical study of the formation of a solid electrolyte interface on graphite in a LiBC2O4F2-based electrolyte[J].Journal of Power Sources, 2007, 163(26):713-718.
[3]付茂华, 黄可龙, 刘素琴, 等.二氟二草酸硼酸锂对LiFePO4/石墨电池高温性能的影响[J].物理化学学报, 2009, 25(10):1985-1990.FU Mao-hua, HUANG Ke-long, LIU Su-qin, et al.Effect of lithium difluoro(oxalato)borate on the high-temperature performance of LiFePO4/graphite batteries[J].Acta Phys Chim Sin, 2009, 25(10): 1985-1990.
[4]Li J, Xie K X, Lai Y Q, et al.Lithium oxalyldi fl uoroborate/carbonate electrolytes for LiFePO4/arti fi cial graphite lithium-ion cells[J].Journal of Power Source, 2010, 195(16): 5344-5350.
[5]Zhang S S.An unique lithium salt for the improved electrolyte of Li-ion battery[J].Electrochemistry Communications, 2006, 8(9):1423-1428.
[6]Gao H Q, Zhang Z A, Lai Y Q, et al.Structure characterization and electrochemical properties of new lithium salt LiODFB for electrolyte of lithium ion batteries[J].J Cent South Univ Technol,2008, 15(6): 830-834.
[7]Liu J, Chen Z H, Sara B, et al.Lithium di fl uoro(oxalato)borate as a functional additive for lithium-ion batteries[J].Electrochemistry Communications, 2007, 9(3): 475-479.
[8]付茂华, 刘素琴, 刘建生, 等.新型锂盐——二氟草酸硼酸锂[J].电池, 2009, 39(6): 316-318.FU Mao-hua, LIU Su-qing, LIU Jian-sheng, et al.A new lithium salt: Lithium oxalyldifluoroborate[J].Battery, 2009, 39(6):316-318.
[9]崔孝玲, 李世友, 骆建国.电解质锂盐草酸二氟硼酸锂的研究进展[J].电池, 2009, 3(4): 233-235.CUI Xiao-ling, LI Shi-you, LUO Jian-guo.Research progress in electrolyte lithium salt lithium oxalyldifluoroborate[J].Battery,2009, 3(4): 233-235.
[10]付茂华.磷酸铁锂电池用高低温电解液的研究[D].长沙: 中南大学化学化工学院, 2010: 16-42.Fu Mao-hua.Study of high and low temperature electrolyte for LiFePO4battery[D].Changsha: Central South University.School of Materials Science and Engineering, 2010: 16-42.
[11]Tobias H, Christian S, Dirk G, et al.Characterization and properties of new ionic liquids with the di fl uoromono[1,2-oxalato(2-)-O,O]borate anion[J].Journal of Fluorine Chemistry, 2007, 128(6): 612-618.
[12]陈凤凤.锂离子电池中新型电解质的合成与表征[D].南京:南京师范大学化学与环境科学学院, 2010: 21-35.Chen Feng-feng.Synthesis and performation of novel electrolyte for Lithium battery[D].Nanjing: Nanjing Normal University.School of Chemistry and Environmental Science, 2010: 21-35.
[13]Sandra Z, Dominik M, Marius A.Electrochemical characterization of electrolytes for lithium-ion batteries based on lithium di fl uoromono(oxalato)borate[J].Journal of Power Sources, 2011, 196: 1417-1424.
[14]邓凌峰, 陈洪.锂离子电池电解质LiBC2O4F2的合成与电化学性能[J].电源技术, 2010, 134(3): 237-240.DENG Ling-feng, CHEN Hong.Electrochemical properties and synthesis of LiBC2O4F2for lithium batteries[J].Journal of Power Sources, 2010, 134(3): 237-240.
[15]Yu B T, Qiu W H, Li F S, et al.The electrochemical characterization of lithium bis(oxalato)borate synthesized by a novel method[J].Electrochemical and Solid-State Letters, 2006,9(1): 1-4.
[16]刘建文, 李新海, 王志兴, 等.锂电池电解质盐LiBF4的制备新方法及表征[J].无机化学学报, 2009, 25(1): 31-36.LIU Jian-wen, LI Xin-hai, WANG Zhi-xing, et al.LiBF4electrolyte for lithium-ion battery: Preparation and characterization[J].Chinese Journal of Inorganic Chemistry,2009, 25(1): 31-36.
[17]Yang H, Guo V Z, Philip N.Thermal stability of LiPF6salt and Li-ion battery electrolytes containing LiPF6[J].Journal of Power Sources, 2006, 161(1): 573-579.
[18]Peter Y Z, Yang S F, Stanley W.Structure chemistry of new lithium bis(oxalto)-borate solvates[J].Acta Crystallographica,2004, 60(2): 716-724.
[19]刘伟.锂电池功能电解质LiBOB的性能研究[D].北京: 北京科技大学材料科学与工程学院, 2008: 46-67.LIU Wei.Properties research of LiBOB electrolytes for lithium-ion batteries[D].Beijing: University of Science and Technology Beijing.School of Materials Science and Engineering, 2008: 46-67.
[20]周园, 张昕岳, 年洪恩, 等.梯度式升温脱水制备LiBF4及其表征[J].化学学报, 2010, 68(14): 1399-1403.ZHOU Yuan, ZHANG Xi-yue, NIAN Hong-en, et al.Preparation and characterization of LiBF4by gradient heating dehydration[J].Acta Chemica Sinica, 2010, 68(14): 1399-1403.
