七甲基二硅氮烷对锰酸锂电池储存性能的影响
2012-08-01吴贤文李新海王志兴郭华军张云河肖围
吴贤文,李新海,王志兴,郭华军,张云河,肖围
(中南大学 冶金科学与工程学院,湖南 长沙,410083)
尖晶石锰酸锂因具有资源丰富、能量密度高、成本低、无污染等优点,被认为是最具有发展前景的锂离子动力电池正极材料[1-3]。目前,锰酸锂应用于锂离子动力电池的主要问题之一是储存后容量衰减严重,从而导致循环性能不佳[4-6]。导致锰酸锂容量衰减快的原因主要是锰溶解、电解液分解及Jahn-Teller效应[7-9]。为了改善锰酸锂动力电池的储存性能,主要是对锰酸锂正极材料进行体相掺杂和表面包覆,以稳定锰酸锂的尖晶石结构、减少锰的溶解等[10-12]。而从电解液入手,优化电解液配方,从而解决锰酸锂储存性能的报道还较少。Guo等[13]研究了亚硫酸丙酯(1,3-PS)、双草酸硼酸锂(LiBOB)及碳酸丙烯酯(PC)作为电解液添加剂对锰酸锂电池储存性能的影响;Yamane等[14]研究了六甲基二硅氮烷对锰酸锂高温储存性能的影响,并对其机理进行了简单的讨论;Li等[15]首次报道了七甲基二硅氮烷作为电解液稳定剂对锰酸锂循环性能和储存性能的影响,但未对不同温度、不同荷电态的锰酸锂储存性能进行研究。在此,本文作者首次在自制浓度为1 mol/L的LiPF6/EC+DMC+EMC(体积比1:1:1)电解液基础上,以七甲基二硅氮烷为电解液稳定剂对锰酸锂储存性能进行研究,并探讨了不同荷电态下锰酸锂电池在不同温度的储存性能。
1 实验
1.1 电解液的配制
以LiPF6(电池级)为电解质,碳酸乙烯酯(EC,电池级)、碳酸二甲酯(DMC,电池级)、碳酸甲乙酯(EMC,电池级)为溶剂,(以上试剂均由广州天赐有限公司提供),在充满高纯氩气的手套箱中配成浓度为1 mol/L LiPF6/EC+DMC+EMC(体积比1:1:1)的电解液,简称TC。向TC基电解液中加入质量分数为0.1%的七甲基二硅氮烷(简称HMDS),配成TCHMDS电解液。其中,电解液中水含量(质量分数,下同)低于0.002%,游离酸(HF)含量低于0.005%,水含量的测定采用卡尔费·休法,游离酸含量的测定采用酸碱滴定法。
1.2 电池的组装与测试
将LiMn2O4、导电剂乙炔黑和黏结剂PVDF按质量比8:1:1混合,用有机溶剂NMP搅拌混合成糊状,均匀涂覆在铝箔上。放置在真空干燥箱中,60 ℃真空干燥12 h,然后压制、切片,制成正极片。将正极片与负极锂片、自制电解液和隔膜(Celgard 2300 PP/PE/PP)在充满氩气的手套箱中组装成CR2032扣式电池。
电池静置12 h后,在蓝电测试仪上对锰酸锂电池进行储存前活化,即以0.1C,0.2C,0.5C,1C,2C恒流恒压充电、恒流放电并循环2~3次,充放电区间为3.3~4.35 V。然后再分别让电池在荷电0,50%和100%的状态下常温25 ℃或高温60 ℃(采用烘箱控制温度)储存。分别于1周或1月后取出电池,室温条件下以2 C倍率进行充放电循环性能测试。交流阻抗测试采用三电极体系在上海辰华CHI660A电化学工作站上完成,测量频率为0.01~100 000 Hz,正弦波振幅为5 mV。
充放电完毕后,将电池在真空手套箱中打开,取出正极片,并用碳酸二甲酯(DMC)清洗残留的锂盐,然后在真空干燥箱中60 ℃烘12 h,并用JSM-5600型扫描电子显微镜对LiMn2O4的表面形貌进行表征。
2 结果与讨论
2.1 不同荷电态锰酸锂电池不同温度储存前后的交流阻抗
图1所示为不同荷电态锰酸锂电池在常温(25 ℃)和高温(60 ℃)储存前后的交流阻抗图谱,表1所示为不同荷电态锰酸锂电池在不同温度下储存前后的交流阻抗拟合结果。由图1和表1可知:3种不同荷电态的锰酸锂电池无论在常温还是高温储存前后,其交流阻抗图谱均由1个半圆和1条直线组成。半圆在高频区与实轴的截距代表溶液阻抗(Rs),半圆的半径代表界面电荷转移阻抗(Rct),斜线代表锂离子在电极材料中所引起的Warburg阻抗。无论在常温还是高温下,3种不同荷电态的锰酸锂电池储存后的半圆半径均比储存前的要大得多,储存后界面电荷转移阻抗迅速增加;处于放电态的锰酸锂电池半圆半径均比处于半电态和满电态的半圆半径小得多,对应着放电态的锰酸锂电池界面电荷转移阻抗均比处于半电态和满电态的小得多。
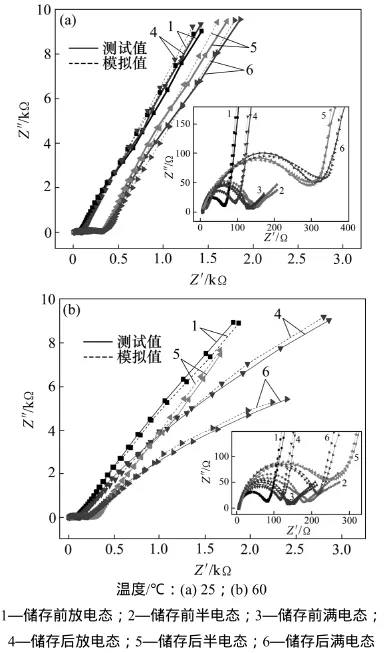
图1 不同荷电态下锰酸锂电池不同温度储存前后的交流阻抗Fig.1 AC impedance of LiMn2O4/Li cells with different charged state before and after storage at different temperatures
电荷转移阻抗Rct可以用电化学极化过电势η对法拉第电流i的导数来表示[16]。即:

在平衡电位附近(过电势小于10 mV)时,单电子反应的Butler-Volmer公式为:
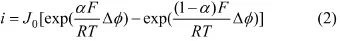
式中:J0为交换电流密度;R为阿伏伽德罗常数;T为热力学温度;F为法拉第常数。
式(2)可以线性化为

则式(3)η对i求导得
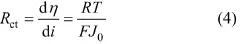

由式(5)可知:交换电流密度J0与电荷转移电阻Rct具有反比关系,Rct越小,J0越大,电化学反应活性越高。
不同荷电态锰酸锂电池在不同温度下储存前后根据界面电荷转移阻抗计算得到的交换电流密度结果见表2。由表2可知:所有锰酸锂电池储存后其交换电流密度都降低;无论在常温还是高温储存,处于放电态的所有锰酸锂电池储存前后交换电流密度值均高于处于半电态和满电态的相应值。即所有锰酸锂电池储存后化学反应活性比储存前要高,且处于放电态的所有锰酸锂电池储存前后电化学反应活性最高。
2.2 不同荷电态锰酸锂电池不同温度下储存后的首次充放电容量
图2所示为不同荷电态锰酸锂电池常温、高温储存后0.2C倍率下的首次充放电曲线。表3所示为不同荷电态的锰酸锂电池在常温和高温储存后的电化学参数。由图2可知,放电态锰酸锂电池无论在常温或高温储存后首次充放电效率、中值电压及首次放电容量均高于半电态和满电态相应值,而处于半电态和满电态的锰酸锂电池无论在常温或高温储存,中值电压和首次放电容量都相差不大。
2.3 不同荷电态锰酸锂电池在不同温度下储存后的循环性能
图3所示为放电态、半电态和满电态的锰酸锂电池分别在常温和高温储存1周的循环性能。由图3(a)可知:处于放电态锰酸锂电池常温储存1周后2C倍率下首次放电比容量为109.6 mA·h/g,远高于处于半电态和满电态的首次放电比容量,即98.7 mA·h/g和96.0 mA·h/g。200次循环后,处于放电态、半电态和满电态的锰酸锂电池容量保持率分别为89.96%,88.24%和85.00%。

表1 阻抗参数拟合结果Table1 Fitting value of AC impedance parameter

表2 不同荷电态锰酸锂电池在不同温度下储存前后的交换电流密度J0Table2 Exchange current density of LiMn2O4/Li cells with different charged states before and after storage at different temperatures mA/cm2

图2 不同荷电态锰酸锂电池不同温度储存后0.2C倍率的首次充放电曲线Fig.2 The first charge-discharge curves of LiMn2O4/Li cells at 0.2C rate with different charged states after storage at different temperatures
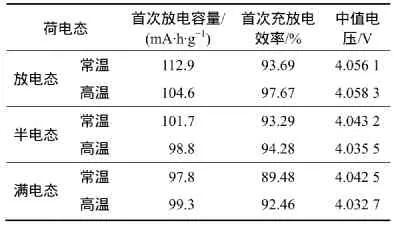
表3 不同荷电态锰酸锂电池在常温和高温储存后的电化学参数Table3 Electrochemical parameters of LiMn2O4/Li cells with different charged state after storage at room and elevated temperatures

图3 不同荷电态锰酸锂电池不同温度储存1周后的循环性能Fig.3 Cycling performance of LiMn2O4/Li cells with different charged states after storage for one week at different temperatures
由图3(b)所示可知:锰酸锂电池高温储存1周后,放电态、半电态和满电态的电池2C倍率下首次放电比容量分别为101.9,92.7和96.0 mA·h/g,200次循环后,容量保持率分别为90.58%,89.97%和84.69%。
由图3可知:随着荷电态的增加,容量保持率依次降低,循环性能逐渐变差。即放电态的锰酸锂电池经储存后首次放电比容量、中值电压和充放电效率最高,储存性能最好。储存后容量衰减较小,表现出较好的循环稳定性。而半电态和满电态的锰酸锂电池储存性能相差不大。随着荷电态的增加,锰价态升高,氧化性逐渐增强,与电解液的反应逐渐加剧。由交流阻抗实验结果表明:随着荷电态的增加,锰酸锂电池循环性能变差是由于电荷转移阻抗增加、活性物质表面被电解液侵蚀逐渐加重所引起的。
2.4 不同荷电态锰酸锂电池循环后的形貌变化
图4和图5所示分别为锰酸锂电池经常温和高温储存1周、再循环后正极材料表面形貌的变化。由图4和图5可知:(1)锰酸锂电极表面均存在白色絮状物质,这是锰酸锂电极表面被电解液侵蚀,形成了一层烷基锂所致[17]。且随着荷电态的增加,锰酸锂电极表面絮状物质有所增厚。(2)处于半电态和满电态的锰酸锂电极表面的导电剂出现一层层很深的裂纹,与黏结剂粘贴不是很紧密。(3)随着锰酸锂荷电态的增加,锰酸理材料表面的细小颗粒越来越少,锰酸锂颗粒的棱角越来越光滑。这些都表明,锰酸锂电极经储存再循环后,电极表面的腐蚀程度随着荷电态的增加而增加,这与锰酸锂电池循环性能下降的规律相一致。

图4 常温储存再循环后的锰酸锂电极表面形貌Fig.4 Morphologies of LiMn2O4 electrode surface after storage and then cycling at room temperature

图5 高温储存再循环后的锰酸锂电极表面形貌Fig.5 Morphologies of LiMn2O4 electrode surface after storage and then cycling at elevated temperature
2.5 放电态锰酸锂电池在不同电解液中的常温储存性能
图6所示为锰酸锂以TC和TCHMDS 2种不同电解液组装的电池放电态常温储存1月后0.2C倍率下的首次充放电曲线,表4所示为相应的电化学参数。由图6和表4可知:以TCHMDS为电解液的锰酸锂电池储存后首次放电比容量、首次充放电效率、充放电平台均明显高于以TC为电解液的锰酸锂电池。

图6 不同电解液的锰酸锂电池常温储存后0.2C倍率下的首次充放电曲线Fig.6 The first charge-discharge curves of LiMn2O4/Li cells with different electrolyte at 0.2C rate after storage at room temperature

表4 不同电解液的锰酸锂电池常温储存后的电化学参数Table4 Electrochemical parameter of LiMn2O4/Li cells with different electrolyte after storage at room temperature
图7所示为采用TC和TCHMDS 2种不同电解液的锰酸锂电池常温储存1月后2C倍率下的常温循环性能图。由图7可知,以TC和TCHMDS 2种不同的电解液的锰酸锂电池在前140个循环时,其放电比容量相差不大,即循环性能差距不少很明显。但随着充放电的继续进行,以TC为电解液的锰酸锂电池循环性能迅速恶化,放电比容量时大时小,电池的稳定性明显降低。而以TCHMDS为电解液的锰酸锂电池经200次循环后,容量保持率为96.73%,放电比容量由首次的101.1 mA·h/g到最后的97.8 mA·h/g,整个过程容量衰减仅3.3 mA·h/g。其原因是,随着HMDS的加入,一方面,增加了电解液体系的稳定性,另一方面,与原有电解液体系中的水分子反应,降低体系中的水含量,进一步阻止氟化氢的生成[15]。从而有利于抑制由于酸催化导致三价锰的溶解及电解液的分解,降低膜阻抗,提高锰酸锂电池储存后首次放电比容量、首次充放电效率及充放电平台,并最终降低锰酸锂电池的容量衰减,提高锰酸锂电池的储存性能。
图8所示为不同电解液的锰酸锂电池常温储存1月再循环后的电极表面形貌的变化。由图8可知:当电解液为TC时,电极表面细小颗粒基本消失,受电解液侵蚀程度比TCHMDS电解液中电极表面侵蚀更严重,这与图7所示的循环性能规律相一致。这就说明了TC电解液中加入HMDS稳定剂确实能提高锰酸锂电池的储存性能。

图7 不同电解液的锰酸锂电池常温储存后的循环性能Fig.7 Cycling performance of LiMn2O4/Li cells with different electrolyte after storage at room temperature
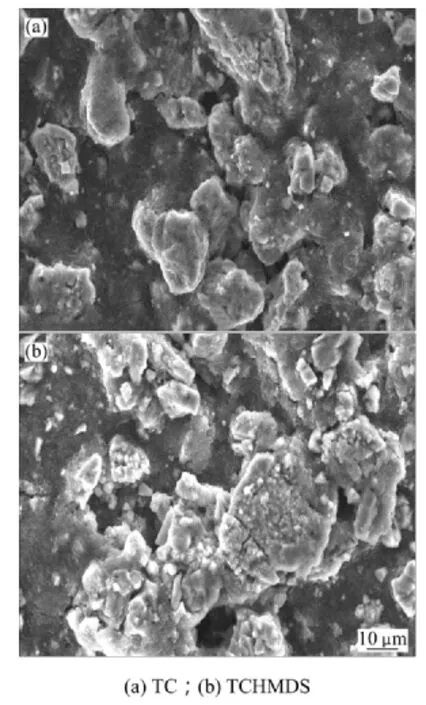
图8 不同电解液的锰酸锂电池常温储存再循环后的电极表面形貌Fig.8 Electrode surface morphology of LiMn2O4 with different electrolytes after storage and then cycling at room temperature
3 结论
(1)锰酸锂电池在常温和高温储存1周后,处于放电态的电池均比处于半电态和满电态的电池电化学性能更优异。交流阻抗和SEM测试结果表明,处于放电态的锰酸锂电池循环性能优异的原因是:放电态的锰酸锂电池电化学阻抗较低,循环后表面形貌更好,被电解液侵蚀程度相对较弱。
(2)放电态的锰酸锂电池常温储存1月,首次充放电效率为95.22%,2C倍率下循环200次后,容量保持率为96.74%,与电解液中未加七甲基二硅氮烷的锰酸锂电池相比,表现出较好的储存性能。其原因是七甲基二硅氮烷添加到原电解液中,与水反应形成盐类化合物,抑制锰溶解,从而提高电池的首次可逆容量和储存性能。
[1]Pasquier A D, Blyr A, Courjal, et al.Mechanism for limited 55 ℃ storage performance of Li1.05Mn1.95O4electrodes[J].Journal of the Electrochemical Society, 1999, 146 (2): 428-436.
[2]Fu M H, Huang K L, Liu S Q, et al.Lithium di fl uoro(oxalato)borate/ethylene carbonate + propylene carbonate +ethyl(methyl)carbonate electrolyte for LiMn2O4cathode[J].Journal of Power Sources, 2010, 195: 862-866.
[3]LIU Yun-jian, LI Xin-hai, GUO Hua-jun, et al.Electrochemical performance and capacity fading reason of LiMn2O4/graphite batteries stored at room temperature[J].Journal of Power Sources, 2009, 189: 721-725.
[4]Wohlfahrt-mehrens M, Vogler C, Garche J.Aging mechanisms of lithium cathode materials[J].Journal of Power Sources, 2004,127: 58-64.
[5]Antonini A, Bellitto C, Pasquali M, et al.Factors affecting the stabilization of Mn spinel capacity upon staring and cycling at high temperatures[J].Journal of the Electrochemical Society,1998, 145(8): 2726-2732.
[6]Aoshima T, Okahara K, Kiiyohara C, et al.Mechanisms of manganese spinels dissolution and capacity fade at high temperature[J].Journal of Power Sources, 2001, 97/98:377-380.
[7]Pistoia G, Antonini A, Rosati R, et al.Storage characteristics of cathodes for Li-ion batteries[J].Electrochim Acta, 1996, 41(17):2683-2689.
[8]Kumagai N, Komaba S, Kataoka Y, et al.Electrochemical behavior of graphite electrode for lithium ion batteries in Mn and Co additive electrolytes[J].Chemistry Letters, 2000, 29:1154-1155.
[9]Goodenough J B.Cathode materials: A personal perspective[J].Journal of Power Sources, 2007, 174(2): 996-1000.
[10]Lu W, Belharouak I, Park S H, et al, isothermal calorimetry investigation of Li1+xMn2-yAlzO4spinel[J].Electrochim Acta,2007, 52(19): 5837-5842.
[11]Alcantara R, Jaraba M, Lavela P, et al.New LiNiyCo1-2yMn1+yO4Spinel oxide solid solutions as 5 V electrode material for Li-ion batteries[J].Journal of the Electrochemical Society, 2004, 151(1):A53-58.
[12]Shu D, Gopu K, Kim K B.Surface modification of LiMn2O4thin films at elevated temperature[J].Solid State Ionics, 2003,160(3/4): 227-233.
[13]GUO Yong-xing, YIN Zhen-guo, TAO Zhi-yong, et al.An advanced electrolyte for improving surface characteristics of LiMn2O4electrode[J].Journal of Power Sources, 2008, 184:513-516.
[14]Yamane H, Inoue T, Fujita M, et al.A causal study of the capacity fading of Li1.01Mn1.99O4cathode at 80 ℃, and the suppressing substances of its fading[J].Journal of Power Sources,2001, 99: 60-65.
[15]LI Yong-kun, ZHANG Ruo-xin, LIU Jian-sheng, et al.Effect of heptamethyldisilazane as an additive on the stability performance of LiMn2O4cathode for lithium-ion battery[J].Journal of Power Sources, 2009, 189: 685-688.
[16]Lee K, Kim K B.Electrochemical and structure characterization of LiNi1-xCoxO2positive electrode during initial cycling[J].J Electrochem Soc, 2000, 147(5): 1709-1717.
[17]吴川.动力锂离子电池正极材料及相关机理研究[D].北京:北京理工大学化工与环境学院, 2002: 20-80.WU Chuan.Fundamental studies on cathode materials of lithium ion batteries for electric vehicles[D].Beijing, Beijing Institute of Technology.School of Chemical Engineering and Environment,2002: 20-80.
