接触抑制对转化生长因子β诱导基因22(TSC-22)在心脏成纤维细胞中表达的影响
2012-05-17魏英杰崔传珏刘晓艳白媛媛
史 强 魏英杰 崔传珏 李 君 刘晓艳 白媛媛
未发生恶性转化的细胞在培养过程中,其增殖受到细胞之间接触程度的调节和影响,当细胞密度达到一个临界点,细胞之间相互汇合接触,形成完全融合的单层细胞层时,细胞增殖能力丧失,生长停滞,这种现象被称为接触抑制。转化生长因子β诱导基因22(TGF-β stimulated clone-22,TSC-22)是近年来发现的一个在多种心脏病模型中表达明显升高的基因,可能在心脏重构过程中发挥重要作用。近年有文献报道,在发生了接触抑制的NIH3T3细胞系中TSC-22表达显著升高,提示其可能参与调控该细胞系接触抑制发生后的相关生物学过程[1]。而在心脏成纤维细胞中,接触抑制对TSC-22的表达有何影响,迄今尚未见诸报道。
材料与方法
1.细胞培养和分组:选用新生1~3天SPF级Sprague-Dawley大鼠,无菌条件下开胸取其心脏,用眼科剪剪成均匀的组织块,37℃水浴条件下用0.08%胰蛋白酶反复消化数次至组织块完全消化,收集消化液,离心弃上清,用含10%血清的DMEM培养液重悬细胞,200目滤网过滤后,接种于T25培养瓶中。采用差速贴壁法获得心脏成纤维细胞,分离得到的成纤维细胞进行传代培养,第2代细胞用于实验。细胞达到80%~90%融合后,无血清处理24h,胰酶消化混悬后,以下述不同的浓度接种并分组,进行后续实验:(1)以不同初始密度接种细胞,分为两组:①50%融合组:以 1.0×105/ml密度接种细胞于T25细胞培养瓶中,培养24h;②100%融合组:以2.0×105/ml密度接种细胞于T25细胞培养瓶中,培养24h。(2)均以2.0×105/ml的初始密度接种细胞于T25细胞培养瓶中,分为4组:①未融合组:接种后培养6h(至贴壁未融合状态);②融合组:接种后培养24h(至100%融合状态);③胰酶消化打破融合组:接种后培养至100%融合后,0.25%胰酶消化,离心混悬后重新贴壁,继续培养6h(此时细胞重新贴壁但未融合);④胰酶消化重新达融合组:接种后培养至100%融合后,0.25%胰酶消化,离心混悬后重新贴壁,继续培养24h,(此时细胞重新达到100%融合)。
2.RNA提取real-time PCR(RT-PCR)检测:按照Trizol试剂(美国Invitrogen公司)说明书所提供的方法提取细胞总RNA,反转录按照反转录试剂盒(美国Promega公司)说明书进行。Real-time PCR反应采用GAPDH作为内参,TSC-22及GAPDH引物合成由大连宝生物公司完成,序列分别为:5'-TSC-22 CGAGTCGGATTGAGCTGCTG-3'(上游),5'-GCAGCCTGGTTCAAACTAGATAAAG-3'(下游);5'-GAPDH GGCACATCAAGGCTGAGAATG-3'(上游),5'-ATGGTGGTGAAGACGCCAGTA-3'(下游);反应体系 10μl:cDNA4μl,上下游引物各 1μl,Power SYBR Green PCR Master Mix(美国 ABI公司)4μl。使用Applied Biosystems 7300实时荧光定量聚合酶链反应仪检测,数据处理采用2-△△CT法。
3.蛋白提取及Western blotting检测:胰酶消化法收集各组细胞,弃上清,PBS洗3遍,加入细胞裂解液后,于4℃裂解20min,12000r/min,4℃离心后,收集上清,BCA法测定提取液的总蛋白浓度。50 μg蛋白经聚丙烯酰胺凝胶电泳分离后转移至硝酸纤维素膜上,5%脱脂奶粉封闭1h,洗膜后加一抗:抗TSC-22抗体(美国 Novus公司),稀释度为1∶500,或抗β-tubulin抗体,稀释度为 1∶3000,4℃ 孵育过夜,洗膜,加HRP标记二抗(北京中杉金桥生物技术有限公司),室温孵育1h,洗膜,ECL法显色。用Quantity One软件(美国Bio Rad公司)扫描条带并分析灰度值。
结 果
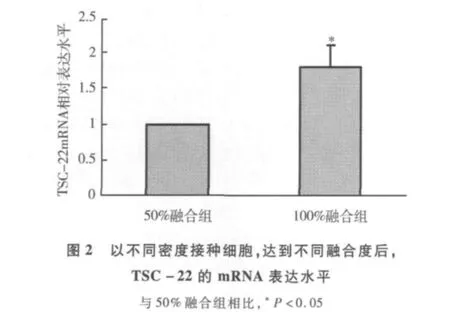
细胞接种培养一定时间后,随着细胞数目的增长,细胞之间互相紧密接触,形成完全融合的单层细胞层,镜下观察培养瓶底部平面全部被细胞所覆盖,即为达到100%融合,见图1。以不同密度接种细胞,培养24h后,100%融合组与50%融合组相比,TSC-22 mRNA水平显著升高,差异有统计学意义(P<0.05),见图 2。
如图3所示,以不同密度接种细胞,培养24 h后,100%融合组与50%融合组相比,TSC-22蛋白水平显著升高,差异有统计学意义(P<0.05)。
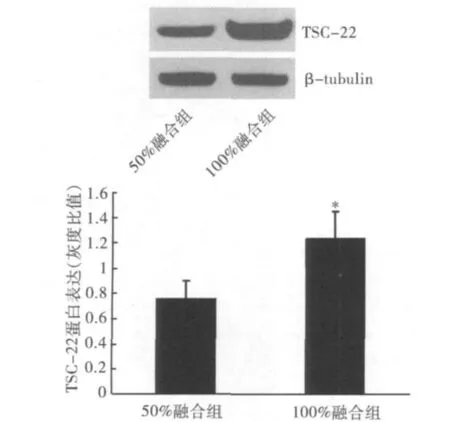
图3 以不同密度接种细胞,达到不同融合度后,TSC-22的蛋白表达水平
如图4所示,以同一密度接种细胞,培养24h达到100%融合后,与培养6h贴壁未融合组相比,TSC-22 mRNA水平显著升高;胰酶消化打破融合,培养6h后,与培养24h达到100%融合组相比,TSC-22 mRNA水平显著下降;胰酶消化后培养24h,重新达到100%融合后,与胰酶消化后培养6h贴壁未融合组相比,TSC-22 mRNA水平显著升高。差异均有统计学意义(P<0.05)。
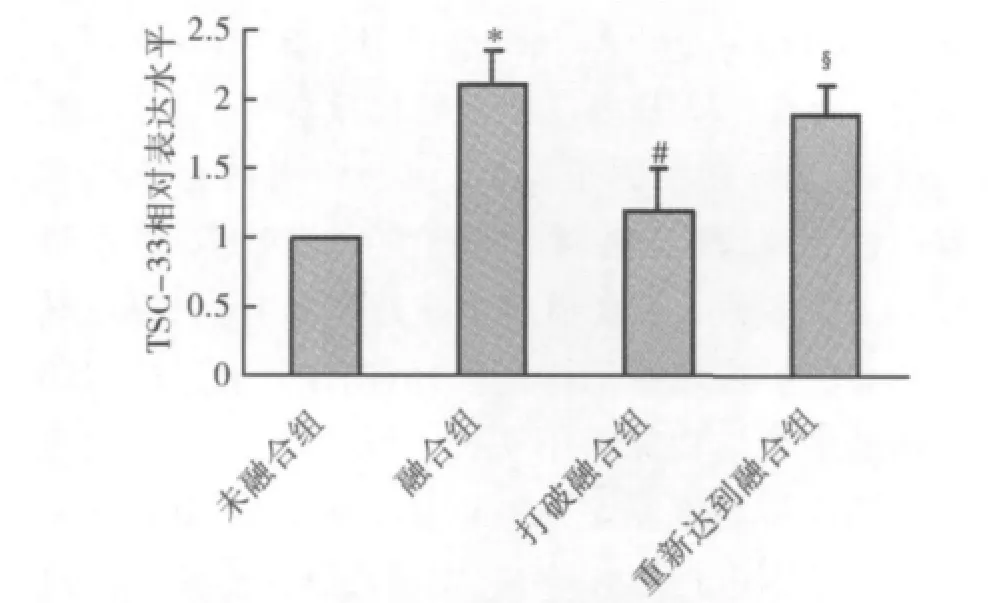
图4 以相同密度接种细胞,达到不同融合度及经胰酶消化处理后,TSC-22的mRNA表达水平
如图5所示,以同一密度接种细胞,培养24h达到100%融合后,与培养6h贴壁未融合组相比,TSC-22蛋白水平显著升高;胰酶消化打破融合,培养6h后,与培养24h达到100%融合组相比,TSC-22蛋白水平显著下降;胰酶消化后培养24h,重新达到100%融合后,与胰酶消化后培养6h贴壁未融合组相比,TSC-22蛋白水平显著升高,差异均有统计学意义(P <0.05)。
讨 论
TSC-22是最早由 Shibanuma等[2]于1992年在小鼠成骨细胞MC3T3E1中鉴定的,受转化生长因子β(transforming growth factor-β,TGF-β)诱导高表达的基因。TSC-22基因在物种间高度保守,属于TSC-22/DIP/Bun转录因子家族,该家族蛋白分子内均含有一段亮氨酸拉链样结构[3,4]。已有文献报道TSC-22在多种心脏病模型中表达明显升高,提示其可能参与心脏病理性重构过程,但调控其表达的机制及具体的生物学功能尚不明确。Stanton等[5]对大鼠心肌梗死模型心脏左室及室间隔心脏组织中表达发生变化的基因进行芯片筛选,发现心脏左室及室间隔组织中TSC-22 mRNA水平在心肌梗死后2~16周均显著升高,提示其参与心肌梗死后的转录调控过程。Rysa等[6]对自发性高血压大鼠心肌肥厚到心力衰竭过程中表达上调的基因进行芯片筛选,结果发现心力衰竭心脏的左室心肌组织中TSC-22转录水平明显升高,提示其参与了心脏重构过程中的转录调控。Chen等[7]对快速起搏诱导的猪心房纤颤模型的心耳组织中表达发生变化的基因进行芯片筛选,亦发现TSC-22 mRNA水平的升高,同时伴随转化生长因子βmRNA表达的上调,提示TSC-22可能在心房纤颤伴随的心肌纤维化及成纤维细胞增殖过程中发挥重要作用。
Kuppers等[1]报道,在发生了接触抑制 的NIH3T3细胞系中TSC-22 mRNA和蛋白表达均显著升高。本研究组之前的结果表明,在大鼠心肌梗死心脏组织中,TSC-22蛋白水平在发生心肌梗死1天~2周时与假手术对照组相比均呈升高趋势[8]。在心肌梗死后的这一时相中,心梗部位的心脏成纤维细胞大量增殖,并在过度增殖的部位存在一定程度的接触抑制现象,在这些部位发生的接触抑制可能是导致TSC-22表达上调的重要原因[9,10]。本研究中,我们通过以不同的密度接种心脏成纤维细胞,检测接触抑制对TSC-22表达的影响,结果表明,以不同密度接种心脏成纤维细胞,培养一定时间,高密度组细胞达到完全融合后,TSC-22的mRNA和蛋白表达水平均较低密度未完全融合组细胞中显著升高。另外,以相同密度接种心脏成纤维细胞,随着培养时间的延长,当达到完全融合后,TSC-22的mRNA和蛋白表达水平均较未达到完全融合的组别显著升高,进一步地,用胰酶打破完全融合细胞组的接触后,TSC-22的mRNA和蛋白表达水平较完全融合细胞组显著下降,继续培养一段时间,当打破融合的细胞组重新达到完全融合后,TSC-22的mRNA和蛋白表达水平较融合打破组又显著升高。这些结果均明确表明,接触抑制是调控TSC-22的重要因素。
已有研究结果显示,TSC-22在某些种类的癌细胞系中具有调控细胞周期、抑制细胞增殖、诱导凋亡发生等生物学功能[3,11,12]。接触抑制是调控细胞生长增殖的一个重要的生物学机制,目前的研究观点认为,未转化的细胞达到完全融合后的接触抑制现象是一个主动有序发生的生物学过程,在该过程中,一系列与细胞周期调控相关的基因表达发生变化,形成一个级联信号网络[1]。本研究发现,TSC-22是心脏成纤维细胞接触抑制发生时表达明确上调的一个新基因,这提示在心脏成纤维细胞在接触抑制发生时,TSC-22可能通过行使其作为转录因子的特定功能,在接触抑制所触发的信号通路中发挥重要作用。对TSC-22确切生物学功能及其作用机制的深入研究,将有助于对心脏重构机制的进一步理解和阐明,并可能作为一个新的生物标志物或治疗靶标应用于心脏病的临床诊断及治疗。
1 Kuppers M,Ittrich C,Faust D,et al.The transcriptional programme of contact-inhibition[J].J Cell Biochem,2010,110(5):1234-1243
2 Shibanuma M,Kuroki T,Nose K.Isolation of a gene encoding a putative leucine zipper structure that is induced by transforming growth factor beta 1 and other growth factors[J].J Biol Chem,1992,267(15):10219-10224
3 Hashiguchi A,Hitachi K,Inui M,et al.TSC-box is essential for the nuclear localization and antiproliferative effect of XTSC-22[J].Dev Growth Differ,2007,49(3):197-204
4 Wu X,Yamada-Mabuchi M,Morris EJ,et al.The Drosophila homolog of human tumor suppressor TSC-22 promotes cellular growth,proliferation,and survival[J].Proc Natl Acad Sci U S A,2008,105(14):5414-5419
5 Stanton LW,Garrard LJ,Damm D,et al.Altered patterns of gene expression in response to myocardial infarction[J].Circ Res,2000,86(9):939-945
6 Rysa J,Leskinen H,Ilves M,et al.Distinct upregulation of extracellular matrix genes in transition from hypertrophy to hypertensive heart failure[J].Hypertension,2005,45(5):927-933
7 Chen CL,Lin JL,Lai LP,et al.Altered expression of FHL1,CARP,TSC-22 and P311 provide insights into complex transcriptional regulation in pacing-induced atrial fibrillation[J].Biochim Biophys Acta,2007,1772(3):317-329
8 史强,魏英杰,张秀芳,等.大鼠心肌梗死后心肌中转化生长因子β诱导基因-22蛋白表达的变化规律及白细胞介素-6对其表达的诱导作用[J].中国循环杂志,2011,26(3):227-230
9 Camelliti P,Devlin GP,Matthews KG,et al.Spatially and temporally distinct expression of fibroblast connexins after sheep ventricular infarction[J].Cardiovasc Res,2004,62(2):415-425
10 Jugdutt BI.Ventricular remodeling after infarction and the extracellular collagen matrix:when is enough enough?[J].Circulation,2003,108(11):1395-1403
11 Nakashiro K,Kawamata H,Hino S,et al.Down-regulation of TSC-22(transforming growth factor beta-stimulated clone 22)markedly enhances the growth of a human salivary gland cancer cell line in vitro and in vivo[J].Cancer Res,1998,58(3):549-555
12 Yu J,Ershler M,Yu L,et al.TSC-22 contributes to hematopoietic precursor cell proliferation and repopulation and is epigenetically silenced in large granular lymphocyte leukemia[J].Blood,2009,113(22):5558-5567
