JMJD6参与调节肿瘤抑制因子p53的转录活性
2012-05-17张艳君程谟斌沈珝琲
张艳君 程谟斌 代 辉 沈珝琲 张 业
p53蛋白作为一个重要的转录因子,可以调控多种基因的表达,它也是最早发现的肿瘤抑制因子之一[1]。有研究表明,在大约50%人类癌症中,p53基因发生了突变。p53作为一个转录因子,当细胞处于应激状态时,会以四聚体的形式紧密结合DNA,通过激活一系列下游靶基因,发挥其调控DNA修复、调节细胞周期和细胞凋亡的功能[2,3]。很多研究显示p53蛋白的激活是一个多级多因子参与的复杂调控机制,这其中p53的翻译后修饰发挥着至关重要的作用[4]。对p53的去乙酰化、磷酸化、泛素化、sumo化和甲基化、去甲基化修饰的研究也有众多报道。
JMJD6是JMJC结构域家族成员。现已发现具有JMJC结构域的蛋白多具有组蛋白去甲基化酶活性[5]。他们以亚铁离子和α-酮戊二酸为辅助因子,可以催化赖氨酸残基上单甲基、双甲基和三甲基发生去甲基化[6]。关于JMJD6的功能先后有不同报道。2004年首先发现JMJD6具有组蛋白精氨酸去甲基化酶活性,但随后发现JMJD6具有赖氨酸羟化酶活性而非精氨酸去甲基化酶活性,它参与RNA的剪接,并倾向于结合单链RNA[7~10]。目前关于JMJD6对p53活性的影响尚未有报道,本文旨在分析两者的相互作用,研究JMJD6对p53靶基因转录活性的影响,并通过鉴定JMJD6的赖氨酸羟化酶活性探讨其可能的作用机制。
材料与方法
1.材料:(1)质粒及细胞:大肠杆菌DH5α、BL21菌种由本课题组提供。HEK293T细胞和 MCF7细胞为本组保存。H1299细胞由中科院生物物理所袁增强老师惠赠。质粒pcDNA6-FLAG-p53及pCMV-Tag2B-p53各删切片段的表达质粒由本课题组保存。POZ-JMJD6真核表达质粒由基础所梅品超老师提供。14×p53-luciferase报告基因质粒由医科院基础所李雷博士提供。(2)试剂及材料:细胞培养基DMEM购自GIBCOBRL公司,胎牛血清购自Hyclone公司。FLAG抗体、FLAG-EZview珠子购自Sigma公司,c-Myc抗体购自Santa cruz公司,二抗辣根过氧化物酶标记的抗小鼠和抗兔IgG购自MBL公司,Glutathione sepharose 4B珠子购自GE公司,限制性内切酶购自NEB公司,T4 DNA连接酶购自Takara公司,Vigofect转染试剂购自威格拉斯公司,IPTG购自amresco公司,双报告荧光检测试剂购于PROMEGA公司。生物素标记的组蛋白H4肽段(氨基酸1~23)在中科亚光公司合成。
2.方法:(1)细胞培养:HEK293T细胞和H1299细胞培养于DMEM培养基(含10%胎牛血清、100μg/ml青霉素和100μg/ml链霉素),培养条件为 5%CO2,37℃。MCF7 细胞培养于DMEM培养基(含15%胎牛血清、100μg/ml青霉素和100μg/ml链霉素),培养条件为 5%CO2,37℃。(2)质粒构建:1)pCMV-3Tag-7-JMJD6真核表达质粒构建:以POZJMJD6质粒为模板,设计引物扩增JMJD6片段,经HindⅢ和SaⅡ双酶切;载体pCMV-3Tag-7经HindⅢ和SaⅡ双酶切后连接。上游引物:5'-GCG AAGCTT AACCACAAGAGCAAGAAGCG-3';下游引物:5'-GCG GTCGAC TCAGGGGTGAGCCCGGCCT-3'。2)pcDNA6-FLAG-JMJD6真核表达质粒构建:pCMV-3Tag-7-JMJD6经HindⅢ和SaⅡ双酶切获得JMJD6目的片段,将SalⅠ黏性末端补齐;载体pcDNA6-FLAG经HindⅢ和EcoRⅤ双酶切后连接。质粒经HindⅢ和XhoⅠ双酶切鉴定,电泳可见约1.2kb片段。3)pGEX4T2-p53原核表达质粒构建:pcDNA6-FLAG-p53经BamHⅠ和XhoⅠ双酶切获得p53目的片段,载体pGEX4T2经BamHⅠ和XhoⅠ双酶切后连接。4)pGEX4T1-p53删切片段原核表达质粒构建:pCMV-Tag2B-p53-ΔC(1~313氨基酸),pCMV-Tag2B-p53-ΔN(96~393氨基酸),pCMV-Tag2B-p53-core(96~313氨基酸),pCMV-Tag2B-p53-C(314~393氨基酸),pCMV-Tag2B-p53-ΔC,-ΔN,-core,-C 经EcoRⅠ和XhoⅠ双酶切获得目的片段,载体pGEX4T1经EcoRⅠ和XhoⅠ双酶切后分别连接。(3)原核蛋白表达纯化:GST-p53各删切体质粒转化大肠杆菌BL21菌株,挑取单克隆37℃进行大量培养,至 OD550达到0.7,加入终浓度为0.5mmol/L的IPTG诱导,16℃培养20h,5000r/min收集菌体。菌体用 BC500-10(20mmol/L This pH7.9,500mmol/L NaCl,1.5mmol/L MgCl2,10%甘油,0.5%TritonX-100)重悬。加入蛋白酶抑制剂(1mmol/L PMSF,1mmol/L DTT),混匀后超声30s,10次。最大转速离心收集上清,并加入 glutathione sepharose 4B 200μl,4℃ 过夜结合。收集 GST 珠子,分别用BC500-10和BC100-10(20mmol/L Tris pH7.9,100mmol/L NaCl,1.5mmol/L MgCl2,10%甘油)洗涤2次和3次,并用终浓度为10mmol/L的还原型谷胱甘肽(50mmol/L Tris pH7.9)洗脱目的蛋白。10%SDS-PAGE凝胶电泳进行蛋白定量。(4)细胞转染:按威格拉斯公司Vigofect高效转染试剂说明书进行。(5)免疫共沉淀:将pCMV-3Tag-7-JMJD6质粒分别与pcDNA6-FLAG或pcDNA6-FLAG-p53质粒共转染HEK293T细胞,48h后用冰预冷的PBS洗涤细胞1次,将细胞吹离瓶壁,悬浮于PBS中。3000r/min、4℃离心3min。裂解缓冲液(50mmol/L Tris-HCl,pH7.5,150mmol/L NaCl,2mmol/L EDTA,0.2%NP-40,1mmol/L DTT,1mmol/L PMSF,10μg/ml leupeptin,10μg/ml aprotinin)裂解细胞。将500μg蛋白裂解液稀释至500μl的裂解缓冲液中,加入20μl protein A/G agarose珠子和1μg c-Myc抗体,将抗体-蛋白混和物于4℃旋转仪上混匀过夜。3000r/min,4℃离心3min,去掉上清。用裂解缓冲液漂洗免疫沉淀复合物5次,收集沉淀,加入1×SDS蛋白电泳上样缓冲液,煮沸5min,免疫印记分析。(6)GST pull-down:将纯化的GST和GST-p53删切体蛋白5μg加入20μl 50%glutathione sepharose 4B珠子混悬液,轻柔混匀,4℃过夜。收集珠子,分别用BC500-10和BC100-10洗涤2次和3次。将 pCMV-3Tag-7-JMJD6质粒转染HEK293T细胞,48h后制备全细胞抽提物。检测蛋白浓度,取500μg蛋白,加入 RIPA-蛋白酶抑制剂至 500μl,加入 20μl 50%glutathione sepharose 4B-GST混悬液,4℃条件下轻柔混匀持续2h。500g、4℃离心5min,弃上清,RIPA洗涤珠子5次,弃上清,加入40μl 1×SDS蛋白电泳上样缓冲液,100℃加热5min。8%SDS-PAGE凝胶电泳,免疫印迹检测。(7)荧光素酶双报告基因检测:将生长旺盛的MCF7细胞和H1299细胞用胰蛋白酶消化,铺至24孔板,24h后转染报告基因质粒,内参照质粒pRL-TK,及相应基因的过表达质粒。37℃、5%CO2孵育 48h,弃去培养基,加入 100μl细胞裂解液,室温30min。取10μl检测荧光素酶及Renillia活性。(8)体外羟基化实验:生物素标记的组蛋白H4肽段(氨基酸1~23)自中科亚光公司合成,在HEK293T细胞中过表达FLAG-JMJD6,按照FLAG-EZview珠子纯化方法获得FLAG-JMJD6蛋白。底物混合物体系如下:组蛋白H4肽段(2μg),α-酮戊二酸(500μmol/L),抗坏血酸(100μmol/L),溶于 Tris(50mmol/L,pH 7.5)中。酶混合物体系如下:FeNH4SO4(100μmol/L),FLAG-JMJD6(0.5μg)溶于Tris(50mmol/L,pH 7.5)中。将二者混合,置于30℃反应1h。反应产物用于LC-MS分析。
3.统计学方法:本实验所有比较各组间数据用t检验,以P<0.05为差异有统计学意义。
结 果
1.表达载体的构建和鉴定:pGEX4T2-p53质粒经BamHⅠ和XhoⅠ双酶切鉴定,电泳可见约1.2kb片段。pGEX4T1-p53-ΔC,-ΔN,-core,-C 质粒经 EcoRⅠ和XhoⅠ双酶切鉴定,电泳可见相应大小的片段。JMJD6和p53各表达载体经测序鉴定,证明构建成功,见图1。
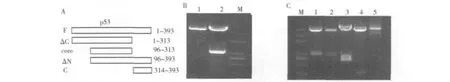
图1 p53各表达载体的酶切分析
2.JMJD6与p53的免疫共沉淀分析:将pCMV-3Tag7-JMJD6及pCMV-3Tag-7空载体分别与pcDNA6-FLAG-p53共转染HEK293T细胞,48h后收集细胞裂解液,用c-Myc标签抗体免疫沉淀,用FLAG标签抗体做免疫印迹,结果显示JMJD6蛋白和p53蛋白可以相互结合,见图2。
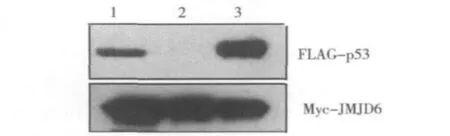
图2 JMJD6与p53的免疫共沉淀分析
3.p53及其删切体质粒的原核表达及纯化:在大肠杆菌中分别表达GST-p53、GST-p53-ΔC-ΔN、-core、-C并纯化,通过SDS-PAGE电泳和考马斯亮蓝染色显示全长及各删切体蛋白表达良好,见图3。
4.JMJD6与p53的GST pull-down分析:利用原核表达的GST-p53蛋白全长及各删切体与在HEK293T细胞中表达的Myc-JMJD6进行GST pull-down实验,结果显示,GST-p53、GST-p53-ΔN、GST-p53-C可与 JMJD6结合,而 GST-p53-ΔC和GST-p53-core不与JMJD6结合,说明JMJD6和p53蛋白可以在体外发生相互作用,p53的C端结构域是p53结合JMJD6的重要位置,见图4。
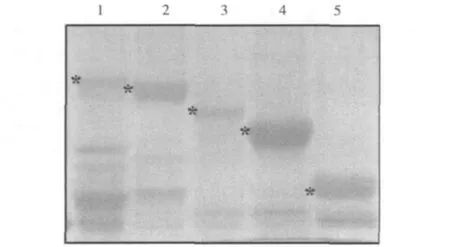
图3 p53及其删切体的SDS-PAGE分析
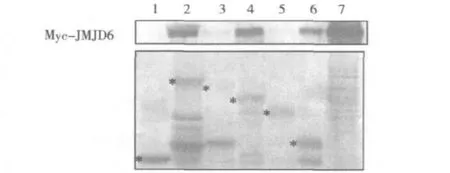
图4 JMJD6与p53的GST pull-down分析
5.JMJD6对p53靶基因启动子活性的影响:将细胞铺至24孔板,24h后转染14×p53-Luc(包含14个串联的p53结合元件)报告基因质粒0.1μg,内参照质粒pRL-TK 0.002μg及各组质粒,转染48h后检测,见图5。
结果发现无论是在外源转染p53的H1299细胞中,还是在表达野生型p53的MCF7细胞中,JMJD6均可以使14×p53-Luc的荧光素酶活性提高(P<0.05),激活作用依赖于p53蛋白的存在,表明JMJD6能够促进p53的转录活性。
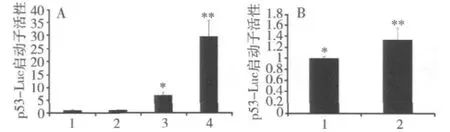
图5 JMJD6对p53靶基因启动子活性的影响
6.JMJD6的体外羟基化实验:在HEK293T细胞中过表达pcDNA6-FLAG-JMJD6质粒,利用FLAG-EZview珠子免疫沉淀获得了FLAG-JMJD6蛋白作为反应酶,以生物素标记的包含组蛋白H4的N端23个氨基酸的肽段作为底物,进行了体外羟化反应。通过质谱鉴定反应产物,结果显示组蛋白 H4有16kDa的质量迁移,说明JMJD6催化组蛋白H4发生了羟基化反应,具有羟化酶活性。

图6 JMJD6羟基化反应的质谱分析
讨 论
组蛋白修饰和转录因子的翻译后修饰研究一直备受关注[11,12]。p53蛋白作为一个重要的转录因子,是最早发现的肿瘤抑制因子之一[1]。它参与调控DNA修复,调节细胞周期和细胞凋亡[2,3]。很多研究显示p53蛋白的激活是一个多级多因子参与的复杂调控机制,这其中p53的翻译后修饰发挥着至关重要的作用[4]。例如,细胞经过紫外(UV)或γ射线处理后,p53的C端6个赖氨酸可以被p300乙酰化修饰,这是激活p53转录活性的重要标志之一[13]。另有报道精氨酸甲基转移酶PRMT1介导的p53-333、335、337位精氨酸甲基化修饰也会影响p53的转录活性[14]。除此之外,对p53的去乙酰化、磷酸化、泛素化、sumo化和赖氨酸甲基化、去甲基化修饰的研究也有众多报道。
JMJD6是组蛋白去甲基化酶家族成员之一,并具有赖氨酸羟化酶活性,它参与RNA的剪接,并倾向于结合单链RNA[9,10]。本研究发现 JMJD6可以与 p53的C端结构域发生相互作用,并激活p53的转录活性。在体外羟基化-质谱分析中发现JMJD6可以催化生物素标记的组蛋白H4肽段发生羟基化反应,这提示JMJD6作为赖氨酸羟化酶可能通过羟基化p53 C端结构域的赖氨酸调控p53的转录活性。另外在体外羟基化-质谱分析中同时发现标记组蛋白H4肽段的生物素同样可以被JMJD6羟基化,提示JMJD6可能不具有底物选择的特异性。
目前对p53的翻译后修饰(包括乙酰化、去乙酰化、磷酸化、泛素化、sumo化、甲基化以及去甲基化)的研究已有众多报道。我们相信很多翻译后修饰相关酶类在这一过程中发挥着重要作用,这其中包括赖氨酸羟化酶JMJD6,可能通过修饰p53来调控其转录活性,从而参与到DNA修复,细胞周期和细胞凋亡的调控过程中。
1 Baker SJ,Fearon ER,Nigro JM,et al.Chromosome 17 deletions and p53 gene mutations in colorectal carcinomas[J].Science,1989,244(4901):217-221
2 Levine AJ.p53,the cellular gatekeeper for growth and division[J].Cell,1997,88(3):323-331
3 Zhang Y,Wang JS,ChenLL,et al.Repression of hsp90beta gene by p53 in UV irradiation-induced apoptosis of Jurkat cells[J].J Biol Chem,2004,279(41):42545-42551
4 Kruse JP,Gu W.SnapShot:p53 posttranslational modifications[J].Cell,2008,133(5):930-30 e1
5 Tsukada Y,Fang J,Erdjument-Bromage H,et al.Histone demethylation by a family of JmjC domain-containing proteins[J].Nature,2006,439(7078):811-816
6 Klose RJ,Kallin EM,Zhang Y.JmjC-domain-containing proteins and histone demethylation[J].Nat Rev Genet,2006,7(9):715-727
7 Chang B,Chen Y,Zhao Y,et al.JMJD6 is a histone arginine demethylase[J].Science,2007,318(5849):444-447
8 Hahn P,Wegener I,Burrells A,et al.Analysis of Jmjd6 cellular localization and testing for its involvement in histone demethylation[J].PLoS One,2010,5(10):e13769
9 Webby CJ,Wolf A,Gromak N,et al.Jmjd6 catalyses lysyl-hydroxylation of U2AF65,a protein associated with RNA splicing[J].Science,2009,325(5936):90-93
10 Hong X,Zang J,White J,et al.Interaction of JMJD6 with singlestranded RNA[J].Proc Natl Acad Sci U S A,2010,107(33):14568-14572
11 Zhao HY,Zhang YJ,Dai H,et al.CARM1 mediates modulation of Sox2[J].PLoS One,2011,6(10):e27026
12 Strahl BD,Allis CD.The language of covalent histone modifications[J].Nature,2000,403(6765):41-45
13 Gu W,Roeder RG.Activation of p53 sequence-specific DNA binding by acetylation of the p53 C-terminal domain[J].Cell,1997,90(4):595-606
14 Jansson M,Durant ST,Cho EC,et al.Arginine methylation regulates the p53 response[J].Nat Cell Biol,2008,10(12):1431-1439
