单抗药物组织交叉反应中不同免疫组织化学方法的比较性研究
2012-05-17吕建军李珊珊杨艳伟
林 志 吕建军 屈 哲 李珊珊 张 迪 杨艳伟 李 波
单克隆抗体类药物作为一种新型的生物技术药物具有特定的免疫性。如果除了与适应证相关本身特定的靶器官外,人体正常组织细胞中存在相同或相似的抗原决定簇,单克隆抗体类药物则可能会与非靶器官外的其他组织或细胞结合,从而产生严重的不良反应[1]。因此单克隆抗体类药物的免疫交叉反应在药物临床前的安全性评价中非常重要。根据FDA的相关规定,抗体类药物的免疫交叉反应常常采用正常成人组织或相应的细胞株进行免疫组织化学或免疫细胞化学试验[2]。然而,单克隆抗体药物作为一种创新的生物技术药物,尤其是全人源化单抗药物的研发,其人体组织交叉反应在技术上仍存在很多困难,如何采用合适的免疫组织化学的方法是我们需要深入讨论的问题[3]。本文拟通过两种不同的单克隆抗体药物进行组织交叉反应的比较研究,以探讨免疫组织化学常规二步法和直接法在人体组织交叉反应研究中的应用。
材料与方法
1.单克隆抗体的准备:实验采用了两种不同的单克隆抗体药物,分别为贝伐单抗(抗血管内皮生长因子受体单克隆抗体)和美罗华(抗CD20单克隆抗体,罗氏公司)。其中贝伐单抗为全人源化单克隆抗体,美罗华为人鼠嵌合型单克隆抗体。根据各抗体的预实验结果,采用不同的抗体最佳浓度进行多种免疫组织化学方法的比较研究(表1)。

表1 不同免疫组织化学方法中两种抗体的最佳浓度*
2.正常人体组织以及肿瘤组织的准备:贝伐单抗是抗血管内皮生长因子受体单克隆抗体(VEGF),因此相应选用高表达VEGF的人血管肉瘤组织(由南京医科大学提供)作为实验对象。美罗华是抗B淋巴细胞表面抗原CD20的单克隆抗体,因此相应选用人淋巴结(由中国食品药品检定研究院提供)作为实验对象。上述组织通过相关抗体证实其对应抗原均保存良好。
3.免疫组织化学方法:(1)常规二步法:正常人体组织或肿瘤组织组织切片脱蜡水化;3%H2O2作用10min,以阻断内源性过氧化物酶;蒸馏水洗,PBS浸泡5min;微波抗原修复10min;蒸馏水及PBS漂洗;正常羊血清工作液封闭,放置37℃温箱孵育60min;滴加一抗,4℃冰箱孵育过夜;PBS漂洗;滴加二抗(贝伐单抗为全人源化单抗,对应二抗为羊抗人多克隆抗体,北京中杉金桥有限公司提供;美罗华为人鼠嵌合型单抗,对应二抗为羊抗鼠F(ab)多克隆抗体,PIERCE公司提供),37℃温箱孵育60min;贝伐单抗采用DAB溶液显色,美罗华采用碱性磷酸酶显色;脱水透明后封片。(2)直接法:正常人体组织或肿瘤组织组织切片脱蜡水化;3%H2O2作用10min,以阻断内源性过氧化物酶;蒸馏水洗,PBS浸泡5min;微波抗原修复10min;蒸馏水及PBS漂洗;正常羊血清工作液封闭,放置37℃温箱孵育60min;内源性生物素封闭;滴加生物素标记的一抗,4℃冰箱孵育过夜;PBS漂洗;滴加链酶卵白素(streptavidin-HRP),37℃温箱孵育60min;DAB溶液显色;苏木精复染,自来水洗,盐酸乙醇分化,返蓝;脱水透明后封片。
4.免疫组织化学方法评分:贝伐单抗以肿瘤细胞胞质出现棕黄色颗粒为阳性信号,美罗华以淋巴结B淋巴细胞胞膜出现蓝色颗粒为阳性信号。按Breasalier等[4]的方法判断染色结果。在每张切片随机选取10个视野,根据细胞染色强度分为4级,并分别记分,阴性:细胞无着色(0分),弱阳性:浅黄色或浅蓝色(1分),中度阳性:棕黄色或蓝色(2分),强阳性:深棕黄色或深蓝色(3分)。计算每一染色强度的细胞占视野的百分数,根据下列公式计算平均染色强度(insensity score),IS=∑{〔0×F0〕+〔1×F1〕+〔2×F2〕+〔3×F3〕},式中,F=每一强度细胞所占视野百分数×10视野。
5.统计学方法:所有实验均重复3次,结果以均数±标准差(±s)表示。应用SPSS 11.0统计软件对结果进行t检验。P<0.05为差异有统计学意义。
结 果
1.贝伐单抗不同免疫组织化学方法的结果:采用直接法进行贝伐单抗的组织交叉反应,结果显示阴性对照组背景干净,血管肉瘤未着色,为阴性表达(图1A)。实验组采用生物素标记后的20μg/ml贝伐单抗,血管肉瘤组织呈深棕黄色,为强阳性表达(图1B)。采用常规免疫组织化学二步法进行贝伐单抗的组织交叉反应,结果显示阴性对照组血管肉瘤组织中淋巴细胞及纤维组织呈浅黄色,为弱阳性表达,肿瘤细胞未着色(图1C)。实验组采用200μg/ml贝伐单抗,血管肉瘤组织呈浅黄色,为弱阳性表达(图1D)。如图所示直接法可以有效地减低背景的非特异性染色,并且提高实验的灵敏度,仅在20μg/ml就显示出较好的染色结果。比较两种方法,直接法中实验组血管肉瘤组织的平均染色强度与阴性对照组存在显著性差异(P<0.01),而常规二步法中实验组血管肉瘤组织的平均染色强度与阴性对照组差异不明显(图2)。

图1 贝伐单抗组织交叉反应不同方法的比较(×200)
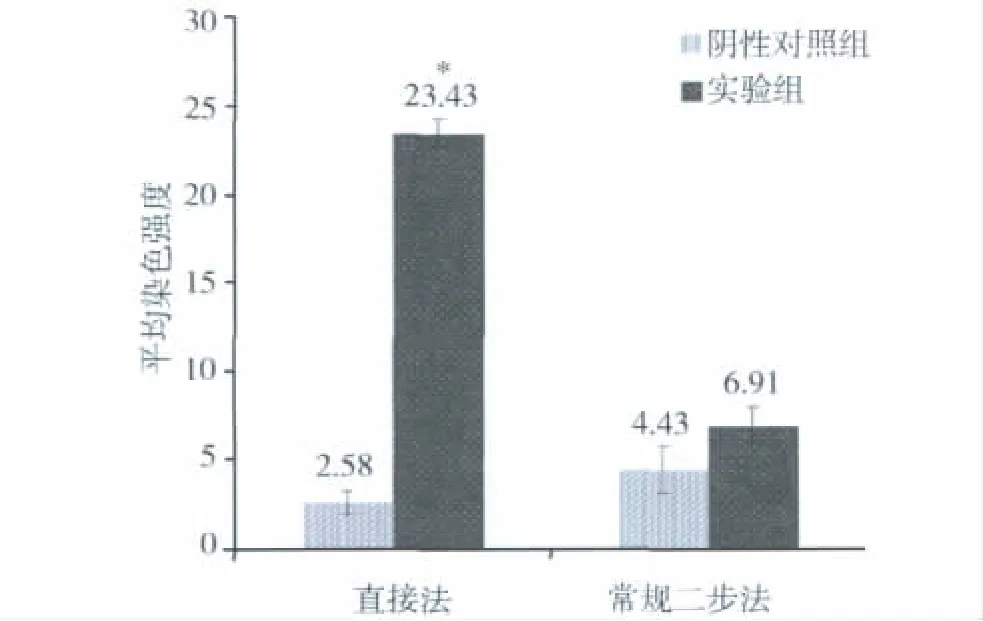
图2 贝伐单抗的组间平均染色强度差异性比较
2.美罗华不同免疫组织化学方法的结果:美罗华为抗CD20单克隆抗体,因此该抗体能与淋巴滤泡中的B细胞结合。采用直接法进行美罗华的组织交叉反应,结果显示阴性对照组背景干净,淋巴结滤泡(B细胞)及髓窦内未着色,为阴性表达(图3A和图3C)。实验组采用生物素标记后的100μg/ml美罗华,仅在淋巴结髓窦内见巨噬细胞呈深棕黄色,为强阳性表达(图3D)。采用常规免疫组织化学二步法进行美罗华的组织交叉反应,结果显示阴性对照组淋巴结未着色(图3E)。实验组采用20μg/ml美罗华,淋巴结滤泡(B细胞)呈蓝色,为阳性表达(图3F)。如图3所示,直接法未能有效地显示美罗华与B细胞的结合,反而出现了髓窦巨噬细胞非特异性染色。常规二步法美罗华仅在20μg/ml就显示出特异性的染色结果,淋巴滤泡B细胞呈蓝色,为阳性表达。
讨 论
1975年Kohler和Milstein创立了杂交瘤技术,为单克隆抗体的研制和开发揭开了序幕。随着转基因技术的日臻完善,完全人源化抗体已经实现,即通过灭活小鼠内源性免疫球蛋白基因,再将人免疫球蛋白基因嵌于其基因组后产生[5]。由于该类生物技术药物在疾病治疗中广阔的应用前景,单克隆抗体药物成为了各国科学家研究的重要领域[6,7]。
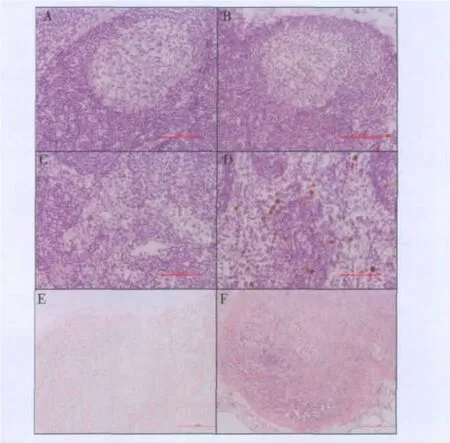
图3 美罗华组织交叉反应不同方法的比较(×200)
如果人体正常组织细胞中存在相同或相似的抗原决定簇,单克隆抗体类药物则可能会与非靶器官外的其他组织或细胞结合,从而产生严重的不良反应。因此单克隆抗体类药物的组织交叉反应在药物临床前的安全性评价中非常重要[8]。免疫组织化学在很多技术上存在困难[9,10]。尤其是最近以来,完全人源化单克隆抗体药物的研发成为热点,这使得人源化单抗进行免疫组织化学研究中所选用的二抗为羊抗人抗体。因此,正常人组织能与二抗(抗人组织抗体)结合造成背景非特异性染色增强,很大程度上干扰了实验结果。尽管有部分文献提供了一些解决办法,如采用与待测组织相同的5%的正常血清(人血清)稀释二抗;采用经胃蛋白酶消化处理二抗使其不含Fc段;采用二抗相同种族的正常血清封闭切片等[11,12]。但是这只能部分解决非特异性染色的问题,目前仍没有可接受的办法。
本文通过两种不同类型的单克隆抗体药物贝伐单抗和美罗华,分别采用了常规二步法和直接法,进行了人体组织交叉反应。实验结果表明贝伐单抗采用直接法,能够有效地显示出与血管肉瘤组织的结合,其特异性及敏感性都远高于常规二步法。直接法采用生物素化的抗体,避免了抗人二抗的使用,减少了二抗与人体组织的非特异性结合。此外,通过链酶卵白素放大系统,放大了抗体与组织结合的效力。然而,美罗华实验却反应出相反的结果。生物素直接标记的美罗华与淋巴结B细胞未见结合,反而在髓窦内巨噬细胞出现非特异性的结合。采用常规二步法,美罗华与淋巴结B细胞出现特异性结合,并且由于美罗华是人鼠嵌合型单抗,二抗采用抗鼠的二抗,有效地减低了背景性的染色。
直接法与常规二步法对于单抗药物的组织交叉反应各有利弊。直接法的优势在于其能有效地避免抗人抗体作为二抗的使用,从而降低了背景染色,有利于最终结果的判定。然而,生物素直接标记后无法确定是否改变了受检单抗的结构特征,因而修饰过的抗体可能与其他非特异性抗原结合,提高实验的假阳性。常规二步法的优点在于直接受检的单抗为一抗,因此抗体的特征与最终临床使用的抗体药物一致,结果最为真实地反映了药物与靶位抗原的结合情况。但是,随着全人源化单抗的日益增多,在常规二步法中需要应用抗人抗体作为二抗,这届不可避免的造成二抗直接与人体组织标本的非特异性抗原结合,从而使得背景染色增强,干扰了最终结果的判定。
本文通过不同实验方法的比较,采用两种不同的单抗,发现不同的单抗适用不同的试验方法。一般而言,以下循序适用于初次研究者进行人体组织交叉反应研究,即先采用常规二步法,如果背景染色过强时考虑换用直接法。最终试验方法的确定取决于该单抗的组织交叉反应结果。有文献报道,常规二抗法中二抗的选择非常重要,避免选用Fc段的二抗可以在一定程度上改善结果[13~15]。当检测抗体为全人源化抗体时,可以采用抗独特型抗体作为二抗进行组织交叉反应。但是仍需要注意抗独特型抗体是否结合内源性的IgG,并确定其不会改变测试抗体的亲和力。在采用生物素标记抗体进行免疫组织化学染色时有两个问题需要考虑:第一是必须对阴性对照抗体同时进行生物素标记,第二必须在加一抗前阻断内源性的生物素。通常阻断采用卵白素和生物素,并且需要采用去除一抗的染色以平行比较内源性生物素结合的情况。总之,组织交叉反应作为单克隆药物的临床前安全性评价的重要组成部分,只有提高是建立和完善该类创新生物技术药物的临床前安全性评价体系的基础,才能促进我国生物技术药物的蓬勃发展。
1 王军志.生物技术药物研究开发和质量控制[M].北京:北京科学出版社,2007:363
2 U S Food and Drug Administration Center for Biologics Evaluation and Research.Points to consider in the manufacture and testing of monoclonal antibody products for human use[J].J Immunother,1997,20(3):214-243
3 Johnson CW.Issues in immunohistochemistry[J].ToxicolPathol,1999,27(2):246-248
4 Bresalier RS,Ho SB,Schoeppner HL,et al.Enhanced sialylation of mucin-associated carbohydrate structures in human colon cancer metastasis[J].Gastroenterology,1996,110(5):1354-1367
5 Davis CG,Gallo ML,Corvalan JRF.Transgenic mice as a source of fully human antibodies for the treatment of cancer[J].Cancer and Metastasis,1999,12(18):421
6 姜倩倩,刘京贞,苏瑞强.单克隆抗体药物进展[J].药物生物技术,2005,12(4):270-274
7 沈倍奋.抗体药物研究进展[J].第二军医大学学报,2002,23(10):1047
8 林志.免疫交叉反应在单克隆抗体类药物临床前安全性评价中的应用[J].毒理学杂志,2007,21(4):303
9 Taylor CR,Levenson RM.Quantification of immunohistochemistryissues concerning methods,utility and semiquantitative assessment II[J].Histopathology,2006,49(4):411-424
10 Taylor CR.Focus on biospecimens:the issue is the tissue[J].Appl Immunohistochem Mol Morphol,2011,19(2):95-98
11 Naseri M,Moazzeni SM,Pourfathollah AA.APAAP complex:Production and usage in immunocytochemical and immunohistochemical staining[J].Hum Antibodies,2007,16(3-4):107-115
12 Vosse BA,Seelentag W,Bachmann A,et al.Background staining of visualization systems in immunohistochemistry:comparison of the Avidin-Biotin Complex system and the EnVision+system[J].Appl Immunohistochem Mol Morphol,2007,15(1):103-107
13 Cavagnaro JA.Preclinical safety evaluation of biopharmaceuticals:a since-based approach to facilitating clinical trials[M].John Wiley Sons Inc,2008:207-239
14 Goldstein NS,Hewitt SM,Taylor CR,et al.Recommendations for improved standardization of immunohistochemistry[J].Appl Immunohistochem Mol Morphol,2007,15(2):124-133
15 Skaland I,Nordhus M,Gudlaugsson E,et al.Evaluation of 5 different labeled polymer immunohistochemical detection systems[J].Appl Immunohistochem Mol Morphol,2010,18(1):90-96
