液体乳和乳饮料中β-内酰胺酶检测方法的研究
2012-01-28张明郑凤娥杨春晖
张明,郑凤娥,杨春晖
(国家加工食品及添加剂质量监督检验中心,沈阳产品质量监督检验研究院,辽宁沈阳110136)
在我国乳品工业中,人们广泛采用抗生素来治疗奶牛的乳腺炎和其它感染性疾病,这导致我国乳制品中抗生素含量较高。2001年9月,我国农业部颁布了《无公害食品生鲜牛乳》行业标准,该标准规定生鲜乳中抗生素“不得检出”。为了防止抗生素在乳制品中的残留,不法生产者在牛奶中加入生物解抗剂,这种解抗剂就是从微生物中提取的β-内酰胺酶。该酶能催化水解6-氨基青霉烷酸(6-APA)和7-氨基头孢烷酸(7-ACA)及其N-酰基衍生物分子中β-内酰胺环酰胺键,其对青霉素具有破坏或抑制作用[1-3]。经生物解抗剂处理过的牛奶存在以下潜在危害:①降解产物是抗生素的类似物,人长期饮用会引起耐药性;②解抗剂滥用会引入大量的致病菌、致癌物等有害物质,危害人民身体健康。③产品以次充好,扰乱市场。本研究通过舒巴坦特异性抑制β-内酰胺酶的这种作用,在样品中先后加入舒巴坦和青霉素,采用杯碟法测定抑菌圈大小差异来检测β-内酰胺酶。然后对菌种、培养基、所选用试剂浓度和培养时间等方面进行研究,确定了检测方法条件。
1 材料和方法
1.1 材料
1.1.1 菌种和培养基
藤黄微球菌(Micrococcus Luteus),菌种号CMCC(B)28001,中国药品生物制品检定所。
抗生素Ⅰ号培养基:蛋白胨5 g,磷酸氢二钾3 g,牛肉粉3 g,琼脂13 g,蒸馏水1 000 mL,pH 6.5~6.6。
菌种培养基(LB 营养琼脂):蛋白胨10.0 g,牛肉浸膏3.0 g,氯化钠5.0 g,琼脂15 g~20 g,蒸馏水1 000 mL,pH 7.0~7.2。
1.1.2 主要试剂和仪器
β-内酰胺酶标准品:纯度≥90%,酶活1 200 IU/mg,中国药品生物制品检定所;舒巴坦标准品:纯度89.2 %,中国药品生物制品检定所;青霉素G:色谱级,纯度97%,中国药品生物制品检定所。
恒温培养箱(DHP9082):上海一恒科技有限公司;抑菌圈自动测量分析仪(ZY-300IV):北京先驱威锋技术开发公司;培养皿:内径(90±0.5)mm,皿底平整光滑,厚薄均匀无凹凸现象;血球计数板;牛津杯:不锈钢管,外径[(7.8±0.1)mm],内径[(6.0±0.1)mm],高度[(10.0±0.1)mm];陶瓦盖:内径110 mm,外径116 mm,高度26 mm。
1.2 方法
1.2.1 菌悬液的制备
取新鲜培养的藤黄微球菌LB 营养琼脂斜面培养物,每只管中加入2 mL~3 mL 灭菌生理盐水,将菌苔洗下,振荡均匀,合并菌液至灭菌试管中。
1.2.2 检定用培养基的制备
在无菌培养皿中注入抗生素Ⅰ号培养基,作为底层培养基,水平静置,使其凝固。将适量菌悬液加入到55 ℃左右的菌种培养基中,混匀,然后注入铺有底层培养基的培养皿中,均匀摊开、凝固。在每个培养基表面放置4 个牛津杯,呈均匀对称分布。检定用培养基平板需当天配置使用。
1.2.3 试样制备
样品:将25 mL 样品混合均匀,待处理。阴性对照样品:0.8%灭菌生理盐水。阳性对照样品:酶活力为0.1 IU/mL β-内酰胺酶的阳性对照样品。将试样和对照品分别加入适量舒巴坦和青霉素G,将上述混合液充分振荡混匀,室温放置1 h。
1.2.4 试样测定
每组试验做3 个重复,将陶瓦盖盖好,培养皿水平放置于培养箱中培养22 h~24 h。培养结束后去除陶瓦盖和牛津杯,使用抑菌圈自动测量分析仪或游标卡尺精确测量抑菌圈直径。
2 结果与讨论
2.1 指示菌和菌悬液
2.1.1 指示菌的选择
因为β-内酰胺酶的检测是以青霉素作为直接检测指标进行的测定,所以选择非致病性的对青霉素敏感的藤黄微球菌作为指示菌[4]。
2.1.2 菌悬液浓度的确定
本研究使用0.8%灭菌生理盐水3 mL 将新鲜培养的藤黄微球菌洗涤下来制成菌悬液[5],使用血球计数板对其计数,得出菌悬液浓度为1×109cfu/mL。
2.2 培养基的选择及用量
2.2.1 培养基的选择
下层培养基根据药典采用抗生素Ⅰ号培养基,用量为10 mL。
上层培养基分别考察了抗生素Ⅳ号培养基和LB营养琼脂[6]按照本方法进行操作,两种培养基的实验结果见图1。
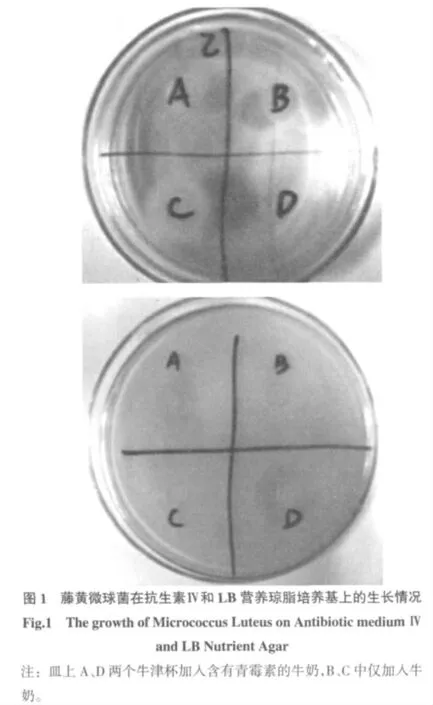
从实验结果可以看出藤黄微球菌在抗生素Ⅳ号培养基上不能良好地生长,而在LB 营养琼脂上生长良好,青霉素可以抑制藤黄微球菌在LB 营养琼脂上的生长。因此选择LB 营养琼脂作为上层培养基使用。
2.2.2 上层培养基的用量
为考察上层培养基用量对实验结果的影响,我们做了如下实验:固定下层培养基用量为10 mL,上层培养基(含1×109cfu/mL 藤黄微球菌)用量分别为4 mL、5 mL、6 mL。配制一定浓度青霉素G 的生理盐水标液,按照本方法进行操作。实验结果见表1。4 mL 上层培养基产生的抑菌圈平均直径为26.54 mm;5 mL 上层培养基产生的抑菌圈平均直径为24.16 mm;6 mL 上层培养基产生的抑菌圈平均直径为23.53 mm。从实验数据中可以看出,上层培养基的用量越少,溶液渗透后所形成的抑菌圈越大。但考虑到双层平板在制备的过程中对上层培养基温度、培养基的水平程度的要求,选择5 mL 最为适宜。
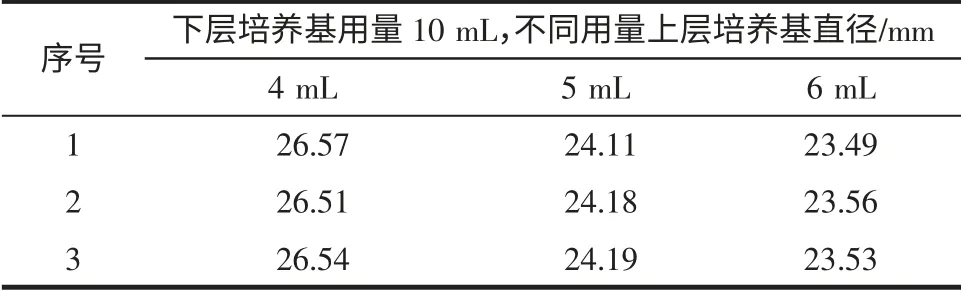
表1 上层培养基用量对实验结果的影响Table 1 The effects of upper medium volume on the experimental results
2.3 青霉素G 浓度的选择
3 个抗生素检测平板,每个平板上放置3 个牛津杯,杯中分别加入200 μL 含有0.05 μg/mL,0.1 μg/mL,0.2 μg/mL,0.5 μg/mL,1.0 μg/mL,1.5 μg/mL,3.0 μg/mL,6.0 μg/mL,12 μg/mL 青霉素G 的10%脱脂牛奶,37 ℃培养18 h~22 h。实验结果见表2。
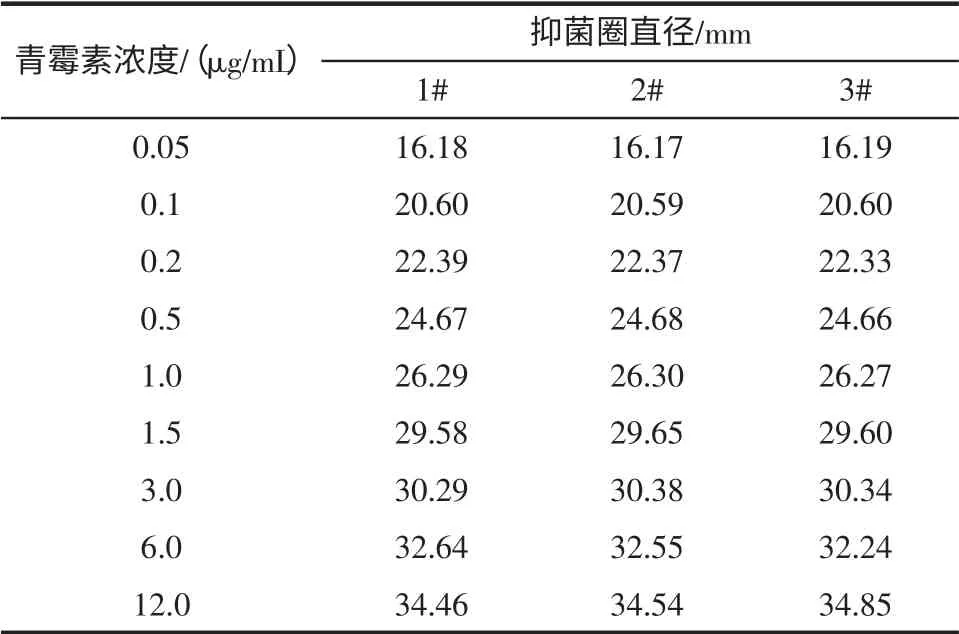
表2 不同浓度青霉素的抑菌圈实验Table 2 The inhibition zone test of different concentrations of penicillin
在杯碟法试验中,产生的抑菌圈越大,误差就越大。一般选择抑菌圈大小在24 mm 左右较为适宜。0.5 μg/mL 的青霉素G 在抗生素检定平板上可产生稳定的24 mm 的抑菌圈直径,为了使结果更便于观察,我们选择0.5 μg/mL 的青霉素G 作为使用浓度。
2.4 β-内酰胺酶对抑菌效果的影响
2.4.1 β-内酰胺酶对藤黄微球菌生长的影响
在每个抗生素检测用培养基上均匀放置6 个牛津杯,在每个杯子中分别加入200 μL 不同浓度β-内酰胺酶(0.001 IU/mL,0.1 IU/mL,1 IU/mL,10 IU /mL,100 IU/mL,1000 IU/mL) 的标准溶液,37 ℃培养18 h~22 h,观察牛津杯周围的抑菌圈情况。实验结果见图2。

从实验结果可以看出,各种浓度的β-内酰胺酶均没有形成抑菌圈,说明在选择的浓度范围内β-内酰胺酶对藤黄微球菌的生长没有影响。
2.4.2 β-内酰胺酶对青霉素抑菌效果的影响
配制含有不同浓度单位为IU/mL 的β-内酰胺酶(0、5×10-6、5×10-5、5×10-4、5×10-3、0.05、0.5、5)的奶样,在奶样中加入青霉素G,使终浓度为0.5 μg/mL。
在每个抗生素检测用培养基上均匀放置4 个牛津杯,在每个杯子中分别加入200 μL 上述样液37 ℃培养18 h~22 h,观察抑菌圈情况。实验结果见表3。

表3 β-内酰胺酶对青霉素抑菌作用的影响Table 3 The inhibitory effects of β-lactamase on penicillin
从实验结果可以看出浓度在0.05 IU/mL 及以上的β-内酰胺酶可以将0.5 μg/mL 青霉素G 完全分解,使其失去抑菌作用。
2.5 舒巴坦用量的确定
2.5.1 舒巴坦抑菌浓度的确定
配制含有不同浓度舒巴坦(0、12.5、25、50、100、200、400、800 μg/mL)的奶样。
在每个抗生素检测用培养基上均匀放置4 个牛津杯,在每个杯中分别加入200 μL 以上不同舒巴坦浓度的奶样37 ℃培养18 h~22 h。观察是否产生抑菌圈,以确定不产生抑菌圈的最高舒巴坦浓度。实验结果见表4。

表4 舒巴坦抑菌浓度实验结果Table 4 The results of sulbactam MIC
从试验结果中可以看出,舒巴坦浓度在200 μg/mL以下均不产生抑菌圈,表明200 μg/mL 的舒巴坦浓度是控制抗生素的临界浓度,因此可以确定舒巴坦的安全使用浓度范围为0~200 μg/mL。为了更安全起见,选取0~100 μg/mL 浓度的舒巴坦通过以下试验确定最佳使用浓度。
2.5.2 舒巴坦使用浓度的确定
牛奶解抗剂的推荐使用浓度为4 mL,牛奶解抗剂加入到4 t 牛奶中。本实验将解抗剂加到10%空白牛奶中,稀释配成牛奶解抗剂浓度为10-4的奶样(高于推荐使用浓度100 倍),用来确定舒巴坦的使用浓度。
2 个抗生素检测平板,每个平板上平均放置3 个牛津杯,在2 个检测平板的1 个牛津杯中均加200 μL含有0.5 μg/mL 青霉素的空白奶样;其余4 个杯子杯子中分别添加200 μL 含有0.5 μg/mL 青霉素G、舒巴坦(25,50,75,100 μg/mL)的解抗剂浓度为10-4的奶样,37 ℃培养18 h~22 h。观察产生抑菌圈情况,以确定舒巴坦最终适用浓度。结果见表5。

表5 确定舒巴坦使用浓度试验数据Table 5 The experimental data of the concentration of sulbactam using
由试验结果可以看出,添加舒巴坦浓度为25 μg/mL时,抑菌圈直径为16.99 mm,当添加舒巴坦浓度为50、75、100 μg/mL 时,抑 菌 圈 直 径 分 别 达 到25.01,25.08,25.09 mm,与仅添加青霉素形成的抑菌圈直径25.05 mm 相差很小。即当舒巴坦的浓度为25 μg/mL未能完全抑制牛奶解抗剂的活性;舒巴坦超过50 μg/mL时,高浓度牛奶解抗剂的活性均能被抑制,因此,选择舒巴坦的使用浓度为50 μg/mL,这一浓度与200 g/mL的舒巴坦最高安全使用浓度相差4 倍。
2.6 方法检测限
准确配置含有0.02、0.01、0.005、0.001 IU/mL β-内酰胺酶的牛奶样液,按样品检测进行操作,测定牛奶中β-内酰胺酶的检测限,试验结果见表6。实验结果表明,本方法的最低检测限为0.005 IU/mL。
2.7 培养时间的确定
配制含β-内酰胺酶0.005 IU/mL 的10%脱脂奶,做定性试验,共需15 个平行,在培养到18、20、22、24、26 h 时分别取出3 个平皿,测量A、D 圈的大小变化。结果见表7。

表6 牛奶中β-内酰胺酶检测限实验数据Table 6 The experimental data of β-lactamase detection limit in milk

表7 β-内酰胺酶(0.005 IU/mL)培养时间试验数据Table 7 The test data of incubation time with 0.005 IU/mL β-lactamases
由试验结果可知,当培养时间在22 h~24 h 时,A与D 抑菌圈直径之差趋于稳定,所以确定培养时间为22 h~24 h。
2.8 方法的准确度试验
准确配置含有0.005 IU/mL β-内酰胺酶的牛奶标准溶液,使用该方法进行9 次3 组平行测定,考察方法的准确性,试验数据统计见表8。
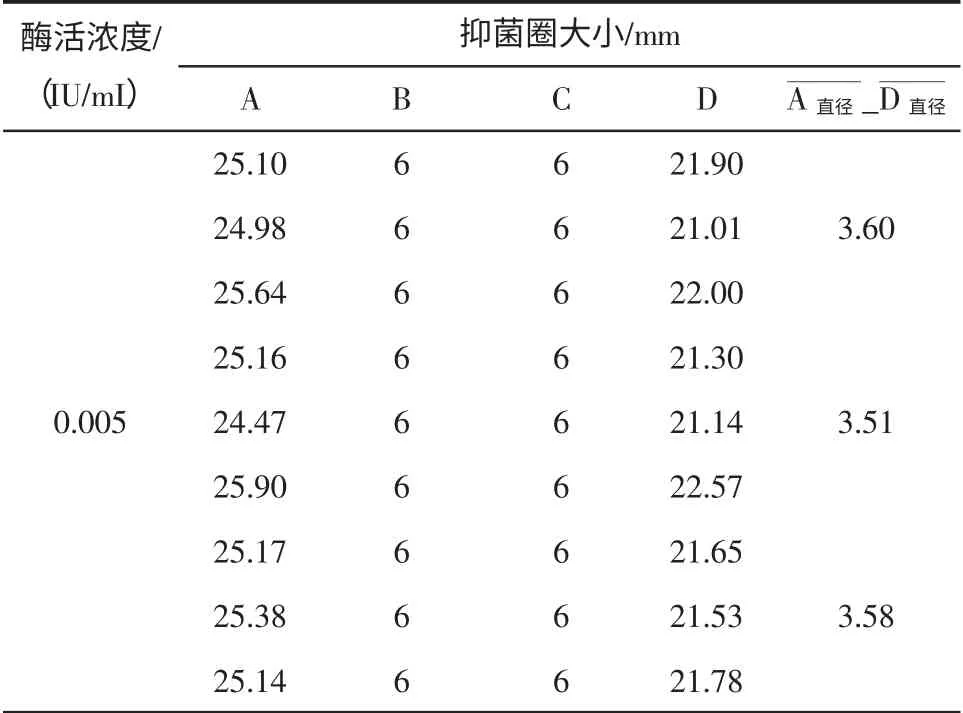
表8 β-内酰胺酶(0.005 IU/mL)检测准确度试验Table 8 The detection accuracy for β-lactamases(0.005 IU/mL,0.01 IU/mL)
由试验结果可知,0.005 IU/mL 3 组平行9 次测定结果重复性较好,方法准确性较高。
3.9 牛奶中β-内酰胺酶的温度稳定性试验
配含β-内酰胺酶0.005 IU/mL 的奶样,配好后分装到10 mL 离心管中,分别放在-18 ℃~-20 ℃、25 ℃和4 ℃下保藏,分别在1、2、4、8、12 和16 d 进行定性测定,考察不同温度下样品的稳定性,试验结果见表9。
由数据可以看出,在本试验所选的温度条件下(-18 ℃~-20 ℃;25 ℃;4 ℃),含0.005 IU/mL β-内酰胺酶的奶样,可以检出β-内酰胺酶,表明含有的β-内酰胺酶牛奶在-18 ℃、-20 ℃、25 ℃和4 ℃的保存条件下,β-内酰胺酶受温度的影响较小。从实验结果中可以看出随着保存时间的延长,酶活力逐渐下降,但在16 d时0.005 IU/mL 依然能检出。

表9 牛奶中β-内酰胺酶稳定性试验Table 9 The stability test of β-lactamase in milk
3 结论
通过杯碟法对液体乳和乳饮料中β-内酰胺酶进行检测,确定了杯碟法检测液体乳和乳饮料中β-内酰胺酶的各项参数。选择藤黄微球菌作为指示菌,菌悬液浓度要求达到1×109cfu/mL,上层培养基使用LB 营养琼脂,用量为5mL,青霉素G 的使用浓度为0.5 μg/mL,β-内酰胺酶对藤黄微球菌的生长没有影响,0.05 IU/mL的β-内酰胺酶可以将0.5 μg/mL 青霉素G 完全分解,舒巴坦的使用浓度为50 μg/mL。本方法中β-内酰胺酶的最低检测限为0.005 IU/mL;最佳培养时间为22 h~24 h,测定结果的重复性好,方法准确性高。温度试验证明牛奶中存在的β-内酰胺酶在-18 ℃~-20 ℃、25 ℃和4 ℃3 种温度条件下,酶活力变化没有明显的区别。但是无论在那种温度条件下,随着时间的延长,酶活力逐渐下降,0.005 IU/mL 的β-内酰胺酶在3 种温度条件下16 d 依然能检出酶活性。本方法的研究可用于监测和检测目前我国乳制品中使用β-内酰胺酶的情况,为乳制品检测提供技术支持,为国家标准的起草提供了基础的数据,可用于政府部门的监督检验,也可用于企业自检自查。
[1] Harry Brik.Development of a Method for the Detection of β-Lactamases in Milk Samples[J].AOAC,2007,10(1):514-557
[2] Koryck-dahl M,Richardson T,Bradley R.Use of microbial betalactamase to destroy penicillin added to milk[J].J Dairy Sci,1985,68(8):1910-1916
[3] Samaha-kfoury,Arajjngf. Recent developments in beta-lactamases and extended spectrum beta-lactamases[J].Bmj,2003,327(7425):1209-1213
[4] 郑卫.β-内酰胺酶及其抑制剂研究进展[J].国外医药(抗生素分册),2001,22(2):49-56
[5] 钟艺, 冯霞.产超广谱β-内酰胺酶大肠埃希菌的分离率与抗菌药物消耗量相关性研究[J].医药世界,2006,5(1):42-45
[6] 中华人民共和国国家进出口商品检验局.SN0539-1996 中国标准书号[S].北京:中国标准出版社,1996:10-11
