无花果多糖的部分理化性质研究
2012-01-28张秀丽杨小明何娟马海乐田婷孙乐六
张秀丽,杨小明,何娟,马海乐,田婷,孙乐六
(1.盐城工学院博雅学院,江苏盐城224051;2.江苏省生物资源加工与分离技术工程中心,江苏镇江212013;3.江苏大学化学化工学院,江苏镇江212013)
无花果(Ficus carica L.)又名“映日果”、“奶浆果”,其果实口味香甜,日常作为鲜果、果脯和果汁食用。中医认为无花果味甘、性凉,具有清肺热、止胃痛、通乳、润肠、消肿解毒等功效。无花果含有丰富的维生素、微量元素,是一种具有丰富营养和药用价值的水果。无花果的抗肿瘤作用已有广泛的研究,其抗肿瘤活性成分主要为苯甲醛、补骨脂素、香柠檬内酯等[1-2],此外戴伟娟等[3-5]报道无花果多糖(Ficus carica polysaccharides,FCPS)具有免疫活性,是一种免疫功能调节剂。王振斌等[6-8]对无花果多糖的提取条件进行了优化。吴亚林[9]对无花果粗多糖进行纯化后得到两个单一多糖,进行了红外、紫外光谱分析。但目前尚未见有关无花果多糖分子量分布、单糖组成的报道。作者在王振斌无花果多糖提取技术研究的基础上,重点考察了无花果多糖分离纯化中乙醇用量和脱蛋白方法对得率的影响,完善了无花果多糖的分离纯化工艺,得到精制无花果多糖,并对其理化性质、含量、分子量范围和单糖组成进行了研究,为无花果多糖的深入研究奠定基础。
1 材料与方法
1.1 材料与仪器
无花果渣(榨取无花果汁后的残渣):江苏丰县中研无花果责任有限公司提供;浓硫酸:上海国药提供;考马斯亮蓝、标准分子量葡聚糖(Dextran 系列):购自Sigma 公司;L-鼠李糖:北京化学试剂公司。
D-木糖:上海国药;D-甘露糖、D-葡萄糖、D-半乳糖:上海试剂二厂;D-阿拉伯糖Sigma 公司;无水Na2CO3、无水乙醇、碘、碘化钾、茚三酮、α-萘酚等:购自上海化学试剂公司。以上试剂皆为分析纯,试验用水为二次蒸馏水。
HH 恒温水浴锅:江苏中大仪器厂;GFB 高速万能粉碎机:北京长风仪器仪表厂;RE-52A 旋转蒸发仪:上海亚荣生化仪器厂;AvantiJ25 冷冻离心机:贝克曼公司;Pellicon 小型超滤系统:美国Millipore 公司;ALPHA2 -4 冷 冻 干 燥 机: 德 国 CHRIST 公 司;CARY100Conc 紫外可见分光系统,高效液相系统、ProStar210 泵、ProStar 355 RI 检测器:美国VARIAN 公司;日本TSK-GEL G4000PW(7.5×300 cm)凝胶柱、DZF-6020 型真空干燥器:上海益恒实验仪器有限公司;NEXUS670 傅立叶红外分光光度计:Nicolet 公司;气相色谱HP5890、色谱柱HP-INNOWAX 19091N-133:美国HP 公司。
1.2 方法
1.2.1 无花果多糖的分离
1.2.1.1 提取
按王振斌[6]方法提取。50 g 干燥无花果渣粉(20 目筛网粉碎)加入500 mL 石油醚(沸程60 ℃~90 ℃)脱脂三次,待溶剂挥发后加入12 倍量蒸馏水,100 ℃,180 min 提取两次,过滤,合并滤液。
1.2.1.2 Sevag 法脱除蛋白
滤液浓缩至原体积的1/4 后,加入Sevag 试剂(提取液∶氯仿∶正丁醇=25 ∶4 ∶1),振摇均匀后静置分层,除去水相与有机相交界处的灰白色变性蛋白质,水相继续加入Sevag 试剂,重复多次。取水相分别测定蛋白和多糖含量,计算蛋白脱除率和多糖保留率。
1.2.1.3 乙醇沉淀
脱蛋白后的提取液在搅拌下慢慢加入一定体积的无水乙醇,使乙醇终浓度分别为30%、45%、60%、75%和90%(体积比),于4℃静置12 h,离心(3000 r/min,20 min)分离,收集沉淀,即得无花果粗多糖,计算得率。考察乙醇用量对粗多糖得率的影响。
1.2.2 无花果多糖的精制
无花果粗多糖加水溶解,用截留分子量为10KD的平面纤维素超滤膜超滤(ΔP=0.1 MPa,T=25 ℃),收集分子量大于10 KDa 部分,在60 ℃以下浓缩至原体积的1/4,搅拌下慢慢加入无水乙醇至75%浓度,4 ℃静置12 h,离心(3 000 r/min,20 min)分离,沉淀以无水乙醇、丙酮洗涤,冷冻干燥,得精制无花果多糖。计算得率。
1.2.3 无花果多糖及蛋白含量的测定
总糖含量测定采用苯酚-硫酸法[10],以葡萄糖为标准单糖,苯酚-硫酸显色后,测定A490 nm,得标准曲线为A=0.808C-0.012,R=0.9991。
蛋白含量测定采用考马斯亮蓝法[8],以牛血清白蛋白为标准蛋白,考马斯亮蓝G250 显色后,测定A595 nm,得标准曲线为A=5.779 9C+0.010 2,R =0.999 4。式中:A 为吸光度;C 为糖/蛋白浓度,(mg/mL)。
1.2.4 无花果多糖的化学性质验证
1.2.4.1 外观及溶解性
观察精制无花果多糖的形状、颜色,并将其溶于水、乙醇、丙酮和乙醚,观察其溶解性。
1.2.4.2 碘-碘化钾反应
取1%无花果多糖1 mL,加入碘-碘化钾溶液,观察颜色变化。
1.2.4.3 Molish 试剂反应
取1%无花果无花果多糖1 mL 加入试管,滴家α-萘酚试剂,混匀后,倾斜试管,沿管壁慢慢加入浓硫酸1 mL,竖直试管观察浓硫酸与糖交界面颜色变化。
1.2.4.4 茚三酮反应
取1%无花果多糖1 mL,加入0.5 mL 0.1%茚三酮乙醇溶液,混匀煮沸2 min,冷却后观察颜色变化。
1.2.4.5 紫外光谱检测
将1 %的FCPS 稀释一定倍数后,在190 nm~400 nm 范围扫描。
1.2.4.6 红外光谱检测
取5 mg FCPS 冻干样品,KBr 压片后,在400 cm-1~40 000 cm-1中红外区扫描。
1.2.4.7 分子量范围测定
将Dextran T-10、T-40、T-70 、T-500、T-2000 以水溶解后,进样于高效液相色谱(柱温30 ℃,检测器35 ℃,流动相为娃哈哈纯净水,流速0.5 mL/min),精制无花果多糖用0.2 M NaCl 溶液配成0.5%的浓度,在相同条件下分析,推算无花果多糖的相对分子量。
1.2.5 无花果多糖单糖组成分析
1.2.5.1 样品处理
准确称取精制无花果多糖10.8 mg,加入3 mL 2 mol/L 三氟乙酸,封口后于100 ℃水解8 h,水解液于40 ℃~50 ℃真空蒸干,加入10.9 mg 盐酸羟胺、6.8 mg内标,0.5 mL 吡啶,封口后于90 ℃水浴30 min,冷却后再加入0.5 mL 乙酸酐90 ℃水浴30 min,取1.0 μL 进样进行GC 分析。
1.2.5.2 标准单糖处理
准确称取鼠李糖(Rha)9.5 mg, 阿拉伯糖(Ara)9.5 mg,木糖(Xyl)11.5 mg,半乳糖(Gal)9.7 mg,甘露糖(Man)10.0 mg,葡萄糖(Glu)10.6 mg,内标8.2 mg,加入盐酸羟胺60.9 mg, 吡啶3 mL,封口后90 ℃水浴30 min,冷却后再加入乙酸酐3 mL 同样处理。
1.2.5.3 GC 分析条件
炉温210 ℃,进样口250 ℃,FID 检测器温度250 ℃;载气为氮气;载气流速0.82 mmL/min,总流量为34 mL/min;分流比40 ∶1。
由对照单糖标准品保留时间确定单糖种类,根据各标准单糖质量和峰面积计算换算因子,推算出无花果多糖中各单糖相对含量。
2 结果与讨论
2.1 无花果多糖提取液中蛋白的脱除
Sevag 法脱蛋白效果见图1。

图1 Sevag 法脱蛋白的效果及对多糖得率的影响Fig.1 The effects of Sevag method on protein eliminated rate and polysaccharides retainment
随着脱除次数的增加,蛋白脱除率逐渐上升,但多糖保留率却逐渐下降。蛋白的脱除是以损失多糖为代价,因此本试验中选择脱蛋白6 次。
2.2 乙醇加入量对多糖得率的影响
乙醇加入量对多糖得率的影响见图2。
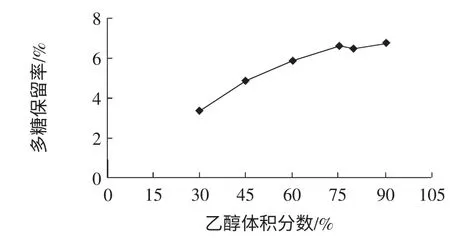
图2 乙醇体积分数对无花果多糖得率的影响Fig.2 The effects of ethnol volume fraction on polysaccharides yield rate
试验结果表明,多糖得率随着乙醇浓度的上升有明显的增加趋势,到75%以上明显缓慢。这与多糖分子量大小有关,大分子量多糖溶解性较差,在低浓度的乙醇中既可沉淀,而小分子多糖则要较高浓度下才能沉淀,部分单糖与寡糖不会沉淀。在试验中,选择75%的乙醇体积分数进行无花果多糖的沉淀。
由上述试验结果,无花果多糖分离纯化的工艺流程为:

2.3 无花果多糖表观性状
经过脱蛋白、脱除小分子杂质后的无花果多糖为浅灰色疏松状粉末,无味,易溶于水,其水溶液pH4.2,难溶于甲醇、乙醇、丙酮、乙醚等有机溶剂。
碘-碘化钾试验为阴性,Molish 反应为阳性,茚三酮反应为阴性。
2.4 无花果多糖得率及总糖含量
精制无花果多糖的得率4.1%,按苯酚-硫酸法测得总糖含量为91%。
2.5 紫外检测
紫外扫描图谱如图3 显示。

无花果多糖在192 nm 有明显的吸收峰,表现为糖的特征吸收,260 nm、280 nm 处没有蛋白质、核酸的特征吸收。
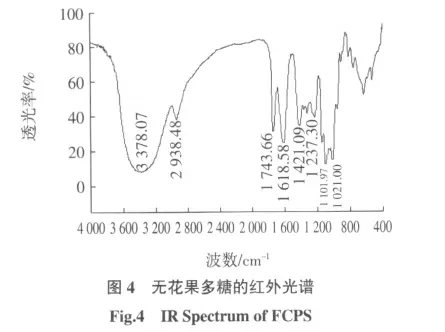
2.6 红外光谱
图4 显示无花果多糖具有典型的多糖特征吸收峰(3 378、2 938、1 743、1 618、1 421 cm-1)。表现为378 cm-1处的O-H 伸缩振动,2 938、1 421 cm-1的C-H伸缩振动与变角振动;1 250~950 cm-1之间存在的吸收峰,提示糖链构型为吡喃型。
2.7 分子量测定
标准分子量葡聚糖与保留时间的回归方程为:Log Wt=9.618 8-0.324 6 Tr,R=0.994 7. 无花果多糖的分子量分布范围在5.92×105~1.95×106之间。
2.8 单糖组成分析
无花果多糖水解液的GC 谱图见图5。
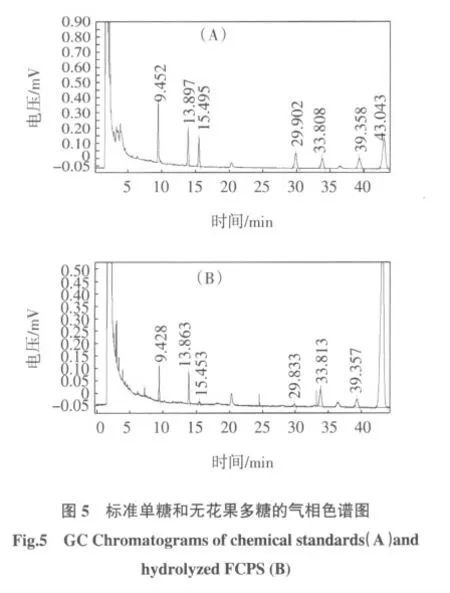
其中图5A 为单糖标准品,按出峰时间先后顺序分别为Rha、Ara、Xyl、Man、Glu、Gal 和内标。测定结果表明,水解液出峰的保留时分别与Rha、Ara、Xyl、Man、Glu 和Gal 准确对应,说明无花果多糖中含有这6 种单糖,其摩尔质量比值为1.93 ∶3.86 ∶0.46 ∶0.55 ∶7.42 ∶2.87。
3 结论
(1)三氯乙酸法脱蛋白常会引起多糖的降解,且制备的多糖复溶性差。故本试验采用Sevag 法,避免了多糖的降解,制备的多糖复溶性好。采用Sevag 法脱蛋白6 次,多糖保有率为70.2%。
(2)无花果多糖为浅灰色粉末,化学性质验证为非淀粉多糖,紫外扫描说明不含蛋白质、核酸和氨基酸,得率为4.1%,总糖含量为91%。
(3)本试验采用高效凝胶色谱测定出无花果多糖的分子量分布范围在5.92×105~1.95×106之间。
(4)采用GC 法对无花果多糖进行了单糖鉴定,是由鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖组成,其摩尔质量比值为1.93 ∶3.86 ∶0.46 ∶0.55 ∶7.42 ∶2.87。
[1] Setsuo T,Kimura H,Yonemawa Y,et al.Benzaldehyde as a carcinostatic principle in Fig[J].Agric Biol Chem,1978,42(7):1449-1451
[2] 尹卫平,陈宏明,王天欣.从无花果中提取新的皂甙和糖甙化合物及其活性研究[J].中草药,1998,29(8):505-507
[3] 戴伟娟,司端运,辛勤.无花果多糖对小鼠细胞免疫功能的影响[J].中草药,2000,31(5):355-356
[4] 戴伟娟,司端运,仲传法.无花果多糖对小鼠单核吞噬细胞吞噬功能影响的研究[J].中医药学刊,2002,20(1):98-99
[5] 王力男,王勤,苗明三.无花果多糖对环磷酰胺致免疫抑制小鼠免疫功能的影响[J].中医学报,2010,25(149):676-678
[6] 王振斌,马海乐,王超.无花果多糖提取技术研究[J].食品科学,2006,27(2):174-177
[7] 余希成,卢俊,曹为民.水溶性无花果多糖的微波提取技术[J].食品研究与开发,2009,9(30):19-23
[8] 陈运江.大孔径树脂分离纯化无花果多糖工艺研究[J].江苏农业科学,2010(2):320-321
[9] 吴亚林,黄静,潘远江.无花果多糖的分离、纯化和鉴定[J].浙江大学学报:理学版,2004,31(2):177-187
[10] 张罹杰.糖复合物生化研究技术[M].2 版.浙江: 浙江大学出版社,1992
