维药材小豆蔻提取物的体外抑菌实验研究
2012-01-28王春霞田莉田树革吴玲玲
王春霞,田莉,田树革,吴玲玲
(1.兰州军区乌鲁木齐药品器材供应站,新疆乌鲁木齐830002;2.新疆名医名方与特色方剂学重点实验室,新疆乌鲁木齐830011;3.新疆医科大学中医学院,新疆乌鲁木齐830011)
小 豆 蔻 (Elettaria cardamomum) 是 姜 科(Zingiberaceae)植物小豆蔻(Elettaria cardamomum(L.)Maton)的干燥成熟果实,是新疆维吾尔医常用药材,在《维吾尔医常用药材》(维吾尔文)中记载小豆蔻的维吾尔语名称为Kqiklaqindane(克其克拉秦达乃)[1]。小豆蔻主产于斯里兰卡、印尼、印度南部海岸,夏、秋季果实成熟时采收,晾干,我国不出产,主要由巴基斯坦和印度进口新疆。小豆蔻气芳香而浓烈,味辣、微苦,含3%~8%的挥发油,油中含松油醇-4α-松油醇、乙酸松油醇酯、桉油精等,是一种常见调料[2]。小豆蔻收载于《中华人民共和国卫生部标准》(维吾尔药分册),认为其二级干热,具有健胃助食,止泻止呕,爽神悦志的功能,维医临床用于治疗腹痛胃胀,食少嗳气,呕恶口臭,腹泻反胃,口舌生疮,偏头痛等症[3]。
在维吾尔民间多有使用小豆蔻治疗腹泻反胃、口舌生疮,但对其抑菌研究的相关报道少见。本文采用微孔板法、连续稀释法和吸收度法进行了其体外抑菌实验的初步研究。
1 材料和仪器
1.1 材料
小豆蔻,2010年9月购于新疆维吾尔自治区维吾尔医院,经新疆医科大学中医学院乌莉娅·沙衣提教授鉴定为姜科植物小豆蔻(Elettaria cardamomum(L.)Maton)的干燥成熟果实。
1.2 供试菌种和试剂
大肠杆菌(Escherichia coli,ATCC 35218)、变异链球菌(streptococcus mutans,ATCC 700610):均购自中国药品生物制品检定所。
脑心浸液培养基(Brain Heart Infusion Broth,BHI)、营养肉汤培养基(Nutrient Broth,NB):均购自美国BD 公司;结晶紫:上海研晶生物科技有限公司;去氧胆酸钠(Sodium deoxycholate,SD,Sigma-Aldrich 公司);其余试剂均为分析纯。实验用水为蒸馏水。
1.3 主要仪器
SPECTRAMAX 190 酶标仪:美国Molecu1ar Devices 公司;YJ-875A 医用净化工作台:苏州金燕净化设备厂;DNP-9162 型电热恒温培养箱:上海精宏实验设备有限公司;3110 系列CO2培养箱:美国赛默飞世尔科技公司;YXQ-LS-SI 全自动立式电热压力蒸汽灭菌器:上海博迅实业医疗设备厂;RE-52A 旋转蒸发仪:上海亚荣生化仪器厂。
2 方法
2.1 小豆蔻提取物的制备
精确称取干燥小豆蔻粗粉200 g,用石油醚1.5 L回流提取1.5 h 后,滤过,滤渣依次用氯仿、乙酸乙酯、正丁醇、乙醇和水1.5 L 回流提取2 h 后滤过,均重复提取3 次,滤液分别置于旋转蒸发仪中浓缩减压后得稠浸膏,再经冷冻干燥制成粉末,密封冷藏保存。
2.2 抑菌试验
2.2.1 菌种复苏与培养
将变异链球菌、大肠杆菌标准菌种分别置于装有2 mL BHI 培养基、NB 培养基的有盖试管中,置于37 ℃5%CO2培养箱内培养16 h 后,经比浊法判断试管变浑浊,说明菌种已复苏。
把灭过菌的培养皿和培养基倒平板,冷却凝固后,用接种针挑取少许待复苏后的标准菌种进行划线接种,37 ℃恒温培养箱中培养24 h 后,再进行活化,使这些菌种有较强的活力[4]。
经复苏转种培养后,分别取新传代变异链球菌、大肠杆菌置于已灭菌的装有2 mL 培养基的有盖试管中,加入适量40%葡萄糖,置于37 ℃5%CO2培养箱内培养24 h 后,培养液用肉汤培养基稀释,充分震荡后并用经麦氏比浊管法调整菌液浓度为109CFU/mL。
2.2.2 微孔板法筛选抑菌活性
采用96 孔微孔板进行抑菌活性的快速筛选[5]。分别取变异链球菌、大肠杆菌悬液用培养液50 倍稀释,混匀。把维药材小豆蔻的不同极性提取物溶解在适宜溶剂中制成2 mg/mL 的溶液,经微孔滤膜除菌后,在96 孔板上分别用肉汤培养基与大肠杆菌、变异链球菌作连续对倍稀释,使含药浓度分别为1 000、500、250、125、62.5 μg/mL。相同条件下,以纯二甲基亚砜作溶剂对照,仅含菌液做空白对照,以阿莫西林作为阳性对照,同一板重复4 次,共置于37 ℃5%CO2培养箱内培养18 h,以培养液透明为无菌生长的最低抑菌浓度(MIC 值)。
2.2.3 抑菌效果的测定
用酶标仪于450 nm 波长处测定细菌的OD(Optical Density)值,将96 孔板用蒸馏水清洗数遍,再用1%结晶紫染色15 min,用蒸馏水冲洗至透明后,加入2%的SD 洗脱生物膜,再用酶标仪于605 nm 波长处测试生物膜的OD 值。抑菌率的计算方法如下:

3 结果与分析
3.1 小豆蔻不同极性提取物对变异链球菌的抑菌率
采用微孔板对倍稀释法测定小豆蔻不同极性的5种提取物对变异链球菌生长及其生物膜形成的抑制率,结果如表1,表2。
由表1,表2 可知,小豆蔻的氯仿、乙酸乙酯提取物在低于250 μg/mL 时对变异链球菌的生长有部分的抑制作用;正丁醇、乙醇提取物对变异链球菌的生长及其生物膜形成有不同程度的抑制作用;水提取物对变异链球菌的生长无抑制作用,但对其生物膜的形成有部分的抑制作用,当浓度为1 mg/mL 时,抑制率为58.74%。

表1 小豆蔻不同极性提取物对变异链球菌生长的抑制率(n=4)Table 1 The different extract fractions of Elettaria cardamomum inhibit the growth rate of Streptococcus mutans inhibition(Mean±SD,n=4)

表2 小豆蔻不同极性提取物对变异链球菌生物膜形成的抑制率(n=4)Table 2 The different extract fractions of Elettaria cardamomum inhibit biofilm formation of Streptococcus mutans inhibition(Mean±SD,n=4)
3.2 小豆蔻不同极性提取物对大肠杆菌的抑菌率
采用微孔板对倍稀释法测定小豆蔻不同极性的5种提取物对大肠杆菌生长及其生物膜形成的抑制率,结果如表3,表4。
由表3、表4 可知,5 种不同极性的提取物对大肠杆菌生长均无抑制作用,但对大肠杆菌生物膜形成均有不同程度的抑制作用,其中,氯仿、乙酸乙酯和正丁醇提取物抑制大肠杆菌生物膜形成的作用很强,氯仿提取物在1 000 μg/mL~62.5 μg/mL 浓度范围,抑制率均大于90%,其次为乙酸乙酯,浓度为62.5 μg/mL 时抑制率为68.54%,正丁醇提取物浓度为125 μg/mL 时的抑制率为49.54%。
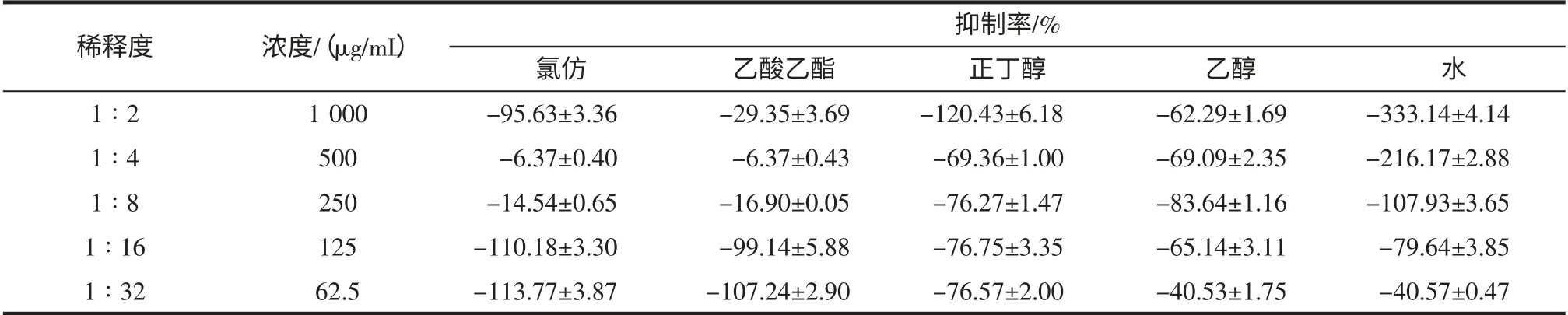
表3 小豆蔻不同极性提取物对大肠杆菌生长的抑制率(n=4)Table 3 The different extract fractions of Elettaria cardamomum inhibit the growth rate of Escherichia coli inhibition(Mean±SD,n=4)
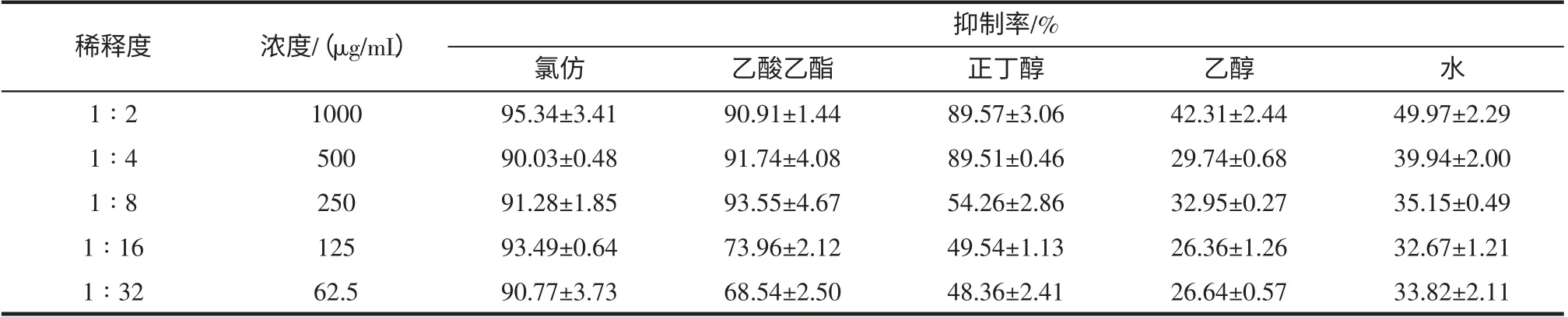
表4 小豆蔻不同极性提取物对大肠杆菌生物膜形成的抑制率(n=4)Table 4 The different extract fractions of Elettaria cardamomum inhibit biofilm formation of Escherichia coli inhibition(Mean±SD,n=4)
3.3 不同提取物对受试菌的MIC50
依据MIC50的判断标准,小豆蔻水提取物抑制变异链球菌生物膜形成的MIC50为1 mg/mL;氯仿、乙酸乙酯提取物抑制大肠杆菌生物膜形成的MIC50均小于62.5 μg/mL,正丁醇提取物的MIC50为125 μg/mL,水提取物的MIC50为1 mg/mL。
结果表明,小豆蔻正丁醇、乙醇和水提取物对变异链球菌的生物膜形成有一定抑制作用;氯仿、乙酸乙酯、正丁醇提取物中含有能有效抑制大肠杆菌生物膜形成的活性成分。
4 讨论
细菌生物膜(Biofilm)是细菌的一种保护性生长模式,是细菌被包裹在自身分泌的多聚物中形成具高度分化结构的特殊细胞群体结构,能不断地释放浮游细菌引起持续性感染,对抗生素和宿主免疫防御机制的抗性很强,80%的细菌性感染与其有关[6-7],主要有由革兰阳性球菌导致的龋齿,革兰阴性厌氧性口腔细菌导致的牙菌斑,肠道细菌引起的胆囊感染,以及大肠杆菌和其他革兰阴性菌引起细菌性前列腺炎等[8],从天然产物中筛选抑制细菌生物膜形成的活性成分已成为药物的研发热点。
经化学鉴别预试验检出小豆蔻中含生物碱,糖和苷类,有机酸,氨基酸,蛋白质、酚类鞣质和油脂类等成分。抑菌筛选时发现,小豆蔻提取物对大肠杆菌没有抑菌作用,反而有促进细菌生长的的趋势,可能其所含糖类、蛋白质、氨基酸等成分为细菌生长提供了营养成分。小豆蔻不同极性提取物所含化学成分的类别和含量不同,使其抑菌活性不同,而同一提取物对不同菌种的抑制敏感性也存在差异。本方法可为小豆蔻的药用开发提供实验依据,对小豆蔻抑菌成分、机理及对其他细菌的影响还有待进一步研究。
[1] 黄辉,张彦福.维吾尔药小豆蔻名实考辩[J].中国民族民间医药杂志,1998(6):29-32
[2] 马新玉,潘苇芩.小豆蔻的显微鉴别研究[J].新疆中医药,2005,23(2):48
[3] 中华人民共和国卫生部药典委员会.中华人民共和国卫生部药品标准(维吾尔药分册)[M].乌鲁木齐:新疆科技卫生出版社,1999
[4] 李悦,侯滨滨,静宝元.葡萄柚精油抑菌活性的研究[J].食品研究与开发,2010,31(11):237-240
[5] Ramage G,Vande-Walle K,Wickes B L,et al.Standardized method for in vitro antifungal susceptibility testing of Candida albicans biofilm[J].Antimicrob Agents Chemother,2001,45(9):2475-2479
[6] Vilchez R,Lemme A,Thiel V et al.Analysing traces of autoinducer-2 requires standardization of the Vibrio harveyi bioassay[J].Anal Bioanal Chem,2007,387(2):489-96
[7] 屈常林,高洪,赵宝洪,等.细菌生物被膜与抗生素耐药机制研究进展[J].动物医学进展,2008,29(3):86-90
[8] Stewat P S,Costerton J W.Antiblotic resistance of bacteria in bioilms[J].Lancet,2001,358(9276):135-138
