卵巢上皮癌中HER-2、TOPO-Ⅱα和PI3K的表达及临床意义
2012-01-20尚素霜程佳张静任月环张利玲于华霍艳
尚素霜 程佳 张静 任月环 张利玲 于华 霍艳
卵巢癌是病死率最高的妇科恶性肿瘤,目前其发病机制仍不清楚。由于卵巢的解剖位置隐蔽,卵巢癌具有发现晚、转移早等特点。所以如何控制卵巢癌的血管生成和转移就成为治疗卵巢癌、提高患者生存率的关键。目前晚期卵巢癌患者施行理想的肿瘤细胞减灭术较为困难,因此化疗对于卵巢癌治疗的成败具有决定性作用。但因为获得性耐药约占70%~80%,肿瘤细胞对化疗药物(尤其是铂类)产生耐药性是导致卵巢癌综合治疗失败的关键因素。目前对卵巢癌耐药机制研究的焦点已逐渐集中到细胞内的信号转导通路,本实验应用免疫组化技术检测58例卵巢上皮癌中人类表皮生长因子受体2(HER-2)、拓扑异构酶Ⅱ(Topo-Ⅱα)和磷脂酰肌醇3激酶(PI3K)组织中的表达、相互关系及临床意义,为卵巢癌有效治疗提供理论基础。
1 材料与方法
1.1 标本 选择2008年10月至2009年12月我院住院患者手术标本存档的88份蜡块,其中正常卵巢组织10份(对照组),卵巢良性上皮肿瘤组织20份(良性组),卵巢上皮癌组织58份(卵巢癌组)。对照组患者年龄30~58岁,中位年龄44岁;良性组患者年龄18~50岁,中位年龄37岁;卵巢癌组患者年龄35~73岁,中位年龄56岁。3组年龄比较差异无统计学意义(P>0.05)。卵巢癌组病理分级:高、中分化33例,低分化25例;手术病理分期按国际妇产科联盟(FIGO,1988年)的标准:Ⅰ、Ⅱ期22例,Ⅲ、Ⅳ期36例;浆液性42例,黏液性16例。所有患者均为初发,术前均未接受过放、化疗。
1.2 主要实验试剂 鼠抗人HER-2单克隆抗体(工作浓度1∶50),鼠抗人TOPO-Ⅱα单克隆抗体(工作浓度1∶50),均购自Santa Cruz公司。兔抗人PI3K单克隆抗体由武汉博士德生物工程有限公司提供。过氧化物酶标记的链霉卵白素标记盒(SP)试剂盒、DAB显色剂等均购自北京中衫金桥生物技术有限公司。
1.3 免疫组化染色方法及结果判定 采用免疫组化链霉菌抗生物素蛋白-过氧化物酶连接(SP)法对HER-2、TOPO-Ⅱα和PI3K的表达进行检测。每批染色均设阴性和阳性对照。阴性对照采用磷酸盐缓冲液(PBS)代替一抗,阳性对照取已知HER-2、TOPO-Ⅱα和PI3K表达阳性的乳腺癌组织的石蜡切片。本实验染色判断标准:(1)根据阳性细胞的比例计分:光学显微镜下随机选取5个视野,每个视野计数100个细胞,阳性细胞比例计算方法为阳性细胞数占总细胞数的百分比,取其平均值。①1分:阳性细胞比例≤10%;②2分:阳性细胞比例为10% ~50%;③3分:阳性细胞比例为50% ~75%;④4分:阳性细胞比例≥75%。(2)根据阳性细胞染色强度计分:0分:细胞无显色;1分:浅黄色;2分:棕黄色;3分:黄褐色。阳性细胞比例与细胞染色强度积分的乘积为每例标本的最终积分,范围为0~12分,其中0分为(-),1~4分(﹢),5~8分为(﹢﹢),9~12分为(﹢﹢﹢)。阳性表达率的计算方法为阳性表达细胞数/总细胞数×100%。
1.4 统计学分析 应用SPSS 13.0统计软件,HER-2、TOPO-Ⅱα和PI3K的表达与临床病理指标间的关系分别采用χ2检验、Spearman等级相关检验,P<0.05为差异有统计学意义。
2 结果
2.1 3组卵巢组织中HER-2、TOPO-Ⅱα和PI3K的表达 卵巢上皮癌组织中HER-2、TOPO-Ⅱα和PI3K阳性表达率显著高于卵巢正常组织和良性组织(P<0.05),卵巢良性组织与正常组织间差异无统计学意义(P>0.05)。见表1。
2.2 HER-2、TOPO-Ⅱα和PI3K的表达与卵巢上皮癌手术病理分期、组织学分级有关(P<0.05),而与年龄、病理类型无关(P >0.05)。见表2。
2.3 HER-2、TOPO-Ⅱα和PI3K在卵巢上皮癌中表达的相关性 HER-2和TOPO-Ⅱα蛋白阳性表达之间呈正相关(rs=0.455,P=0.000);HER-2和PI3K蛋白阳性表达之间呈正相关(rs=0.285,P=0.285);TOPO-Ⅱα 和 PI3K 蛋白阳性表达之间呈正相关(rs=0.311,P=0.017)。见表3。
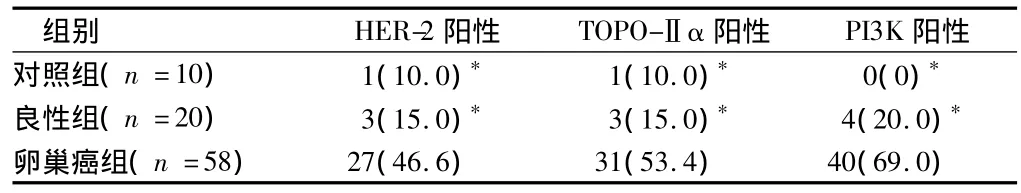
表1 卵巢组织中HER-2、TOPO-Ⅱα和PI3K的表达 例(%)
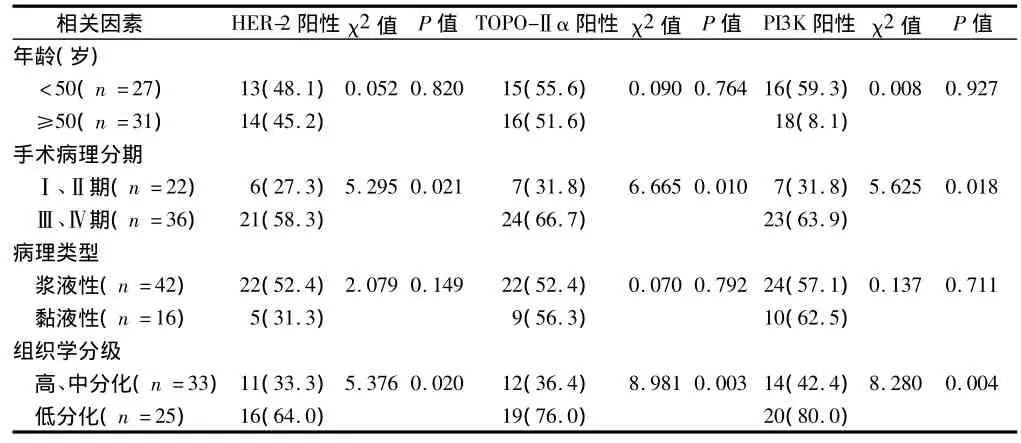
表2 卵巢组织中HER-2、TOPO-Ⅱα和PI3K表达的相关因素 例(%)
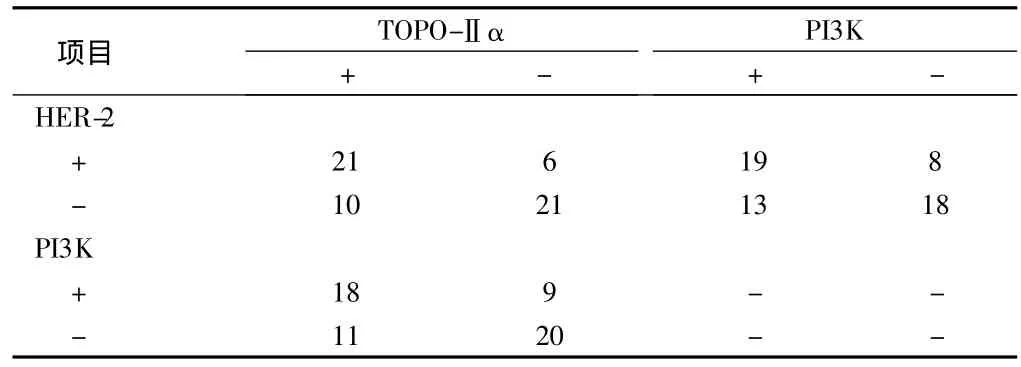
表3 卵巢组织中HER-2、TOPO-Ⅱα和PI3K表达的相关性 例
3 讨论
原癌基因与细胞的正常生命活动密切相关,发生突变后导致细胞增殖、分化平衡的失调。癌基因活化、抑癌基因缺失在细胞恶性转化中起主导作用。表皮生长因子受体(epidermal growth factor receptor,EGFR)是Ⅰ型跨膜酪氨酸激酶生长因子受体,定位于细胞膜,编码分子量170kD的跨膜糖蛋白,广泛分布于哺乳动物除血管外的上皮细胞膜上[1]。EGFR家族还包括 c-erbB-2、c-erbB-3 和 c-erbB-4[2]。C-erbB2 是人类肿瘤常发生改变的一个癌基因,HER-2在细胞信号转导中占重要地位,可启动细胞内强大的信号转导网络,引发一连串“瀑布”式反应,影响肿瘤细胞的生长、分化、转移和黏附。大量研究表明,HER-2在许多肿瘤如乳腺癌、卵巢癌、肺癌和胃癌等中扩增或者过表达。Trastuzumab-C-erbB2人源化单克隆抗体已成功用于治疗C-erbB2过度表达的晚期乳腺癌患者。人源性抗HER-2单克隆抗体Herceptin(赫赛汀),可与HER-2的胞外位点相结合,抑制HER-2过表达的肿瘤细胞生长。目前,Herceptin联合紫杉醇及其他药物治疗卵巢癌的实验仍在进行中。PIK3A 43.2%,p-AKT 51.6%。结果表明,HER-1、HER-2 在卵巢癌的发生发展过程中起一定的作用并可作为该疾病预后的特异性指标。因此HER-2不但可作为反映恶性肿瘤恶性生物学特性的指标,而且为治疗肿瘤提出了新的理念及可能的相关治疗方法。
本研究结果显示:HER-2在卵巢上皮癌的阳性表达率为46.6%,而在正常卵巢组织及良性卵巢上皮肿瘤的表达率较低,恶性组与良性组及对照组比较,差异有统计学意义(P<0.05),而良性组与对照组之间比较差异无统计学意义 (P>0.05),提示HER-2在卵巢上皮癌的发生发展过程中起重要作用;临床期别越晚,HER-2蛋白表达率也越高,Ⅰ、Ⅱ期与Ⅲ、Ⅳ期的阳性表达率分别为27.3%、58.3%,2组间比较差异有统计学意义(P<0.05),表明HER-2的表达与临床分期有关;研究显示肿瘤分化程度越差,HER-2的阳性表达率也越高,表明HER-2的表达与组织学分级有关(P<0.05);对不同年龄阶段及不同组织学类型HER-2的表达情况进行分析后结果表明HER-2的表达与年龄和组织学类型无关。
TOPO-Ⅱ又称旋转酶(gyrase),有两个α亚基和两个β亚基。α亚基具有磷酸二酯酶活性,β亚基具有DNA依赖的ATP酶活性。TOPO-Ⅱα是DNA复制的重要核酶,与恶性肿瘤的增生及化疗耐药密切相关。研究表明,在多种恶性肿瘤中Topo II α的表达水平增高是一个普遍现象,而且临床方面已逐渐将TOPO-Ⅱα作为一个标志,以判断细胞或肿瘤的增殖程度[3,4]。Falck等[5]研究TOPO-Ⅱα等基因在卵巢浆液性肿瘤中的表达情况,免疫组化方法显示41例浆液性卵巢癌组织TOPO-Ⅱα的阳性率在30.2% ~59.7%,卡方检验显示TOPO-Ⅱα与临床分期(P=0.0034),组织分化程度(P=0.0076)及预后(P=0.0011)均有关。
TOPO-Ⅱ抑制剂是一类以TOPO-Ⅱ为靶点的抗肿瘤药物,以拓扑异构酶为靶点,选择性抑制增殖期DNA复制细胞,集中杀伤肿瘤细胞。Topo-Ⅱα表达降低使肿瘤细胞对多种抗癌药产生耐药,Topo-Ⅱα含量的高低,可以作为判定各种肿瘤对抗癌药物的敏感性或抗药性的指标。
本实验结果显示:TOPO-Ⅱα在卵巢上皮癌的阳性表达率为53.4%,而在良性卵巢组织及正常卵巢组织的表达率较低,与良性组、对照组比较差异有统计学意义(P<0.05)。而良性组与对照组比较差异无统计学意义,反映了TOPO-Ⅱα与肿瘤细胞的增殖程度有关。研究结果还显示,TOPO-Ⅱα的表达与组织分化和临床分期显著相关,在高分化,中低分化卵巢上皮癌组织中TOPO-Ⅱα的阳性表达率分别为36.4%、76.0%,差异有统计学意义(P <0.05),TOPO-Ⅱα在临床分期Ⅰ、Ⅱ期和Ⅲ、Ⅳ期的阳性表达率分别为31.8%、66.7%,差异有统计学意义(P<0.05)。这说明肿瘤细胞的分化越差,临床分期越晚,TOPO-Ⅱα的阳性表达率越高,提示肿瘤的的预后不良并表明肿瘤细胞的增殖程度很高。TOPO-Ⅱα在卵巢上皮癌组织中的表达与年龄和组织类型无关。
PI3K是二聚体,主要由一个催化亚基p110和一个调节亚基p85组成。它是生长因子受体超家族信号转导途径中的一个关键分子,在促进细胞生长、抑制细胞凋亡、维持细胞生存等机制中具有重要作用[6]。PI3K/Akt是与细胞增殖和细胞凋亡关系最密切的信号传导通路之一[7]。IA型PI3K是酪氨酸激酶受体(如HER2)传递信号的重要转导子[8]。细胞膜HER2受生长因子等刺激后,细胞内PI3K活化,进而磷酸化其底物PIP2使其转化为 PIP3[9]。Akt(蛋白激酶 B,PKB)和 PIP3结合,前者的Thr308和Ser474位点因磷酸化而被激活[10],活化的Akt可能进一步激活其下游分子mTOR等[11]。Ning等[12]在所培养的人卵巢癌细胞系OVCAR-3和 A2780/CP70中加入PI3K抑制剂LY294002,可抑制卵巢癌细胞增殖,并引起细胞周期停滞。有研究发现,顺铂可以下调卵巢癌细胞株中的AKT磷酸化和活性,PI3K活性抑制剂可以明显提高顺铂对耐药细胞株诱导的细胞毒性和凋亡效应,提示耐药株对顺铂的化疗抵抗至少一定程度上是源于PI3K/AKT信号转导途径的激活[9]。
本研究显示PI3K蛋白在正常卵巢组织细胞和卵巢良性肿瘤组织中呈现不表达或弱表达,而在卵巢癌细胞中表达较强,且主要定位于胞核中。卵巢癌分化越差PI3K蛋白表达强度越强(P<0.05);临床分期越晚,PI3K阳性表达率也越高(P<0.05)。提示PI3K在卵巢癌发生发展过程中起重要作用。
HER-2/neu能够发生自身激活,通过PI3K/Akt通路,导致恶性肿瘤的发生。TOPO-Ⅱα基因与HER-2基因均定位于染色体17q12-q21,C-erbB-2表达增高还可激活Ras-MAPK或PI3-K等信号传导因子,促进增殖,间接促进TOPO-Ⅱα表达增加。研究发现,Akt的磷酸化水平从正常乳腺上皮组织、不典型增生到恶性转化,再到肿瘤侵袭转移渐次增加,且与HER2的过表达呈正相关。已经发现在卵巢癌细胞中PI3K催化亚单位(P110)的扩增和AKT的变异。在不同类型的肿瘤中发现此信号通路的失调控表达,系列研究表明PI3K/AKT信号转导途径是卵巢癌细胞对顺铂敏感性的关键调控因素。HER-2,TOPO-Ⅱα,PI3K在多种恶性肿瘤如卵巢癌、乳腺癌、胃癌等均有共同的过度表达并且具有相关性,提示在卵巢癌的发生发展及化疗耐药过程中可能起协同作用,并为治疗卵巢癌提供新的理念。
本研究结果显示卵巢上皮癌中HER-2分别与TOPO-Ⅱα、PI3K的表达之间均呈正相关(P <0.05),TOPO-Ⅱα与PI3K的表达呈正相关(P<0.05)。提示三者协同促进卵巢上皮癌的发生、发展及侵袭、转移有关,对临床治疗及预后判断具有重要的指导意义。
综上所述,本实验应用免疫组化方法,检测HER-2、TOPO-Ⅱα和PI3K在卵巢上皮癌表达情况并对其临床意义进行分析,提示HER-2、TOPO-Ⅱα和PI3K对促进卵巢癌的发生、发展、浸润和转移起重要作用,并与患者预后有关。原癌基因HER-2是近几年来防治肿瘤的一个重要靶点,TOPO-Ⅱα抑制剂是目前卵巢上皮癌化疗的常用药物,PI3K/AKT在恶性肿瘤发生,增殖,转移,血管生成及化学耐药中的作用,以该通路为靶点的特异性或非特异性抑制剂在肿瘤治疗中有着广阔的应用前景。因此研究三者之间的关系将会进一步加深对卵巢癌发病机制的理解,并为卵巢癌有效治疗提供新思路。
1 Paul W,Sholam B,Matthew R,et al.Correlation of the structure of the transmembrane domain of the neu oncogene-encoded p185 protein with its function.Biochemistry,1990,87:8660-8664.
2 William J.Update on HER-2 as a target for cancer tHerapy:Alternative strategies for targeting the epidermal growth factor system in cancer.Breast Cancer Res,2001,3:390-394.
3 Lazar E,Tudose N,Lazar DC.Prognostic significance of c-erbB2 protein in endometrial cancer.Rom J Morphol Embryol,1998,44:101-107.
4 Suzuki C,Matsumoto T,Sonoue H,et al.Prognostic significance of the infiltrative pattern invasion in endometrioid adenocarcinoma of the endometrium.Pathol Int,2003,53:495-500.
5 Falck J,Jensen PB,Sehested M.Evidence for repressional role of an inverted CCAAT box in cell cycle-dependent transcription of the human DNA topoisomerase IIalpha gene.J Biol Chem,1999,274:18753-18758.
6 Cantley LC.The phosphoinositide 3-kinase pathway.Science,2002,296:1655-1657.
7 Xu G,ZhangW,Bertram P,et al.Pharmacogenomic profiling of the PI3K/PTEN-AKT-mTOR pathway in common human tumors.Int J Oncol,2004,24:893-900.
8 Vivanco I,Sawyers CL.Pharmacogenomic profiling of the PI3K/PTENAKT-mTOR pathway in common human tumors.Nat Rev Cancer,2002,2:489-501.
9 Pene F,Claessens YE,Muller O,et al.Role of the phosphatidylinosi tol 3-kinase/Akt and mTOR/P70S6-kinase pathways in the proliferation and apoptosis in multiple myeloma.Oncogene,2002,21:6587-6597.
10 Hill MM,Hemmings BA.Inhibition of protein kinase B/Aktimplications for cancer therapy.Phamacol Ther,2002,93:243-251.
11 Huang S,Houghton PJ.Targetiog mTOR signaling for cancertherapy.Curr Opin Pharmacol,2003,3:371-377.
12 Ning G,Daniel C,Flynn L,et al.G1 cell cycle progression and the expression of G1 cyclins are regulated by PI3K/AKT/mTOR/p70S6K1 signaling in human ovarian cancer cells.Am J Physiol Cell Physiol,2004,287:281-291.
