山杏果肉可溶性膳食纤维的抗氧化活性与红外光谱分析*
2012-01-12崔洁顾欣黄昆王文江李迪王建中
崔洁,顾欣,黄昆,王文江,李迪,王建中
(北京林业大学生物科学与技术学院,北京,100083)
山杏Armeniaca sibirica(L.)Lam.蔷薇科杏属植物,主要分布于我国黑龙江、吉林、辽宁、内蒙古、甘肃、河北、山西等省区[1]。山杏为我国三北防护林的主栽树种之一,现有栽培面积约占三北防护林保存面积的1/8,果实年产量约20~30万t,果肉、杏核各约10~15万t。由于山杏果肉酸涩适口性差,生产中被直接废弃,不仅造成资源的严重浪费,还经常导致环境污染。研究发现山杏果肉中膳食纤维含量较高(超过50%),以此为切入点,开展山杏果肉可溶性膳食纤维制备及其抗氧化活性研究,对于将山杏果肉变废为宝,降低其相关产品生产成本,保护环境,都至关重要[2]。
本文通过总还原力测定、清除DPPH自由基、清除羟基自由基和清除超氧阴离子4种评价方法,分析比较微生物发酵液酶解法和复合酶酶解法制备的山杏果肉可溶性膳食纤维的抗氧化活性,同时分析比较了两者的红外光谱图。
1 材料与方法
1.1 试验材料与试剂
承德平泉县提供的山杏果肉,经45℃烘干,磨粉,过40目筛,备用。
1,1-二 苯 基-2-苦 肼 基 (1,1-dipheny1-2-picrylhydrazyl,DPPH),Sigma 公司;VC,2,6-二叔丁基-4-甲基苯酚(BHT),邻苯三酚,磷酸氢二钠,磷酸二氢钠,氯化钠,铁氰化钾,三氯醋酸,三氯化铁,三羟甲基氨基甲烷(Tris),邻菲罗啉,硫酸亚铁,双氧水,氢氧化钠,天津市津科精细化工研究所,分析纯试剂;98%浓硫酸,无水乙醇,盐酸,北京化工厂,分析纯试剂。
绿色木霉(中科院微生物所购得)发酵液,糖化酶,碱性蛋白酶(北京科百奥生物技术有限公司),纤维素酶(北京奥博星生物技术有限责任公司)。
试验用水为蒸馏水。
1.2 试验仪器
752 Spectrophotometer紫外分光光度计,上海美谱达仪器有限公司;Thermo BIOFUGE PRTMO R centrifuge,美国 Thermo Fisher Scientific公司;SHZ-往复式水浴恒温振荡器,太仓市实验设备厂;SHB-3循环水式多用真空泵,郑州长城科工贸有限公司;RE-5203旋转蒸发器,上海亚荣生化仪器厂;Thermo Heto Power Dry LL1500 Freeze Dryer,美国 Thermo Fisher Scientific公司;Nesus670红外光谱仪,美国Nicolet公司。
1.3 试验方法
1.3.1 微生物发酵液酶解法制备山杏果肉可溶性膳食纤维
称取10 g山杏果肉,按1∶15的料液比加入绿色木霉发酵粗酶液,45℃恒温水浴6 h,反复离心3次取上清,旋蒸浓缩后,以4倍体积的无水乙醇沉淀,再离心,取沉淀,用少量水溶解,冷冻干燥,记作F-SDF,备用[3]。
1.3.2 复合酶酶解法制备山杏果肉可溶性膳食纤维
称取10 g山杏果肉,按按1∶15的料液比加入蒸馏水,混匀,用酸度计将pH值调至4.5,加入糖化酶0.2 g,50℃水浴振荡1 h,之后再调节 pH值至7.5,加入纤维素酶0.2 g,55℃水浴振荡1 h,再调节pH值至8.2,加入碱性蛋白酶0.02 g,55℃水浴振荡1 h,然后反复离心3次取上清,以下步骤同微生物发酵液酶解法,记作E-SDF,备用。
1.3.3 不同梯度参照物和样品浓度的制备
用蒸馏水分别溶解2种不同方法制备的山杏果肉SDF,天然抗氧化剂VC,并配制成以下所需的相应浓度,备用;用无水乙醇溶解BHT并配制成以下所需的不同浓度,备用。
1.3.4 山杏果肉可溶性膳食纤维(SDF)清除DPPH自由基测定
称取0.003 8~0.004 0 g DPPH,用无水乙醇溶解,定容至50 mL,摇匀得到浓度为2×10-4mol/L的DPPH溶液,放在冰箱中避光保存备用。在10 mL离心管中分别加入2 mL不同浓度梯度的E-SDF,FSDF,BHT和VC溶液,再分别加入2 mL DPPH溶液,避光反应30 min后在波长517 nm处测定吸光度。以2 mL样品溶液加入2 mL无水乙醇作为对照,以2 mL DPPH溶液加入2 mL蒸馏水作为空白,计算对DPPH自由基的清除率。以无水乙醇溶液作为参比,如此重复3次,取平均值[4-7]。公式如下:
DPPH·清除率/%=[1-(A-B)/C]×100
式中:A,DPPH溶液+样品溶液的吸光度值;B,样品溶液+无水乙醇的吸光度值;C,DPPH溶液+蒸馏水的吸光度值。
1.3.5 山杏果肉可溶性膳食纤维(SDF)总还原力的测定
分别取1mL不同浓度的样品溶液于10 mL离心管中,加入2 mL磷酸盐(PBS)缓冲液(0.2 mol/L,pH 6.6)和2 mL 1%铁氰化钾溶液,混匀,50℃水浴20 min,取出,加入2 mL 10%三氯乙酸溶液,混匀,迅速冷却。然后,取2 mL上述混合液于10 mL离心管中,加入2mL蒸馏水水和0.4 mL 0.1%的三氯化铁溶液,混匀,测定其在700 nm处的吸光度(A700),以A700表示样品的还原能力,以蒸馏水为空白,每个样品做3 个平行,取其平均值[8]。
1.3.6 山杏果肉可溶性膳食纤维(SDF)清除羟基自由基(·OH)的测定
称取0.020 9 g FeSO4·7H2O,于100 mL容量瓶中准确定容,得0.75 mmol/L FeSO4溶液;称取0.148 7 g邻二氮菲,用无水乙醇定容到10 mL容量瓶中,再取1 mL稀释至100 mL得到0.75 mmol/L的邻二氮菲溶液;用微量移液器量取166.7μL 30%的双氧水用蒸馏水定容至50 mL容量瓶中,得到0.1%的H2O2。
在10 mL的离心管中分别加入1 mL 0.75 mmol/L邻二氮菲溶液,2 mL 0.2 mol/L pH 7.4的磷酸缓冲溶液,1 mL蒸馏水,充分摇匀后,加入0.75 mmol/LFeSO4溶液1 mL,混匀后再加入H2O21 mL,37℃水浴反应60 min后,在536 nm处测定吸光度Af。
用蒸馏水代替上述方法中H2O2测定吸光度Ao。
用不同浓度试样代替上述方法中的蒸馏水,测定吸光度Ax。
以蒸馏水代替样品作为空白[9-11],3 次平行,取平均值。按照如下公式进行计算:
羟基自由基(·OH)清除率/%=[(Ax-Af)/(Ao-Af)]×100
1.3.7 山杏果肉可溶性膳食纤维(SDF)清除超氧阴离子(O2-)的测定
称取三羟甲基氨基甲烷(Tris)12.11 g,用蒸馏水溶解定容至1 000 mL,得到0.1 mol/L Tris溶液;取50 mL 0.1 mol/LTris溶液与22.9 mL 0.1 mol/L HCl混匀并用蒸馏水稀释至100 mL,调整pH值为8.2,得50 mmol/L Tris-HCl缓冲溶液;称取0.315 g邻苯三酚用10 mmol/L盐酸溶解定容至100 mL,得到25 mmol/L邻苯三酚,棕色瓶,避光保存。
取50 mmol/L Tris-HCl缓冲溶液(pH=8.2)2.25 mL,加入2 mL不同浓度的待测样品(对照加蒸馏水),然后加入25 mmol/L的邻苯三酚1mL,混匀后25℃水浴20 min,然后滴入10 mol/L的HCl 1滴,终止反应,在420 nm处测吸光度,重复3次,取平均值。按以下公式计算样品对O-2·的清除率[12]。
超氧阴离子(O-2·)清除率/%=[1-(A1-A2)/A3]×100
式中:A1,Tris-HCl+样品+邻苯三酚+HCl的吸光度值;A2,Tris-HCl+样品+HCl的吸光度值;A3,Tris-HCl+邻苯三酚+盐酸的吸光度值。
1.3.8 山杏果肉SDF的红外光谱分析
称取两种不同方法制备的SDF各2 mg,称取200 mg的溴化钾粉末2份,分别将样品与KBr粉末在玛瑙研钵中研成细粉并混匀,压片,置于红外光谱仪中进行测定。扫描范围为4 000~400 cm-1;分辨率8 cm-1,扫描次数32 次。
2 结果与分析
2.1 山杏果肉SDF抗氧化结果分析
2.1.1 对DPPH自由基的清除能力测定结果
1,1-二苯基苦基苯肼(DPPH·)是一种稳定的有机自由基,在可见光区的517 nm处存在最大吸收峰,其浓度与吸光度呈线性关系,通过被测物质对DPPH自由基的清除能力可以表示其抗氧化性的强弱。
由图1可知,低于0.10 mg/mL浓度时,抗氧化剂(VC,BHT等)明显比2种不同方法制备的SDF的清除能力强,这是因为抗氧化剂是纯品,单位体积内浓度相对高,而制备的样品粗提物纯度低所致。随浓度升高,抗氧化剂清除率曲线变化并不明显,而2种SDF的清除率呈明显上升趋势,在0.60 mg/mL处,E-SDF和F-SDF的清除效果均很接近抗氧化剂水平,分别达到了84.23%,61.39%。相同浓度时,E-SDF的对DPPH自由基的清除效果优于F-SDF。
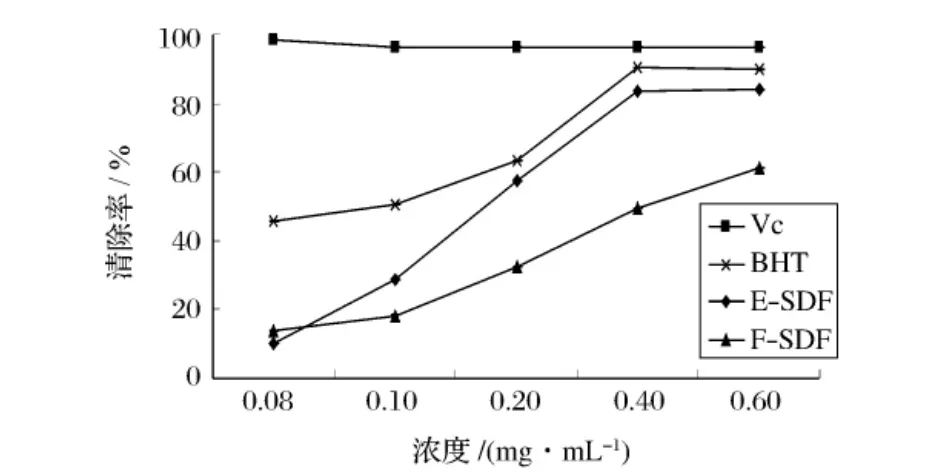
图1 E-SDF与F-SDF清除DPPH自由基能力比较
2.1.2 总还原力测定结果
还原能力的测定是以样品是否为有效的电子供应者为评价指标的。若是有效的电子供应者,其供应的电子可将Fe3+还原成Fe2+,还可与自由基形成较惰性物质,从而中断自由基连锁反应。一般情况下,物质的吸光度越大,还原能力越强,其抗氧化能力也越高。
由图2可知,当浓度在0.20 mg/mL时,BHT的吸光度值就已经达到了1.03以上,而 E-SDF是0.19,F-SDF稍好0.22。随浓度增加,吸光度值增加趋势缓和,可以看出,相同浓度时抗氧化剂BHT的总还原能力明显优于山杏果肉SDF。当浓度达到1 mg/mL时,E-SDF的还原能力达到0.83,F-SDF则达到0.59,均明显低于BHT。将BHT在同等浓度下稀释10倍后是0.72,它的总还原能力介于F-SDF和ESDF之间,即1 mg/mL的山杏果肉SDF的总还原力相当于BHT/10的还原能力。
2.1.3 对羟基自由基(·OH)的清除结果
邻二氮菲-Fe2+被反应体系产生的经自由基氧化后红色褪去,吸收峰大幅度下降,反应前后的变化可反映羟自由基氧化的累积效应,确定待测样品的存在是否对(·OH)有清除作用。

图2 E-SDF和F-SDF的总还原力比较
由图3可知,VC对·OH的清除效果明显优于E-SDF和 F-SDF的粗提物,当浓度为0.60 mg/mL时,E-SDF的清除率是30.55%,F-SDF为18.02%。随浓度升高,清除率呈递增趋势,前者较后者趋于平缓。当浓度达到3 mg/mL时,E-SDF清除率达到62.24%,F-SDF达到65.89%,清除率超过 E-SDF。同时,VC在相同浓度范围内,清除率从90.91%到98.14%,变化幅度虽然不明显,但是一直处于较高的清除水平,这与VC是纯品有关,鉴于样品本身颜色,若继续增加样品浓度进行对比势必干扰测定结果,故未提升样品浓度。

图3 E-SDF和F-SDF对羟基自由基(OH·)的清除能力比较
采用改良的邻苯三酚自氧化方法,邻苯三酚在碱性条件下易发生自身氧化,产生和有色中间产物,能促进邻苯三酚自氧化,通过测定物质是否对邻苯三酚自氧化有抑制作用,可评价其对的清除能力。
由图4可知,当浓度为0.60 mg/mL时,E-SDF,F-SDF,BHT清除率分别是 23.93%,29.93%,72.13%,当浓度大于0.80 mg/mL时,E-SDF的清除率逐渐超过F-SDF。而后随浓度增加,E-SDF的清除率的增加趋势明显强于F-SDF和抗氧化剂BHT。当浓度达到3 mg/mL时,E-SDF,F-SDF,BHT清除率分别达到了99.67%,72.72%,89.56%。可见,2种方法制备的SDF对的清除能力都很强,比对的清除效果显著,在较低浓度下,清除率已经接近甚至超过BHT。

图4 E-SDF和F-SDF对超氧阴离子()的清除能力比较
2.2 F-SDF和E-SDF的红外光谱分析
如图5所示,2种SDF均在3 300~3 500 cm-1内出现较强的吸收峰,此为O—H键的伸缩振动峰;在2 924.5 cm-1出现吸收峰,此处是甲基与亚甲基的C—H键的伸缩振动峰,此处E-SDF的吸收程度明显比F-SDF高;在1 610 cm-1附近出强现吸收峰,ESDF在 1 611.46 cm-1处,F-SDF在1 606.36 cm-1处,此波动范围为芳香环的伸缩振动;在1 100 cm-1附近出强现吸收峰,E-SDF在1 105.40 cm-1处,FSDF在1 106.70 cm-1处,此处为C-F的伸缩振动;在1 500~500 cm-1内2种 SDF的吸收峰强度略有差异,E-SDF的吸收峰略强于F-SDF。
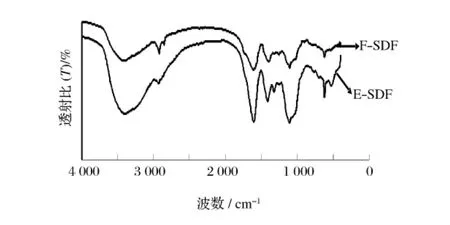
图5 发酵与酶解制得SDF红外光谱对比
综合以上条件分析得出:2种方法制得的SDF结构很形似,均可能含有酚类,芳烃类,胺类,醇类化合物[13-14],由于含量或结合程度不同,导致它们在吸收强度上面存在差异。资料显示多糖本身并不具有抗氧化特性,但是SDF与上述具有抗氧化能力的物质紧密结合在一起,使SDF具有了一定的抗氧化活性。初步推断微生物发酵粗酶液中酶的种类多代谢旺盛,对与山杏果肉SDF结合的某些酚类醇类物质水解充分,故造成了其在红外光谱中的强度差异,同时抗氧化活性较之复合酶酶解产物减弱。
3 结论
本研究表明,微生物发酵液酶解法和复合酶酶解法制备的山杏果肉可溶性膳食纤维SDF均具有一定的抗氧化活性,并且在一定范围内随浓度增高,其活性逐渐增强。但是评价方法不同相应的反映出其抗氧化能力略有也不同,总体来说,后者制备的SDF的抗氧化能力要略强于前者,但二者都低于天然或合成类抗氧化剂,如VC,BHT等。由于产物具有明显的抗氧化特性,故可将其归属于抗氧化膳食纤维一类[15-16]。2种SDF的红外光谱图在吸收峰上存在一定差异初步认为是水解程度不同导致,进而也造成其抗氧化能力不同。
[1] 中国植物志电子版.http://frps.plantphoto.cn/dzb listz.asp.第38 卷,27页.
[2] 张继,罗俊富,姚健,等.野山杏果肉中水不溶性膳食纤维的提取研究[J].安徽农业科学,2008,36(30):13 003-13 004.
[3] 欧阳玲花,冯健雄.化学法和绿色木霉(Trichoderm aviride)发酵法提取柠檬皮膳食纤维的研究[J].食品科学,2008,(2):222-224.
[4] 曹炜,卢珂,陈卫军,等.不同种类蜂蜜抗氧化活性的研究[J].食品科学,2005,26(8):352.
[5] 彭长连,陈少薇,林植芳,等.用清除有机自由基DPPH法评价植物抗氧化能力[J].生物化学与生物物理进展,2000,27(6):658 -661.
[6] Hana Kim,Jeong Yong Moon,Hyeonji Kim,et al.Antioxidant and antiproliferative aetivities of mango(Mangi fera indieal)flesh and peel[J].Food Chenistry,2010,121(2):429-436.
[7] Ribeiro S M R,Barbosa L C A,Queiroz J H,et al.Phenolic compounds and antioxidant capacity of Brazilian mango(Mangifera indica L.)varieties[J].Food Chemistry,2008,110(3):620- 626.
[8] Jing H,Kitts D D.Antioxidant activity of Sugar-lysine Maillard reaction products in cell free and cell culture systems[J].Archives of Biochemistry and Biophysis,2004,429:154-163.
[9] 金鸣,蔡亚欣,李金荣,等.邻二氮菲-Fe2+氧化法检测H2O2/Fe2+产生的羟自由基[J].生物化学与生物物理进展,1996,23(6):553.
[10] 王飞,张洪,刘秀玲.枳椇子各部位清除羟自由基作用的比较[J].华西药学杂志,2006,21(1):48.
[11] 张泽庆,田应娟,张静.防风多糖的抗氧化活性研究[J].中药材,2008,31(2):368.
[12] 张京芳,王冬梅,周丽,等.香椿叶提取物不同极性部位体外抗氧化活性研究[J].中国食品学报,2007,7(5):12-16.
[13] 孙毓庆,胡育筑.分析化学(第二版)[M].北京:科学出版社.2006:328.
[14] Kacurakova M,Capek P,Sasinkova N,et al.FT2IR study of plant cell model compounds:pectic polysaccharides and hemi cellulose[J].Carbohydrate Polymers,2000,43(1):195 -203.
[15] 欧仕益,高孔荣,黄惠华.麦麸膳食纤维抗氧化和·OH自由清除活性的研究[J].食品工业科技,1997(5):44-46.
[16] 程安玮,杜方岭.膳食纤维抗氧化作用及其机理的研究[J].农产品加工,2009,(1):67-71.
