产抗真菌蛋白(AFP)巨大曲霉的分离鉴定及AFP的提纯
2012-01-12元月王德良郭立芸林智平江伟
元月,王德良,,郭立芸,林智平,江伟
1(新疆农业大学,新疆乌鲁木齐,830000)2(中国食品发酵工业研究院,北京,100027)3(北京燕京啤酒股份有限公司,北京,101300)
巨大曲霉(Aspergillus giganteus)是一种无害丝状真菌,目前已广泛应用于纤维素酶的工业生产。其所产的抗真菌蛋白(Antifungal Protein,AFP)是一种含有51个氨基酸的小分子量碱性蛋白,可有效抑制丝状真菌的生长,特别是引起动植物致病的丝状真菌,而细菌、酵母、植物和哺乳类动物细胞却不会受到影响。许多研究表明,AFP在抑制丝状真菌方面具有安全、高效、广谱、稳定等特点[1],可作为一种新型天然杀菌剂,应用于医疗、制药、食品加工以及农业生产等多个领域。本研究主要介绍巨大曲霉的形态特征、分子鉴定及其抗真菌蛋白(AFP)的分离纯化方法。
1 材料和方法
1.1 材料
1.1.1 土壤样品
共采集314份碱性土壤[2],分别取自河北、山东、河南、山西以及新疆等地区。采样时,去除上层5cm表土,取10~15cm深度的土壤,装入无菌试管中,每份样品约20 g。
1.1.2 主要培养基
查氏培养基:葡萄糖 20 g,NaNO32 g,K2HPO41 g,KCl0.5g,MgSO40.5 g,FeSO40.01 g,蒸馏水 1 000 mL ,pH自然,加入2%的琼脂,121℃湿热灭菌20 min。
液体摇瓶培养基[3]:玉米淀粉20 g,牛肉膏15 g,蛋白胨10 g,NaCl 5 g,蒸馏水1 000 mL,121℃湿热灭菌20 min。
麦芽汁琼脂培养基:取澄清麦芽汁,加2%琼脂,121℃,灭菌 30 min。
PDA培养基[4]:取马铃薯200 g去皮,切成块煮沸30 min,用纱布过滤;加入葡萄糖20 g,琼脂20 g,融化后补水至1 000 mL,121℃,灭菌20 min。
1.1.3 供试菌种
巨大曲霉AF-11由本研究筛选得到。
供试菌株:黄曲霉(Aspergillus flavs40191)、黑曲霉(Aspergillus niger2485)、圆弧青霉(Penicillium cyclopium40215)、禾谷镰孢菌(Fusarium graminearum4598)、燕麦镰孢菌(Fusarium avenaceum4594)和尖孢镰孢菌(Fusarium oxysporium4591),由中国工业微生物菌种保藏管理中心和中国食品发酵工业研究院酿酒部提供。
1.2 试验方法
1.2.1 菌株筛选
首先从碱性土壤中分离霉菌[5-6],并将初筛菌样接种于麦芽汁琼脂培养基进行复筛,于筛选平板上划线分离至纯种,编号并用斜面保存。以黄曲霉菌、黑曲霉菌、青霉菌、禾谷镰孢菌、燕麦镰孢菌和尖孢镰孢菌作为测试菌,结合平板对峙法[7]和牛津杯扩散法,筛选具有抗真菌活性的目标菌种。
1.2.2 菌株鉴定
形态鉴定参见《中国真菌志》(第五卷)[8]、《微生物分类学》[9]及 Varga[10]等文献中的方法进行。
参照文献[8]对菌株92号进行趋光性和感光性生理特征实验,即28℃下,对AF-11菌株分别进行单侧光照射和暗光照射处理,并建立正常光照条件下空白对照,培养5d,对比2种不同条件下的菌落颜色。
参照巨大曲霉抗真菌蛋白AFP特异序列,设计引物序列,见表1。PCR反应体系(50 μL):10×PCRbuffer(5 μL),dNTP(2.5 mmol/L,4 μL),primer 1(10 μmol/L,1 μL),primer 2(10 μmol/L,1 μL),Taq 酶(5 units/μL,0.5 μL),Template(4 μL),ddH2O 补至 50 μL。反应程序:94℃ 5 min;94℃ 30 s,58℃ 30 s,72℃ 30 s,30 个循环;72℃ 8 min,4℃保温。取 5 μL PCR产物在1%琼脂糖凝胶电泳上进行检测,电泳结束后用凝胶成像系统观察结果,样品于-20℃保存。

表1 巨大曲霉特异性引物序列
PCR产物经纯化后,送交上海生工生物工程有限公司测序。选择测序结果中可信度较高的区域,提交至NCBI-BLAST网站进行比对。
1.2.3 抗真菌蛋白(AFP)的分离纯化
发酵液离心(10 000 r/min,15 min)取上清液并调整pH 7.0。以CM-52为填料,装成φ2.6 cm×40 cm阳离子交换柱,配制TE缓冲液,上样后填料终浓度为50g/L。设置紫外检测仪在280 nm检测,流速1 mL/min,平衡30 min。加入发酵上清液后,上清液中的正价基团将吸附在柱填料上,随后加入含钠盐TE缓冲液进行洗脱,所得馏分透析后经真空冷冻干燥浓缩至2~4 mL,4℃保存。
取上述步骤所得馏分2 mL,加入Sephadex G-50凝胶柱层析系统(柱规格:φ1.6 cm×100 cm,填料终浓度为5 g/L)。用醋酸钠缓冲液(0.05 mol/L醋酸钠+0.1 mol/L NaCl)进行洗脱,设置流速0.5 mL/min,同时用紫外检测仪在280 nm进行检测。分别收集各吸收峰对应的馏分,透析后经真空冷冻干燥浓缩至2~4 mL[3,15]。所得浓缩蛋白经聚丙烯酰胺凝胶电泳检测[16-17],观察含有分子质量约为6.3 ku的蛋白质馏分组,并将其浓缩至2 mL,重复凝胶层析操作,所得蛋白馏分经真空冷冻干燥制粉,于-20℃保存。
1.2.4 SDS-PAGE检测
该试验选用低分子量蛋白质电泳体系,凝胶由16.5%分离胶、10%夹层胶和4%浓缩胶3部分构成[16]。Marker为超低分子量蛋白质标准品,分子质量范围为3.3~20.1 ku。蛋白样品经样品缓冲液溶解处理后上样,Marker上样量为15 μL,蛋白样品上样量为20 μL。待电泳结束,凝胶固定20 min,考马斯R-250染色1 h,并用微波法快速脱色。
1.2.5 抗真菌蛋白(AFP)的鉴定
取聚丙烯酰胺凝胶电泳上的目标条带,送交上海生工生物工程有限公司进行蛋白测序。选择蛋白测序结果中可信度较高的区域,提交至NCBI-BLAST网站进行比对。
1.2.6 抗真菌蛋白最低抑制浓度(MIC)
以黄曲霉菌、黑曲霉菌、青霉菌、禾谷镰孢菌、燕麦镰孢菌和尖孢镰孢菌为测试菌,分别制备浓度为103CFU/mL菌悬液备用。配制8组液体培养基,均添加纯化的 AFP并使终浓度分别达到1、3、5、7、9、12 μg/mL 和 15 μg/mL,最后 1 组为空白对照组。各组分别添加0.1 mL黄曲霉菌的菌悬液,于28℃条件下液体培养36 h,结合分光光度计法[18]和显微镜观察各组生长情况,无菌生长即为最低抑制浓度(MIC)。按上述步骤处理其他测试菌,各组均重复3次试验。
2 结果与分析
2.1 菌株的分离纯化
从土壤样品中分离出220株菌,其中具有抑制丝状真菌活性的霉菌11株,编号分别为菌株23号、菌株25号、菌株48号、菌株52号、菌株63号、菌株72号、菌株80号、菌株92号、菌株103号、菌株115号、菌株127号。经抑菌活性试验鉴定,菌株92号及其发酵液对试验指示菌都有明显的抑制作用,以无菌水为对照,每个处理重复3次求平均值,于28℃下恒温培养3 d,测量各个处理的菌落直径并计算抑菌率,见表2。图1为菌株92号对黄曲霉菌和青霉菌的抑制实验。

表2 菌株92号对各供试菌的抑制作用
2.2 菌种鉴定
2.2.1 形态特征
菌株92号在查氏琼脂平板上25℃培养7 d,菌落直径约为28~35 mm,10天后约40~50 mm;初期平薄,而后产生大量分生孢子结构,质地丝绒状;呈蓝灰色,老后变成带褐色,反面现褐色;无渗出液,无明显气味。菌落置于散射光下有些分生孢子梗很长,在边缘处尤为显著。分生孢子头为球形,而后呈棒形,直径26~40 μm;分生孢子椭圆形,3.5 μm ×2.5 μm,光滑。初步鉴定其属于丛梗孢科的曲霉属,如图2。
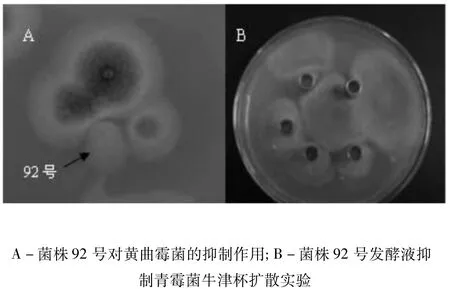
图1 菌株92号对霉菌的抑制作用
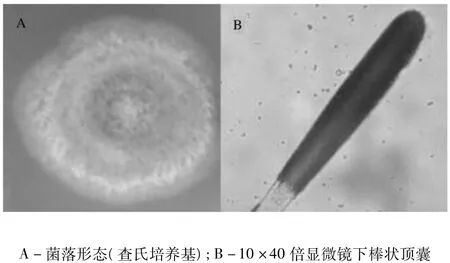
图2 菌株92号形态学鉴定
2.2.2 生理生化特性鉴定
趋光性试验结果显示,该菌分生孢子梗可弯向单侧光源生长,结果为阳性(图3,A)。感光性试验结果显示,无光的条件下呈白色(图3,B左);有光照的条件下,菌落呈现蓝绿色(图3,B右),结果为阳性。趋光性和感光性是巨大曲霉特有的生理特征,其他的棒状曲霉没有或不兼有上述生理特征。

图3 菌株92号趋光性和感光性试验
琼脂糖凝胶电泳检测菌株92号的总DNA,观察其长度约为20 Kbp。对26SrDNA D1/D2区序列进行扩增,得到长度约为450 bp的片段,与文献提供的巨大曲霉AFP开放阅读框片段大小相一致[14],且无非特异性扩增条带,经纯化后可以进行测序反应。
2.2.4 DNA测序结果
将PCR产物纯化后送交测序,所得序列与Gen-Bank数据库中的序列进行比较分析,测序结果显示,该序列与已发表的巨大曲霉特异性抗真菌蛋白AFP的开放阅读框序列(X60771.1)一致,菌株92号与巨大曲霉菌的同源性达100%。
通过上述形态鉴定、生理生化特性试验以及26s区序列分析,可知菌株92号与巨大曲霉菌的特性完全吻合,同源性达到100%,基本确定菌株92号为巨大曲霉菌(Aspergillus giganteus),编号AF-11。
2.3 巨大曲霉抗真菌蛋白(AFP)的分离纯化
2.3.1 CM-52阳离子交换层析
Theis等人[3]于2003年通过试验将AFP抗真菌蛋白从巨曲霉菌IfGB0902的发酵上清液中分离出来,并建立了用磷酸纤维素代替羧甲基纤维素作为阳离子交换剂的AFP提纯方法。当离子交换柱层析系统上样后,发酵上清液中的正价基团将吸附在CM-52阳离子交换柱上,其他组分和杂质随缓冲液最先流出,经280 nm紫外检测,在层析谱图上产生一个杂峰;持续加入TE缓冲液直至恢复基准平衡并维持15 min,开始加入钠盐洗脱液,此时正价基团被释放,在层析谱图上产生一个正价基团峰,如图4。收集正价基团峰所对应的馏分,经透析除盐后,真空冷冻干燥(0.011 MPa,-80℃)浓缩至2 mL,于4℃保藏备用。

图4 CM-52阳离子交换层析图
2.2.3 菌株92号总DNA提取与26SrDNA D1/D2区序列扩增
2.3.2 Sephadex G-50凝胶柱层析
Sephadex G-50凝胶柱层析系统平衡后,注入离子交换所得浓缩样品2 mL,继续加入醋酸钠缓冲液进行洗脱,设置紫外检测仪波长为280 nm。样品中的蛋白组分按分子从大到小的顺序随缓冲液依次被分离出来,在层析谱图出现对应的吸收峰,如图5。由图5看出,整个层析过程共分离出5个洗脱峰,分别收集各峰馏分,经透析除盐后,真空冷冻干燥(0.011 MPa,-80℃)浓缩至1 mL,-20℃保存。为提高样品纯度,浓缩样分别进行第2次凝胶层析操作,所得馏分浓缩后进行SDS-PAGE检测。

图5 Sephadex G-50凝胶柱层析图
2.3.3 SDS-PAGE检测结果
SDS-PAGE检测结果见图6。
查文献可知,巨大曲霉所产抗真菌蛋白(AFP)的分子量约为6.3ku[13,19]。经检测,凝胶层析所得第5组馏分的泳道上出现了与该类蛋白分子量大小相近的明显条带(图6,D)。经2次凝胶层析纯化后,得到单一条带(图6,E),由图显示该处理方法得到的蛋白浓缩液为电泳纯。

图6 SDS-PAGE电泳图
2.3.4 蛋白质序列检测结果
将电泳胶板送交测序,所得序列与GenBank数据库中的已知蛋白质序列进行比较分析。检测结果显示,该段蛋白序列与已发表的巨大曲霉所产抗真菌蛋白(AFP)的特异序列(CAA37523.1和P17737.2)基本一致,序列覆盖度分别为100%和98%。由特异性蛋白序列分析结果可进一步验证,菌株AF-11为巨大曲霉,所产蛋白为巨大曲霉抗真菌蛋白(AFP)。
2.3.5 抗真菌蛋白(AFP)抑菌活性试验结果
根据实验结果绘制折线图,如图7。

图7 不同浓度AFP对各测试菌生长的抑制作用
由图7可知,抗真菌蛋白(AFP)对于不同菌种的抑制浓度也不同。如AFP对黄曲霉的最低抑制浓度约为3μg/mL,对禾谷镰孢菌和燕麦镰孢菌的最低抑制浓度均为3μg/mL。实验证明,AFP可在低水平含量条件下抑制丝状真菌,有效降低测试菌产毒素的含量。
3 讨论
由于曲霉属微生物形态相似,生理生化特征也很相近,单从传统方法很难将其鉴定。本研究将形态特征鉴定与分子鉴定相结合,对巨大曲霉菌做了更为全面和细致的鉴定。
研究表明,巨大曲霉菌可产生具有抗真菌活性的肽类物质——AFP,能有效抑制产毒丝状真菌的生长并缓解真菌毒素残留问题;利用阳离子交换层析和凝胶层析交替结合的方法可有效提取高纯度的AFP;对于不同的真菌,AFP的使用量也不同;AFP的作用时限和高产优化条件仍需要进一步试验验证。
[1] Meyer V.A small protein that fights fungi:AFP as a new romising antifungal agent of biotechnological value[J].Applied Microbiology and Biotechnology,2008,78:17-28.
[2] 诸葛健,王正祥.工业微生物实验技术手册[M].北京:中国轻工业出版社,1995:394-400.
[3] Theis T,Wedde M,Meyer V,et al.The antifungal protein from Aspergillus giganteus causes membrane permeabilization[J].American Society for Microbiology,2003,47(2):588-593.
[4] 杨文博.微生物学实验[M].北京:化学工业出版社,2004,217-218.
[5] Agnihothrudu V.Aspergilli from soils of South India[J].Naturwissenschaften,1957,44:64-65.
[6] Gochenaur S E.A modification of the immersion tube method for isolating soil fungi[J].Mycologia,1964,56:921-923.
[7] 陈仕江,丁伟,杨帮,等.10种中药植物对4种植物病原真菌的生物活性研究[J].西南农业学报,2005,18(30):311-314.
[8] 齐祖同.中国真菌志(第五卷)[M].北京:科学出版社,1997.
[9] 张纪中.微生物分类学[M].上海:复旦大学出版社,1990.
[10] Varga J,Due M,Frisvad J C,et al.Taxonomic revision of Aspergillus section Clavati based on molecular,morphological and physiological data[J].Studies in Mycology,2007,59:89-106.
[11] 李永明,赵玉琪.实用分子生物学方法手册[M].北京:科学出版社,1998.
[12] Wnendt S,Ulbrich N,Stahl U.Molecular cloning,sequence analysis and expression of the gene encoding an antifungal-protein from Aspergillus giganteus[J].Current Genetics,1994,25(6):519-523.
[13] Meyer V,Wedde M,Stahl U.Transcriptional regulation of the antifungal protein in Aspergillus giganteus[J].Molecular Genetics and Genomics,2002,266(5):747-757.
[14] 徐军,龚蓁蓁.一个抗真菌蛋白在绿色木霉中的分泌表达[J].生物化学与生物物学报,2003,35(5):454-458.
[15] Silke H.Identification of fungal constituents that determine the sensitivity of fungi towards the antifungal protein(AFP)of Aspergillus giganteus[D].Berlin:Technische Universität Berlin,2006.
[16] Schagger H,Jagow G.Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa[J].Analytical Biochemistry,1987,166:368-379.
[17] Marcelo F P,Claudia L N.Electrophoretic analysis(tricine-SDS-PAGE)of bovine caseins[J].Acta Farmaceutic Bonaerense,2002,21(1):57-60.
[18] Hassan B,Anja S,Mahmoud H,et al.The antifungal protein AFP from Aspergillus giganteus prevents secondary growth of different Fusarium species on barley[J].Applied Microbiology and Biotechnology,2010,87:617-624.
[19] Florentine M,Willibald S,Lydia K,et al.Proper folding of the antifungal protein PAF is required for optimal activity[J].Research in Microbiology,2005,156:35-46.
