强噪声暴露后不同时期豚鼠耳蜗外毛细胞死亡方式的研究
2012-01-11薛秋红何坚陈佳吴翔磊龚树生谢静
薛秋红 何坚 陈佳 吴翔磊 龚树生 谢静
研究表明,噪声首先损伤柯替器的外毛细胞,从耳蜗底回开始,进行性向蜗顶发展,可进一步累及内毛细胞、支持细胞、耳蜗血管纹甚至螺旋神经节细胞[1]。耳蜗的损害存在两种类型的细胞死亡—即凋亡和坏死[2],本实验采用细胞核荧光染色方法,观察强噪声暴露后不同时期豚鼠耳蜗毛细胞死亡的不同方式,为其不同的时期干预提供实验依据。
1 材料与方法
1.1实验动物及分组 选用健康白色红目雄性豚鼠48只,体重400~450 g,耳廓反射灵敏,鼓膜完整,无中耳炎,无药物、噪声接触史。随机分为健康对照组(8只)和实验组(40只),实验组又分为噪声暴露后3 h、1 d、4 d、14 d、30 d组,每组8只。实验前适应性喂养1周。
1.2实验方法
1.2.1噪声暴露 噪声由软件4 kHz NBN-316 Hz BW-50 mV(北京解放军总医院耳鼻咽喉研究所自制并惠赠) 经笔记本电脑声卡产生,经放大器放大传至扬声器,扬声器置于80 cm×80 cm×85 cm的双层隔音箱四角;实验组豚鼠置于35 cm×35 cm×50 cm的饲养笼中,自由进水,豚鼠活动范围内声强相差最大不超过5 dB。用HS6280型噪声频谱分析仪(中国江西国营红声器材厂)连续监测,噪声为中心频率4 kHz的窄带噪声,声级计测量噪声强度,给声强度为120 dB SPL,暴露时间为4 h。对照组正常饲养不作任何处理。
1.2.2听性脑干反应(ABR)测试:正常对照组、实验组豚鼠在噪声暴露前及噪声暴露后相应时间点处死前,以10%水合氯醛(30 mg/kg)腹腔麻醉,在静电屏蔽室内测试ABR。采用Nicolet Compass 系统,刺激声为click,重复率为20次/秒, 扫描周期为10 ms,滤波带宽100~3 000 Hz,信号叠加1 024次,以引出可重复波Ⅲ的最小刺激声强度为标准判断反应阈。
1.2.3耳蜗基底膜铺片、Hoechst33342荧光染色 各组豚鼠于全身麻醉状态下完成ABR测试后,快速断头处死,取双侧听泡,开放卵圆窗和圆窗,灌注4%多聚甲醛磷酸缓冲液后,将听泡置于4%多聚甲醛磷酸缓冲液2 h,去蜗壳,分离耳蜗基底膜;应用DNA荧光染料Hoechst33342进行细胞核染色。将分离的基底膜置于染色液中,室温避光染色10 min后10 mmol/L BPS清洗标本3次,染色后的基底膜铺片,50%甘油封片。共聚焦荧光显微镜观察毛细胞核的变化并计数;观察全耳蜗基底膜,选择受损最明显的一段基底膜(距蜗尖约9~14 mm处,长约6 mm),定量观察受损的外毛细胞,并分别计数凋亡、坏死和缺失数目的百分比。 Hoechst33342染色显示核固缩、核碎裂是细胞凋亡的特征,核肿胀是细胞坏死的特征,在正常的毛细胞排列处出现空缺为毛细胞缺失。
1.3统计学处理 各组计量资料以均数± 标准差表示,用SPSS11.5统计软件两组间比较采用t检验,多组间比较采用单因素方差分析。
2 结果
2.1各组ABR反应阈 对照组及实验组噪声暴露前后ABR平均反应阈见表1,可见实验组噪声暴露后各组与对照组及实验组噪声暴露前ABR阈值差异均有统计学意义(P<0.01),噪声暴露后3 h、1 d组与噪声暴露后其他组ABR阈值差异有统计学意义(P<0.01),但噪声暴露后4 d、14 d、30 d组间差异没有统计学意义(P>0.05)。说明本实验的噪声条件可以引起豚鼠听力永久性阈移,噪声暴露后3 h阈移达到高峰,4 d后基本稳定。
注:*与对照组及同组噪声暴露前相比,P<0.01;△与噪声暴露后4、14、30 d组相比,P<0.01
2.2共聚焦荧光显微镜下观察 正常对照组毛细胞核为淡蓝色,大小一致,三排外毛细胞及一排内毛细胞排列整齐。噪声刺激后3 h、1 d、4 d、14 d、30 d组外毛细胞排列紊乱,内、外毛细胞均呈现3种病理改变:①核肿胀:细胞核体积增大,荧光染色减弱;②核固缩:细胞核体积缩小,荧光染色增强;③核消失:在原细胞核位置出现空白区。根据Hoechst33342染色判断标准,这三种核改变分别是细胞发生坏死、凋亡和缺失的改变。各种毛细胞核的病理改变多见于第一排外毛细胞,其次为第二、第三排,内毛细胞核受损较少。毛细胞核形态学改变累及耳蜗基底膜各回,主要为底回末端和第二回起始区域(距蜗尖约9~14 mm处,长约6 mm)(图1)。
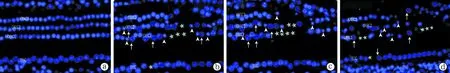
图1 各组耳蜗基底膜铺片(Hochest33342染色×400)
2.3损伤的外毛细胞定量分析 在噪声暴露后总的趋势是缺失的外毛细胞逐渐增加,坏死和凋亡的细胞数逐渐减少,总的损伤外毛细胞数(坏死、凋亡、缺失)明显增加。凋亡和坏死的细胞数在不同的时间点不同,噪声暴露后3 h、1 d、4 d组凋亡的平均细胞数百分比明显多于坏死(P<0.05),噪声暴露后14 d组凋亡与坏死的细胞数百分比没有明显差异(P>0.05),噪声暴露后30 d组凋亡细胞少于坏死细胞(P<0.05)(表2)。
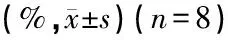
表2 实验各组豚鼠外毛细胞凋亡、坏死占受损细胞总数百分比
注:与同组坏死的平均细胞百分数相比,*P<0.05
3 讨论
研究表明,强噪声刺激后,耳蜗内细胞坏死和凋亡是同时发生的[2]。细胞的死亡方式与线粒体能量代谢相关,细胞内 ATP水平保持在一定的阈值以上时, 细胞以调亡方式死亡,而 ATP水平在阈值之下时, 细胞以坏死方式死亡[ 3]。Hoechst为核酸特异性染料,能区分凋亡和坏死细胞,凋亡细胞发生染色质浓缩或核碎裂,染色后荧光显微镜下表现为胞核致密浓染或碎块样致密浓染,而坏死细胞表现为核肿胀,荧光变淡。本实验结果中,在噪声刺激后基底膜铺片Hoechst33342荧光染色显示内、外毛细胞均呈现核肿胀、核固缩和核消失3种病理改变,外毛细胞比内毛细胞损害严重,外毛细胞损害主要表现在底回和第二回,且多为第一排和第二排,与HU等[2]报道基本一致。同时实验组受损的细胞愈近底回愈多,愈近顶回则愈少,耳蜗的基底回末段及第二回开始处病变最明显,可能是由于此处接近鼓室,容易受噪声影响,且该部位主要感受4 kHz的声音,本实验所给噪声的中心频率为4 kHz,故此处损害最明显。噪声可造成耳蜗局部缺血再灌注及细胞膜微小损伤,导致谷氨酸、NO、ROS(活性氧)形成,其中ROS的产生和耳蜗中抗氧化防御系统的改变对耳蜗细胞的损伤起到了主要作用[4]。许多实验证明NO、ROS可直接诱导体内、外各种组织的氧化损伤和细胞凋亡,因此推测噪声刺激导致耳蜗内NO、ROS的水平增高,并可能激活细胞内的信号途径和调控基因表达来诱导耳蜗细胞凋亡。本实验中,强噪声暴露后30天,耳蜗还同时存在3种核形态变化,据此推论强噪声暴露后毛细胞的损伤是一个复杂的长期非同步的病理变化过程,且耳蜗的损伤至少持续到噪声暴露后30天。
从文中结果看,实验组噪声暴露后总的趋势是缺失的外毛细胞明显增加,坏死和凋亡的细胞数减少,噪声暴露后3 h、1 d、4 d组凋亡的细胞数明显多于坏死(P<0.05),噪声暴露后14 d组凋亡与坏死的细胞数没有明显差异(P>0.05),噪声暴露后30 d组凋亡的细胞数明显少于坏死(P<0.05)。由此推论, 强噪声暴露后的早期,细胞能量代谢系统轻度受损,毛细胞死亡方式以凋亡为主;到中晚期一些细胞内ATP含量严重减少,细胞死亡以坏死为主。凋亡不仅发生在强噪声对豚鼠耳蜗损害的早期,而且至少一直持续到噪声暴露后30天。这可能与强噪声除对内耳直接作用外,还会发生次级损伤有关,即高强度噪声后产生大量自由基,自由基损伤DNA、蛋白质、脂质、核酸等,导致毛细胞的凋亡和坏死[5,6]。噪声暴露后30天总的损伤外毛细胞数(坏死、凋亡、缺失)明显上升,这与豚鼠噪声暴露后听力损失结果并不矛盾,因为随着噪声停止刺激后时间的延长,大量损害不严重的毛细胞在各种细胞保护机制的作用下会逐渐恢复[7],因此听力也逐渐恢复,而本研究统计的总的损伤细胞数是不可逆的细胞病理改变,只是损伤细胞的一部分。至于噪声诱导耳蜗细胞凋亡与听力损失的具体相关性,以及凋亡的途径和分子调控机制,还需进一步的研究。
4 参考文献
1 黄选兆,汪吉宝 ,主编.实用耳鼻咽喉科学[M].北京 :人民卫生出版社,2005.1 066~1 066.
2 Hu BH, Guo W, Wang PY,et al . Intense noise-induced apoptosis in hair cells of guinea pig cochleae[J].Acta Otolaryngol,2000,120:19.
3 Leist M, Single B, Castoldi AF, et al . Intracellular adenosine triphosphate ( ATP ) concen -tration : a switch in the decision between apoptosis and necrosis[J]. J ExpMed, 1997, 185:1 481.
4 候粉霞,王生,胡吟燕.噪声对豚鼠耳蜗抗氧化酶防御体系的影响[J].中华劳动卫生职业病杂志,2003,21:121.
5 杨卫平,郭维, 胡博华. 强噪声引起的耳蜗毛细胞核形态学变化[J].解放军医学杂志,2002,27:150.
6 Yang WP, Henderson D, Hu BH, et al.Quantitative analysis of apoptotic and necrotic outer hair cells after exposure to different levels of continuous noise[J].Hear Res,2004,196:69.
7 薛秋红,陈小林,龚树生,等.未折叠蛋白反应在强噪声致豚鼠耳蜗细胞损伤过程中的作用[J].听力学及言语疾病杂志,2011,19:149.
