一株高产果胶酶青霉菌株的筛选鉴定*
2011-12-17蓝丽精蔡琪敏董夏梦汪鹏荣蒋冬花
蓝丽精, 周 琴, 蔡琪敏, 董夏梦, 汪鹏荣, 蒋冬花
(浙江师范大学化学与生命科学学院,浙江金华 321004)
能够分解果胶质的酶称作果胶酶(pectinase)[1].该酶可分为:原果胶酶、裂解酶(PL)、多聚半乳糖醛酸酶(PG)和果胶酯酶(PE)[2].相应地,测量酶活性的方法也有很多,如滴定法、黏度下降法、脱胶作用时间法、还原糖测定法、紫外吸收测定法等.本实验酶活性测定均采用还原糖测定法中的 3,5-二硝基水杨酸(DNS)法[3].
果胶酶主要应用于食品加工业,在纺织、环境保护、饲料加工、生物制浆、木材防腐等行业中也有广泛的应用[4].文献[5]还研究了草酸青霉(Penicillium oxalicum)果胶酶的诱导抗病作用.
果胶酶主要由微生物和植物合成.微生物中的真菌、放线菌和细菌[6]都能产生果胶酶的相关酶系.目前国内外研究与应用较多的是细菌和霉菌,其中黑曲霉(Asperillus niger)是国际公认的安全菌株,所以最受关注[7].此外,酵母菌[8]、链霉菌和根霉[9]等也有相关的报道,而关于草酸青霉(Penicillium oxalicum)的相关报道甚少,草酸青霉(Penicillium oxalicum)产果胶酶的液体发酵更是鲜有报道.
果胶酶的传统工业化生产主要采用固体发酵法,但液体发酵法具有发酵条件参数易于测量、再现性强、易于控制等优点.本实验从污泥中筛选到一株高产果胶酶的草酸青霉,运用液体发酵法对其酶活性进行了相关研究.
1 材料和方法
1.1 菌株来源
以从山东、四川、海南、浙江等地采集的土壤、昆虫、动物内脏、腐烂水果等100多份样品为材料,分离筛选获得高产果胶酶菌株.
1.2 培养基
1)马铃薯葡萄糖培养基(PDA):马铃薯200 g,葡萄糖20 g,琼脂 15 ~20 g,水 1 000 mL,pH 6.0.
2)产果胶酶筛选培养基:果胶30 g,NaNO33 g,K2HPO4·3H2O 3.3 g,KCl 0.5 g,Fe2(SO4)30.01 g,(NH4)2SO420 g,MgSO40.24 g,CaCl20.15 g,KH2PO43.8 g,琼脂粉20 g,溴酚蓝0.2 g,水1 000 mL,pH 6.0.
3)摇瓶种子培养基:果胶4 g,(NH4)2SO41 g,KH2PO43.8 g,K2HPO4·3H2O 0.2 g,水 100 mL,pH 6.0.
4)摇瓶基础培养基:桔皮粉4 g,米糠4 g,(NH4)2SO41 g,KH2PO43.8 g,K2HPO4·3H2O 0.2 g,水 100 mL,pH 6.0.
1.3 初筛
取适量土样、昆虫、腐烂果实等磨碎后加无菌水,于28℃培养24 h,然后取0.1 mL培养液进行涂布,培养3 d.产果胶酶的菌落着生的蓝色培养基有黄色水解圈生成,挑取水解圈明显的菌落进行复筛[10].
1.4 复筛
在筛选培养基中挑取水解圈大的单菌落,通过测定和计算其变色圈直径和菌落生长圈直径的比值(Dp/Dc)进行复筛.在培养皿的中心分别接入初筛获得的菌种,接种后培养皿置28℃恒温培养箱中培养3 d.测量各菌落生长圈的直径Dc和变色圈的直径Dp,选择Dp/Dc值较大的菌种备用,最终选取一株果胶酶活性高的菌株进行实验.
1.5 摇瓶培养
将复筛获得的菌种经PDA斜面培养后,用无菌水配成1.0×106的孢子悬浮液,取2 mL(摇瓶装液量的5%)接入种子摇瓶培养基中,回转式摇床转速为160 r/min,28℃培养24 h后,取3.2 mL(摇瓶装液量的8%)种子液接入摇瓶培养基中继续培养70 h.摇瓶装液量均为250 mL三角瓶中装40 mL.
1.6 粗酶液的提取
发酵液在4℃,10 000 r/min离心10 min,取上清液作为粗酶液.
1.7 酶活性测定
采用 3,5-二硝基水杨酸(DNS)法[3]测定酶活性.吸取0.2 mL适当稀释的酶液于试管中,加1.8 mL 0.4%的果胶底物溶液,50℃水浴反应30 min后,加2 mL DNS试剂终止反应,沸水浴10 min,冷却后蒸馏水定容到15 mL,摇匀.空白对照:吸取0.2 mL煮沸的稀释酶液于试管中,加2 mL DNS试剂和1.8 mL 0.4%的果胶底物溶液,50℃水浴反应30 min,沸水浴10 min,冷却后蒸馏水定容到15 mL,摇匀.在540 nm波长处测定吸光度.在上述反应体系中,以每毫升果胶酶液降解果胶底物1 min产生1 μg还原糖定义为1个酶活性单位.
1.8 培养时间对产果胶酶的影响
取3.2 mL(摇瓶装液量的8%)种子液接入40个250 mL装液量为40 mL的三角瓶内,160 r/min,28℃摇瓶培养,每隔2 h取样.接着,将菌体一并用滤纸过滤,然后用烘箱于50℃烘至恒重,再用分析天平称菌丝体干质量.实验重复3次.
1.9 菌种鉴定
1.9.1 培养和形态特征观察
将菌株在PDA培养基平板上培养3 d,用显微镜观察其菌丝、分生孢子梗、分生孢子等特征.
1.9.2 DNA提取与ITS序列分析
取PDA培养基平板上培养3 d的新鲜菌丝体50 mg,加液氮研磨成粉末,用试剂盒提取DNA.利用真菌通用引物 ITS1:5'-TCCGTAGGTGAACCTGCGG-3'和ITS4:5'-TCCTCCGCTTATTGATATGC-3'进行rDNA的内转录间隔区(ITS)序列扩增,测序由上海生物工程有限公司完成.将测得的ITS序列在GenBank数据库进行BLAST比对,通过同源性分析对菌株进行分子水平的鉴定.
2 结果
2.1 产果胶酶菌株的分离筛选
利用产果胶酶的菌株可以使加溴酚蓝的培养基产生黄色水解圈的原理,本实验从土壤、腐烂水果等生境复筛得到黄色水解圈较大的7株霉菌(见图1和图2),对其进行Dp/Dc值及酶活性的测定,结果见表1.
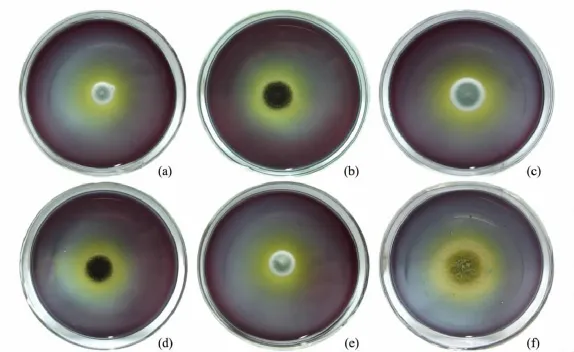
图1 筛选所获部分菌落图

图2 L5菌株的培养特征和形态特征
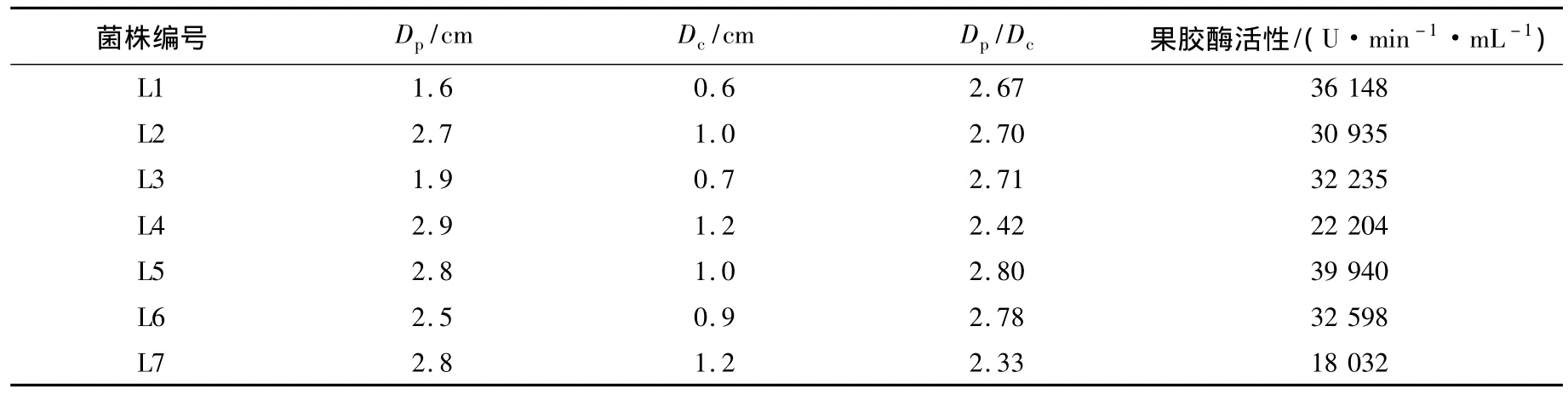
表1 7株产果胶酶菌株的Dp/Dc值和酶活性比较
由表1可以看出,菌株的酶活性随着Dp/Dc值增大而增大,L5菌株的Dp/Dc值最高,相应的酶活性为 39 940 U·min-1·mL-1.L5 菌株是从浙江东阳荷塘淤泥中筛选得到的.图2(a)为L5菌株在溴酚蓝筛选培养基上的黄色水解圈照片.
2.2 培养时间对L5菌株产果胶酶的影响
对每隔2 h取样得菌体进行干质量测量,并绘制生长曲线见图3.由图3可知:将菌体从种子培养基中接入摇瓶培养基约需0~10 h的停滞期;接着10~24 h,菌丝生长,菌体质量进入对数期;其后曲线趋于平缓,24~68 h是菌体质量的稳定期;从68 h始,菌体开始自溶,进入衰亡期.
每隔2 h测量一次L5菌株产生的果胶酶酶活性,以酶活性为纵坐标、培养时间为横坐标绘制曲线(见图3).由图3可知:在2~70 h内,L5菌株产果胶酶的活性逐渐上升,在菌体稳定期结束时酶活性达到最大值39 940 U·min-1·mL-1;在76~80 h内,果胶酶的活性下降.

图3 L5菌株的生长曲线
2.3 L5菌株的分类鉴定
2.3.1 形态学鉴定
1)培养特征:PDA培养基上,28℃培养3 d即形成较典型的菌落,菌落中间呈蓝绿色,边缘为白色,直径约19 mm,轮廓规则,外观呈绒毛状.
2)形态特征:28℃ PDA培养基上培养3 d,显微镜下观察L5菌株的菌丝形态、分生孢子梗的分枝情况、帚状枝及瓶梗的类型等显微形态特征.由图2可见:菌丝细胞丝状交织,具横隔;分生孢子梗不具足细胞,帚状枝为对称双轮型,瓶梗细长渐变尖锐;分生孢子椭圆形,呈蓝绿色.
2.3.2 ITS的PCR扩增与序列分析
用真菌通用引物ITS1/ITS4对L5菌株进行PCR扩增,获一长度为572 bp的目的片段.将测序所得序列在美国国立生物技术信息中心(NCBI)进行BLAST比对和同源性分析,结果表明L5菌株的ITS序列与Penicillium oxalicum同源性最高达99%.基于L5菌株的ITS序列建立的系统发育树见图4,结合形态特征鉴定,将L5菌株鉴定为草酸青霉菌(Penicillium oxalicum)[11].
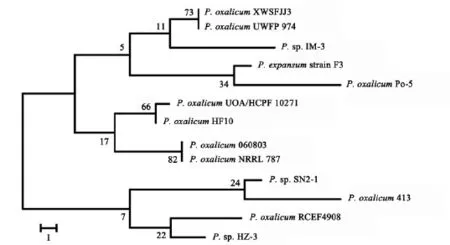
图4 基于L5菌株的ITS序列建立的系统发育树
3 讨论与结论
果胶酶的研究应用迄今已有70多年的历史,其用途广泛,现阶段产量已是世界四大酶制剂之一,而中国现有的生产果胶酶工艺存在着很多问题,如固体发酵成本高、生产率低、易染菌等.面对国外果胶酶产品的优势,我国必须利用丰富的微生物资源,研究新的生产工艺,加紧筛选出拥有自主知识产权、低成本、无污染、满足市场需求的商业化果胶酶.
本研究从污泥中筛选得到一株高产果胶酶的菌株,对其进行了形态学鉴定,并对其进行了ITS测序,确定其为草酸青霉菌.该菌的ITS序列基因已登录GenBank,登录号为:HQ680452.
本研究利用浙江来源丰富的桔皮和米糠作为摇瓶培养基材料,研究表明:该菌株在28℃,培养基初始pH 6.0,转速160 r/min的条件下,培养70 h果胶酶活性最高,可达 39 940 U·min-1·mL-1;并且,该菌株利用成本低廉、天然、含果胶的植物材料为培养基,不仅实现了废物再利用,也可以使其高产.可见,对该菌株的研究具有潜在的意义,其应用前景广阔.
[1]李祖明,张洪勋,白志辉,等.微生物果胶酶研究进展[J].生物技术通报,2010(3):42-49.
[2]Soriano M,Diaz P,Pastor F I.Pectinolytic systems of two aerobic sporogenous bacterial strains with high activity on pectin[J].Current Microbiology,2005,50(2):114-118
[3]武莹浣,叶汉英.果胶酶微生物筛选和酶活测定方法研究[J].食品与机械,2010,26(2):57-60.
[4]薛长湖,张永勤,李兆杰,等.果胶及果胶酶研究进展[J].食品与生物技术学报,2005,24(6):94-99.
[5]彭霞薇,谢响明,白志辉,等.草酸青霉BZH-2002果胶酶系的纯化及其诱导抗病作用[J].应用与环境生物学报,2006,12(6):750-753.
[6]Soares M M C N,Da S R,Carmona E C,et al.Pectinolytic enzyme production by Bacillus species and their potential application on juice extraction[J].World Journal of Microbiology and Biotechnology,2001,17(1):79-82.
[7]张红霞,江晓路,牟海津,等.微生物果胶酶的研究进展[J].生物技术,2005,15(5):92-95.
[8]Blanco P,Sieiro C,Diaz A,et al.Short communication:Differences between pectic enzymes produced by laboratory and wild-type strains of Saccharomyces cerevisiae[J].World Journal of Microbiology and Biotechnology,1997,13(6):711-712.
[9]Saito K,Kawamura Y,Oda Y.Role of the pectinolytic enzyme in the lactic acid fermentation of potato pulp by Rhizopus oryzae[J].Journal of Industrial Microbiology and Biotechnology,2003,30(7):440-444.
[10]张浩森,缪静,余晓斌.果胶酶高产菌株的筛选及产酶条件的研究[J].生物学杂志,2008,25(1):28-30.
[11]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
