Cu/ZrO2催化二乙醇胺氧化脱氢制亚氨基二乙酸性能研究*
2011-12-17李艳妮夏从桥赵亮亮杨元法
李艳妮, 夏从桥, 赵亮亮, 杨元法
(浙江师范大学物理化学研究所,浙江省固体表面反应化学重点实验室,浙江金华 321004)
亚氨基二乙酸(iminodiacetic acid,IDA)是一种应用广泛的化学中间体,主要用于生产除草剂草甘膦,此外还广泛应用于水处理试剂、电镀、农药、橡胶等领域[1-2].自1988年起,国外开始研究制备亚氨基二乙酸的新工艺,即直接使用铜为主催化剂将二乙醇胺低压氧化脱氢制备IDA,并且申请了大量的专利[3-7].近几年国内也开始关注二乙醇胺氧化脱氢制IDA催化剂的研究,重点在提高催化剂的活性或重复使用效果方面展开研究,已取得一定的进展.曾小君等[8]使用非晶态合金制备的骨架铜催化剂,IDA总收率≥95%,催化剂可重复使用24次;杨伟等[9]提出采用骨架铜为主催化剂,以镍、钼和钴等为助催化剂,IDA的最高收率可达98%,但没有报道重复使用的效果;文献[10]采用共沉淀法制备了 Cu/ZrO2催化剂,IDA收率可以达到96%,虽然Cu/ZrO2的催化活性较高,但是重复使用效果不好,稳定性较差.国海光等[11]认为铜基催化剂的活性与其比表面积存在线性关系,催化剂在使用前后物理化学性能发生变化,铜晶粒长大,催化剂比表面积减少,导致催化剂活性位减少,催化剂表面烧结成为铜基催化剂失活的重要原因之一;叶洪平[12]认为碱浓度太高会导致催化剂在反应温度下烧结,降低活性中心的表面积;曾小君等[13]认为增加氢氧化钠用量会提高亚氨基二乙酸的产率,但是用量超过一定值时产率不再明显提高.本文主要考察了碱对Cu/ZrO2催化性能的影响,并分析了引起催化剂活性下降的主要因素,以期对该催化剂的进一步研究有所裨益.
1 实验部分
1.1 催化剂的制备
配制 w(Na2CO3)=10%的溶液 A;配制w(Cu(NO3)2·3H2O+Zr(NO3)4·5H2O)=10%的溶液B,其中n(Cu)∶n(Zr)=1 ∶2.在搅拌下将溶液B缓慢滴加入溶液A中至pH值为10,继续搅拌0.5 h,在80~90℃陈化3 h,洗涤沉淀并烘干、焙烧后,于管形电炉中在氢(10 mL·min-1)/氮(30 mL·min-1)混合气下 230 ℃还原1.5 h,得到的催化剂隔氧保存备用.
1.2 催化剂的表征
催化剂的比表面积采用Quantachrome Autosorb-1型N2物理吸附仪测定,N2吸附曲线在液氮77 K温度下测得,样品比表面积采用BET模型计算得到.样品的孔体积采用BJH(Barrett-Joyner-Halenda)方法和N2吸附-脱附等温线中的脱附线计算.
催化剂的表面形貌采用日本Hitachi S-4800型扫描电子显微镜(SEM)观察,其工作电压为5.0 kV,工作电流为10 μA,工作距离为8.4 mm.
N2O滴定法测定催化剂焙烧后铜的平均粒径.该方法包括2个步骤:1)N2O将Cu(0)氧化为Cu2O;2)表面Cu2O物种的程序升温还原(TPR)测定.在此之前,先用5%H2-95%N2混合气以10℃·min-1的升温速率升温至400℃,然后用氩气吹扫,冷却至60℃,通入N2O(50 mL/min)45 min,将催化剂表面的Cu(0)氧化为Cu2O,再在Ar气氛中冷却至室温后进行TPR测定[14].
1.3 催化剂的性能测试
催化剂的性能评价在FXY-0.1 L高压釜反应器中进行.每次投料5.8 g二乙醇胺、30 mL去离子水和0.8 g催化剂,根据实验设定氢氧化钠的量,通氮气置换反应釜中的空气后,在搅拌下加热至160℃开始计时,此时反应开始并放出氢气,控制不同的温度进行性能测试,当压力升至1.5 MPa时打开控制阀门,开始放气(排水集气计量),控制表压为1.1 MPa,至表压不再升高时结束反应,停止加热,静置冷却至40℃以下,放出余气后往釜内注入80 mL蒸馏水,搅拌(把釜壁上的催化剂收集于溶液中),静置2 h使催化剂充分沉降,通入氮气压出反应物料(底层催化剂重复使用),对物料进行分析,以产物亚氨基二乙酸的选择性、循环次数对催化剂的性能进行评价.采用中生产的PW3040/60型全自动X射线衍射仪上进行,CuKα辐射源,管电压40 kV,管电流40 mA,扫描范围为 20 ~80°,扫描速度为 1.2(°)·s-1.金属Cu粒径大小采用Jade 6.5软件进行拟合计算.样品的XRD衍射峰宽与样品的晶粒大小之间和滴定法分析产物亚氨基二乙酸的选择性(分析亚氨基二乙酸:以Pb(NO3)2溶液做缓冲液,用NaOH溶液滴定,终点pH=5.10;分析副产物甘氨酸:以Cu(NO3)2溶液做缓冲液,用NaOH溶液滴定,终点 pH=4.15).
2 结果与讨论

图1 IDA选择性和反应时间随催化剂循环使用次数的变化
2.1 催化剂在循环使用过程中的性能变化
图1 反映了IDA选择性和反应时间随催化剂循环使用次数变化的关系.结果显示:新鲜的Cu/ZrO2催化剂第1次使用时IDA选择性可达91.2%;在7次循环使用中,IDA选择性可达88.4%以上,催化活性缓慢下降,表现为反应时间延长、IDA选择性逐渐降低;至循环使用第15次时,IDA选择性下降到66.8%,反应时间延长至7 h.说明催化剂在初次使用时表现出较高的活性,随着循环使用次数的增加,催化剂活性呈下降趋势.
2.2 氢氧化钠浓度对催化剂活性的影响
在不同氢氧化钠浓度下于180℃反应的催化剂性能测试结果见表1和图2.表1为在此条件下催化剂第1次使用时的性能测试结果,可以看出,随着氢氧化钠浓度的增加,反应时间逐步缩短.这是因为高浓度的氢氧化钠扩散到活性铜物种中心所需要的时间短[12],加快了反应速率.由图2可知,随着氢氧化钠浓度从10%增大到30%,IDA选择性下降速率逐渐变快,说明氢氧化钠浓度增加虽然缩短了反应时间,却加快了催化剂活性下降的速率.在20%的氢氧化钠存在下反应,催化剂循环使用前7次IDA选择性变化较稳定(达86.2%以上).

表1 IDA选择性和反应时间随NaOH浓度的变化
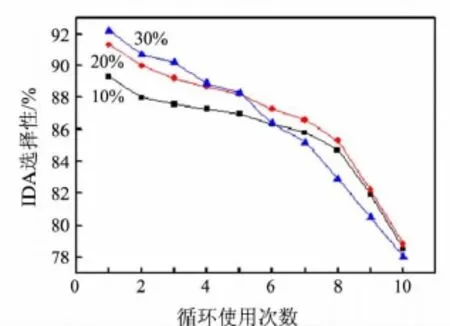
图2 不同质量分数NaOH溶液中IDA选择性随催化剂循环使用次数的变化
2.3 催化剂物理化学性质的测定
从表2可以看出:焙烧后催化剂的比表面积可达 105 m2/g,还原后比表面积增大为 113 m2/g,这可能是因为还原后催化剂的孔体积增大而使比表面积略有增加;使用15次后催化剂比表面积急剧下降为20 m2/g;Cu粒径从还原后的14.8 nm增加到使用15次后的32.4 nm.比表面积降低和Cu粒径增大都会使催化剂活性中心数目减少,进而影响其催化性能.

表2 催化剂的比表面积、孔体积和Cu粒径大小
2.4 催化剂的XRD和SEM分析
图3为催化剂焙烧、还原、使用1次、7次和15次后的XRD衍射谱图.焙烧后,催化剂的衍射峰呈弥散状,在2θ=30°~38°出现一个低而宽的峰,归属为处于亚稳态(介于无定形和四方相之间)ZrO2的峰,没有出现CuO的衍射峰,表明CuO高度分散在ZrO2上,不能被XRD检测出;其对应的SEM照片见图4中A.催化剂在氢气气氛下被还原活化后,于 2θ=43.4°处出现了低而宽的Cu(0)衍射峰,ZrO2的衍射峰几乎没有发生变化,仍处于亚稳态;对应的SEM照片见图4中B,与催化剂活化前形貌相似.新鲜催化剂经反应后,在2θ =30.2°,50.4°和 60°处出现了四方相 ZrO2弱的衍射峰,说明亚稳态ZrO2开始向四方相转变.催化剂循环使用7次后,亚稳态ZrO2完全转变为四方相,Cu(0)的衍射峰增强;对应的SEM照片见图4中C,催化剂已由无定形转为晶态.使用15次后,催化剂中四方相ZrO2和Cu(0)的衍射峰明显锐化,并在2θ=28.4°处出现了单斜ZrO2的衍射峰;其对应的SEM照片见图4中D,可以看到颗粒团聚现象严重.从图3可以看出,在催化剂的循环使用过程中,ZrO2的晶型从亚稳态→四方相→混合相(四方和单斜相)转变.由于亚稳态ZrO2起分散活性铜物种的作用,使Cu颗粒不容易迁移团聚;当亚稳态ZrO2转变为四方晶相或混晶结构时,与Cu的相互作用减弱,Cu晶粒易聚集变大,因此导致催化性能显著下降[15-16].

图3 催化剂的XRD衍射谱图

图4 Cu/ZrO2催化剂的SEM照片
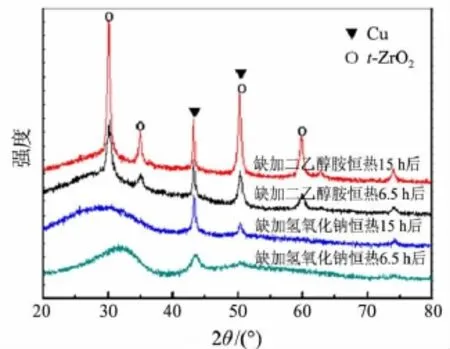
图5 缺加一种原料时180℃反应一定时间后的XRD衍射谱图
图5 是在二乙醇胺氧化脱氢反应体系中分别缺加原料氢氧化钠、二乙醇胺,于180℃反应6.5 h和15 h后的XRD衍射谱图.由图5可知,在缺加二乙醇胺的强碱性体系中:催化剂经恒热反应6.5 h后,能明显观察到催化剂中有活性Cu(0)组分从非晶态转化为晶态,且伴随着亚稳态ZrO2向四方相转变;当恒热反应延长至15 h后,催化剂中Cu(0)和ZrO2的晶化程度更高.而在缺加氢氧化钠的中性体系中:恒热反应6.5 h内仅观察到催化剂中Cu(0)的衍射峰略有增强,ZrO2的衍射峰没有发生变化;当恒热反应延长至15h后,ZrO2的衍射峰仍处于亚稳态,但催化剂中Cu(0)的衍射峰明显锐化.说明:1)在180℃反应条件下,催化剂中活性Cu(0)组分不论在强碱性或中性环境中均会从非晶态向晶态转化,且在强碱性环境中晶化速度较在中性环境中快得多;2)反应体系中的强碱性是促使亚稳态ZrO2向四方相ZrO2转变的因素.在反应过程中,非晶态活性组分Cu(0)在180℃时的自发晶化、亚稳态ZrO2向四方相转变,进而影响活性组分Cu(0)与载体的相互作用,进一步加快活性组分Cu(0)颗粒的长大,这两个因素导致催化剂活性随着循环使用次数的增加而逐渐下降.
3 结论
在180℃反应条件下,共沉淀法制备的Cu/ZrO2催化剂在强碱性环境中,其活性Cu(0)组分会自发从非晶态向晶态转化,亚稳态ZrO2也能自发向四方相ZrO2转变.在Cu/ZrO2催化剂的循环使用过程中,由于非晶态活性组分Cu(0)的自发晶化及亚稳态ZrO2向四方相转变,进而影响了活性组分Cu(0)与载体的相互作用,加快了活性组分Cu(0)颗粒的长大,这两个因素导致催化剂的活性随着循环使用次数的增加而逐渐下降.
[1]陈静,张海良,杨旭,等.一种提高亚氨基二乙酸分离收率的方法[J].农药,2009,48(11):803-810.
[2]徐六兴,许文松,王蓓,等.草甘膦中间体亚氨基二乙酸合成新工艺[J].农药,2006,45(11):751-753.
[3]Bishop J J,Northford C,Jache A W,et al.Preparation of alkalimetal salt of nitrilotriacetic acid:US,3578709[P].1971-05-11.http://www.pat2pdf.org/.
[4]Marquis E,Schulze H.Preparation of aminocarboxylic acids from aminoalcohols:US,3842081[P].1974-10-15.http://www.pat2pdf.org/.
[5]Kawasaki Y U,Kadono Y,Goto T.Process for producing aminocarboxylic acid salts:US,5220055[P].1993-06-15.http://www.pat2pdf.org/.
[6]Goto T,Yokoyama H,Nishibayashi H.Method for manufacture of amino-carboxylic acid salts:US,4782183[P].1988-11-01.http://www.pat2pdf.org/.
[7]Urano Y,Kadono Y,Goto T.Process for producing aminocarboxylic acid salt:US,5220054[P].1993-06-15.http://www.pat2pdf.org/.
[8]曾小君,杨高文,杨刚,等.非晶态合金催化剂用于二乙醇胺脱氢氧化制备亚氨基二乙酸的研究[J].精细化工,2001,18(10):608-610.
[9]杨伟,刘仲能,侯闽渤.用于制备亚氨基二乙酸盐的催化剂:CN,01126292.3[P].2001-07-20.http://www.sipo.gov.cn/sipo2008/zljs/.
[10]叶洪平,段正康,杨运泉,等.二乙醇胺脱氢催化剂Cu/ZrO2的制备条件研究[J].工业催化,2004,12(1):48-52.
[11]国海光,韩文锋,沈菊李,等.铜基合成甲醇催化剂失活研究进展[J].工业催化,2003,11(3):39-42.
[12]叶洪平.用于二乙醇胺催化脱氢制备亚氨基二乙酸盐的Cu/ZrO2催化剂的制备与研究[D].湘潭:湘潭大学化工学院,2004.
[13]曾小君,杨高文,杨刚,等.脱氢氧化法合成亚氨基二乙酸[J].化学研究与应用,2001,13(6):657-660.
[14]Chary K V R,Sagar G V,Srikanth C S,et al.Characterization and catalytic functionalities of copper oxide catalysts supported on zirconia[J].J Phys Chem B,2007,111(3):543-550.
[15]段正康,杨运泉,熊鹰,等.用于二乙醇胺催化氧化脱氢的Cu-ZrO2催化剂的制备与表征[J].精细化工,2002,19(7):412-417.
[16]夏从桥.二乙醇胺脱氢氧化制亚氨基二乙酸Cu/ZrO2催化剂的研究[D].金华:浙江师范大学化学与生命科学学院,2010.
