微生物果胶酶的研究进展
2020-09-18杨同香吴孔阳白云飞陈俊亮万苏艳杨如梦
杨同香 - 吴孔阳 - 白云飞 - 陈俊亮 - 万苏艳 - 杨如梦 -
(1. 河南科技大学食品与生物工程学院,河南 洛阳 471023;2. 洛阳师范学院生命科学学院,河南 洛阳 471934;3. 河南三剑客农业股份有限公司,河南 漯河 462000)
果胶酶是水解酶家族的成员,是一类能够降解果胶分子的多种酶的总称,包括聚半乳糖醛酸酶(polygalacturonase,PG)、果胶酯酶(pectin esterase,PE)和果胶酸裂解酶(pectate lyase,PL)等[1]。果胶酶在全球食品酶制剂市场中占有25%的份额,另外在纺织工业、造纸工业、医药工业、废水处理、动物饲料生产及原生质体融合等诸多领域应用广泛[2]。果胶酶广泛存在于动物、植物及微生物体内。由于受原料、提取工艺及季节等诸多因素限制,果胶酶主要由微生物发酵制备。与许多其他工业酶一样,果胶酶在生产中也面临逐步提高产量、生产率等问题[3]。目前,中国对微生物果胶酶开展了广泛的研究,但是缺乏较为系统的分析和概况。鉴于此,文章就高产果胶酶菌株的筛选、育种技术、影响产酶因素、酶的生化性质以及酶的固定化进行综述,以期进一步推动果胶酶的理论和应用研究。
1 高产果胶酶菌株的筛选
微生物果胶酶的来源广泛,细菌、放线菌及真菌等均能产生。由于果胶分子主要是α-1,4连接的D-半乳糖醛酸残基组成[4],因此分离培养基中的碳源通常是果胶,且作为唯一碳源。目前报道筛选产果胶酶菌株的方法主要有刚果红法、碘试剂法和溴酚蓝法。例如,Zhou等[5]以果胶为唯一碳源,平板培养后经刚果红染色筛选,从烟叶中分离得到一株果胶酶活力高的菌株BacillussubtilisPB1。但也有学者[6-7]使用了其他试剂进行筛选,例如,谭秀华[6]在菌落周围加入1% CTAB,静置15 min后,通过观察是否有无色透明圈产生来筛选果胶酶产生菌,并得到一株枯草芽孢杆菌。另外利用钌红也可以辅助筛选果胶酶产生菌[8-10]。当然,研究人员[11-13]也可以不借助指示剂或染料所形成的透明圈、变色圈等进行筛选,还可以通过直接测定果胶酶活性来筛选。例如,宁振兴等[11]在含有广西六堡茶的蔗糖察氏液体培养基分离纯化菌株,并通过测定果胶酶和纤维素酶活性,筛选得到一株能高效降解梗丝果胶和纤维素的塔宾曲霉(Aspergillustubingensis)。对于想要获得某一特定类群的微生物时,往往在培养基中加入抗生素来抑制其他微生物的生长。例如,Haile等[14]在分离具有果胶酶活性的酵母菌时,在YPDA培养基中加入0.01%的青霉素来抑制细菌的生长,并筛选得到多株具有果胶酶活性的酵母菌,如表1中所示。而杨斯超[15]则通过在YPD培养基中加入链霉素和氯霉素来抑制细菌,并筛选得到一株产果胶酶的酵母菌PPY-1。
从上述筛选的菌株以及表1中展示的微生物类型可以看出,目前报道的果胶酶产生菌主要以丝状真菌和芽孢杆菌为主,也有学者[16-17]发现一些酵母菌和欧文氏菌产果胶酶。对于低温果胶酶菌株的筛选,学者们[18-19]也开展了相关研究。例如,在南极海绵中发现的南极真菌Geomycessp F09-T3-2,在低温条件下表现出较高的果胶酶活性,表明该菌株在低温果胶酶领域具有潜在应用价值[18]。总的来说,在分离产果胶酶菌株时,要结合各种方法的特点和试验条件进行筛选。比如刚果红染色法,一般果胶用量少,灵敏度高,难点是要控制好染色时间,而CTAB法则是果胶用量大,使用受限。

表1 近5年报道产果胶酶的菌株
2 果胶酶菌株的育种
2.1 诱变育种
诱变育种是目前工业菌种选育常用的方法,尽管常规的物理或化学诱变方法工作量大,育种效率稍低,但仍然是果胶酶高产菌株选育的重要方式[33]。通过这些方式获得的高产突变菌株,其酶活性较出发菌株均有较大幅度提高,其中杜国军等[34]采用亚硝酸—紫外线对黑曲霉HY-D3进行诱变处理,突变株HY-LL3酶活力达到了3 124 U/g,提高了3.59倍。同样黄丹梅等[35]采用紫外线对黑曲霉菌株诱变,突变株的酶活力提高了3倍。此外,微波诱变方法可以获得高产果胶酶菌株。例如,何海燕等[36]利用微波照射诱变处理棘孢曲霉D80菌株,筛选出一株酶活力大幅度提高的正突变菌株DW75,是出发菌株D80酶活的2.47倍。
值得提出的是,近年来新发展的常压室温等离子体(Atmospheric and room temperature plasma,ARTP)诱变育种技术已成功应用于细菌和真菌等微生物,在生物育种领域应用上表现出十分出色的诱变效果,具有突变快、突变多样性高、简单易行等优势,已成为高效快速诱变微生物基因组的有效方法之一[37-38],而目前利用该技术来选育果胶酶菌株还鲜有报道,今后可以尝试将其作为果胶酶菌株选育的一种策略。
2.2 基因工程育种
为提高果胶酶产生菌的产酶水平,学者们尝试利用基因工程技术开展果胶酶菌种的选育。目前应用于果胶酶工程菌构建的系统主要是大肠杆菌表达系统和酵母表达系统。其中大肠杆菌表达系统是目前表达外源蛋白的首选,例如,Yuan等[39]将多黏类芽孢杆菌KF-1果胶酸裂解酶基因PpPel9a在大肠杆菌BL21(DE3)中表达,以PGA作为底物,其最高酶活力达到(117.40±4.82) U/mg。Tang等[40]将马赛属细菌M.eurypsychrophila果胶酸裂解酶基因pel1克隆,在大肠杆菌BL21(DE3)中成功表达,以0.2%的PGA为底物,其比活力达到78.75 U/mg。Liu等[41]选择大肠杆菌BL21(DE3)表达了来源于枯草芽孢杆菌JL-13果胶酸裂解酶基因,结果重组酶比活力高达(197.40±5.20) U/mg。Zhou等[42]利用大肠杆菌表达系统成功实现了来自克劳氏芽孢杆菌BacillusclausiiS10果胶酸裂解酶基因的过量表达,其比活力高达675.5 U/mg。而同样的表达系统过量表达地衣芽孢杆菌Bacilluslicheniformis91果胶酸裂解酶,其比活力最高为320 U/mg。相比较于原核表达系统,真核表达系统的发展则较为缓慢。但随着对其表达机制的深入研究,来源于高等生物的基因更适合于真核生物表达系统来表达。比如Aspergillusluchuensisvar.saitoi果胶酸裂解酶基因AsPelA,研究人员将其克隆并在毕赤酵母KM71H中表达,发现经过热处理后重组酶还能达到未处理前64%的酶活力[43]。此外,研究人员还尝试了将微生物源果胶酶基因在动物细胞中表达的研究,莫健新等[44]通过脂质体转染法将构建的携带有微生物源果胶酶基因pg5a、pgI、pga3A和pgaA的真核表达载体转入猪PK15细胞中进行异源表达,结果发现4种果胶酶基因均能在猪PK15细胞中转录出mRNA,但只有pg5a和pgI可以表达出有活性的果胶酶,最高酶活为0.95 U/mL。
2.3 分子定向进化育种
利用结构生物信息学、酶工程等技术对酶进行合理的改造,成为进一步提高酶活性和稳定性的重要手段,也成为获得具有商业价值酶的潜在途径[45]。科研人员[46]从芽孢杆菌Bacillussp. N16-5果胶酸裂解酶基因(spPelA)出发,通过易错PCR构建随机突变体文库,经过两轮易错PCR,从上万个突变体中筛选出10个热稳定性增强的突变体,其中热稳定性好的组合突变体EAET较野生型Bacillussp. N16-5果胶酸裂解酶酶活性增加了140倍。Wang等[45]采用易错PCR对来源于Bacillussubtilis168果胶酸裂解酶基因进行随机突变体文库构建,利用高通量筛选方法分离出5个果胶酸裂解酶活力较高的突变体。与Bacillussubtilis168果胶酸裂解酶相比,突变体K47E的活力最高。此外,该研究还结合点饱和突变技术进一步筛选,获得的K47D/V132F酶活力更高,其比活力是Bacillussubtilis168的3.9倍。不仅如此,通过点饱和突变和随机突变技术处理短小芽孢杆菌Bacilluspumilus(ATCC 7061)时,也取得了满意效果。
除上述育种方法外,DNA改组技术(DNA shuffling)也被应用于果胶酶菌株的改造。例如,Yu等[47]将出发菌株枯草芽孢杆菌ZGL14进行紫外—60Co辐射诱变处理,以获得的5株突变株和ZGL14为亲本菌株进行融合,结果发现经过两轮DNA改组技术,得到一株酶活力达到499 U/mL的突变株FS105,其酶活力较出发菌株提高了1.6倍。
3 影响果胶酶产量的因素
在工业酶制剂生产上,主要通过固态发酵和液体深层发酵技术完成,目前所报道的果胶酶生产亦是如此。近年来,果胶酶的固态发酵和液态深层发酵均有报道。除菌株自身差异外,外部环境条件对果胶酶的发酵生产影响较大,主要包括培养基成分和发酵条件和方式等。
3.1 培养基组成
目前工业上果胶酶生产菌主要是黑曲霉,作为食品级果胶酶的生产菌株,其安全性也得到普遍认可。另外在培养基优化方法选择上,响应面优化方法应用较为广泛[17, 48-50]。另外在基质选择上,廉价的麸皮往往会成为果胶酶生产的重要原料[51]。Bibi等[29]以农副废弃物粗级提取的木聚糖和果胶、麸皮和桔皮为底物,通过响应面优化了BacilluspumilusAJK液体发酵生产木聚糖酶和果胶酶条件,结果发现在最适底物浓度下,木聚糖酶和果胶酶或性最高分别达到(415.22±18.50),(109.10±8.80) IU/mL,进一步分析得出,该菌株具有多种果胶酶活性,其中外切聚甲基半乳糖醛酸酶18.98 IU、内切聚甲基半乳糖醛酸酶0.14 IU,外切多聚半乳糖醛酸酶80 IU,内切多聚半乳糖醛酸酶0.28 IU,聚甲基半乳糖醛酸裂解酶1.42 IU,聚半乳糖醛酸裂解1.47 IU以及果胶酯酶0.15 IU。
培养基中碳源、氮源以及无机盐等对菌株产酶的影响不同。菌体生长依赖于合适的碳源和氮源,Abdullah等[52]在优化黑曲霉ABT-5产果胶酶培养条件时,发现当果糖和尿素作为碳源时可获得最大果胶酶活力。Amin等[53]研究发现在固态发酵工艺下,当初始pH 3.0、35 ℃、含有甘氨酸、果胶和MnSO4存在时,Penicilliumnotatum产多聚半乳糖醛酸酶活性较高,而在初始pH 5.0、30 ℃、湿度50%、含有CaCO3、(NH4)2SO4、乳糖作为营养源时,Coriolusversicolor产多聚半乳糖醛酸酶活性较高。Chen等[54]以中药皂甙提取物为底物,利用枯草芽孢杆菌发酵生产蛋白酶和果胶酶,初步优化后果胶酶活力达到227 U/mL,而当在提取物中加入5%葡萄糖发酵后,果胶酶活力可达到1 390 U/mL。以上研究表明,在遵循微生物基本生长特性情况下,尝试采用不同的营养成分以及进行合理组合对提高果胶酶产量起到积极的作用。
3.2 发酵条件和方式
表2展示了近年来有关微生物果胶酶发酵条件研究的报道。有关微生物果胶酶发酵条件优化方法也是以响应面优化试验居多[55-58]。例如,Mahesh等[57]利用响应面法优化了Aspergillusibericus果胶酶发酵条件,结果发现当pH 4.0、发酵温度40 ℃、发酵时间120 h,以2%果胶为底物的情况下,该菌株所产果胶酶活力达到69.6 U/mL。Bibi等[59]通过中心组合试验优化Bacilluslicheniformis果胶酶发酵条件,确立了pH、温度、接种量等参数,在最优条件下该菌所产果胶酶活力达到219 U/mL。Ortiz等[60]研究了AspergillusgiganteusRRL10产果胶酶的固态发酵工艺,通过响应面试验设计筛选出RRL10产酶条件,确定了pH、温度和CaCl2是影响产酶的重要因素。此外,Kaur等[61]优化了BacillussubtilisSAV-21固态发酵条件,发现在温度35 ℃,湿度60%、pH 4.0,发酵96 h时果胶酶活力最高。
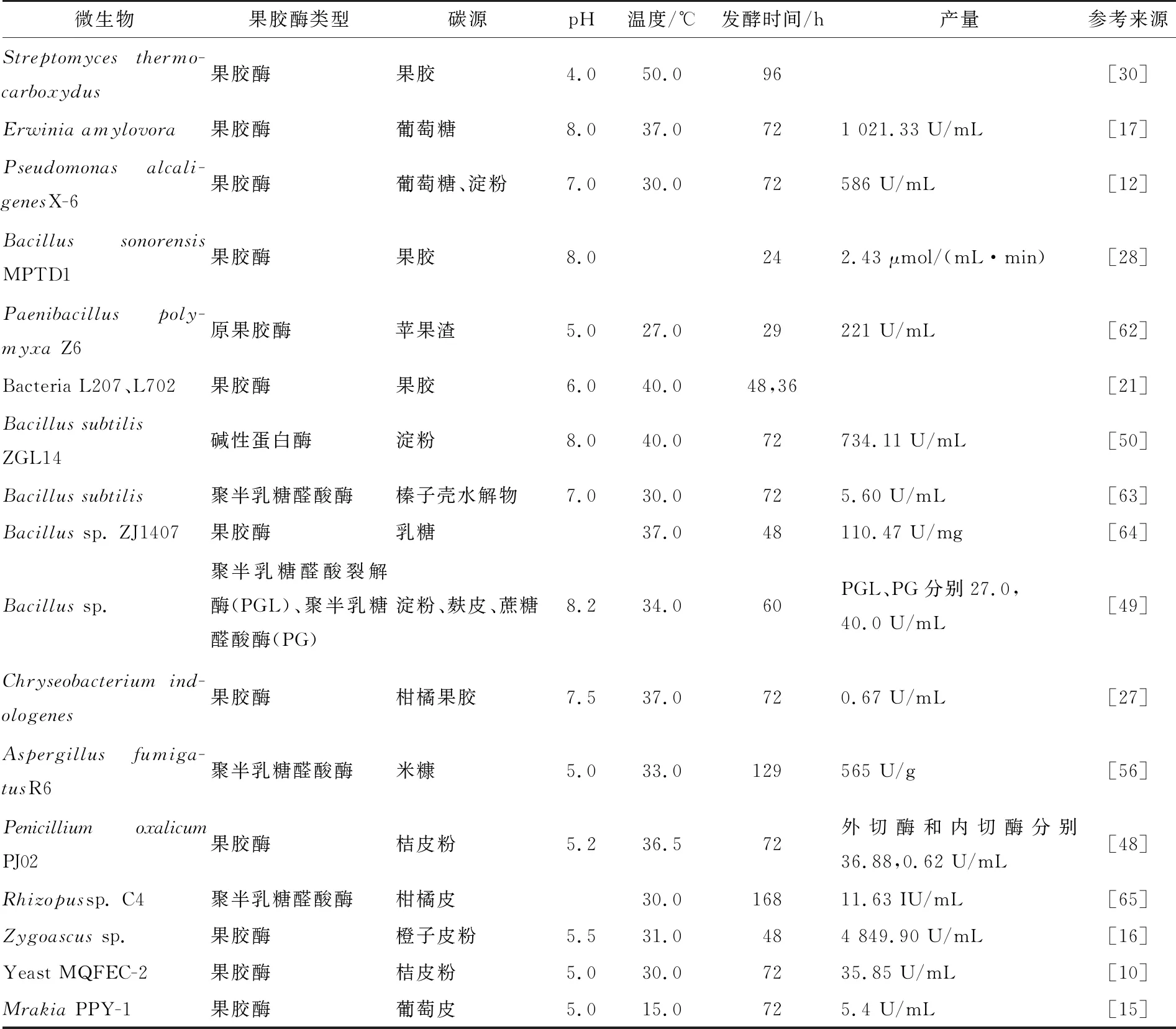
表2 不同菌株的果胶酶发酵条件及产量†
相比于培养基和发酵条件对果胶酶菌株产酶影响,细胞固定化也是影响菌株产酶的一个因素[66-67]。例如,Ejaz等[67]研究了固定化GeotrichumcandidumAA15细胞产果胶酶的参数,结果发现固定化GeotrichumcandidumAA15果胶酶酶活性为0.554 IU/mL,远高于游离细胞0.215 IU/mL的酶活。之后,Ahmed等[66]对比了GeotrichumcandidumAA15细胞在游离状态下和固定化状态下对产果胶酶的影响,同样发现经玉米芯固定化的GeotrichumcandidumAA15表现出更高的酶活性,且不表现出分解代谢物阻遏作用。
4 微生物果胶酶的生化性质
从报道的果胶酶分子量来看,多数微生物果胶酶的分子在30.0~70.0 kDa,如Kumar等[68]报道的芽孢杆菌和放线菌果胶酶的分子量分别是34.9,45.1 kDa。不同菌株之间果胶酶分子量差别较大,即使同一种果胶酶,分子量也有差异。Barma等[69]报道的黑曲霉果胶酶分子量在34.0~42.0 kDa,而Anand等[70]报道的黑曲霉MTCC478所产的外切聚半乳糖醛酸酶分子量为124.0 kDa。一般细菌果胶酶最适温度相对于真菌果胶酶而言相对较高,能够达到50~60 ℃,但是也要注意有些真菌外切聚半乳糖醛酸酶最适温度能够达到60~65 ℃[71-72],Tounsi等[73]报道的Penicilliumoccitanis聚半乳糖醛酸酶最适温度甚至高达70 ℃。对于最适pH研究,可以发现细菌果胶酶主要集中在pH 7.5~10.0,而真菌果胶酶最适pH主要集中在pH 4.0~7.0,当然也有部分碱性果胶酶菌株存在。通过对比可以看出,微生物果胶酶可能具备在各种复杂环境条件下降解基质的特性,并具有较为广泛的适应性。针对微生物果胶酶pH稳定性、温度稳定性等研究,可以发现一些真菌果胶酶通常都具有良好的热稳定性和pH稳定性,Bennamoun等[7]发现Aureobasidiumpullulans在最优培养条件下,其所产果胶酶在5~90 ℃、pH 5.0~10.0范围内稳定,最适温度和pH分别为60 ℃和5.0。Ma等[74]报道的黑曲霉SW06外切聚半乳糖醛酸酶在pH 3.0~5.0、温度60 ℃以下稳定。另外研究人员[64,75]发现不同金属离子对果胶酶活性影响显著,其中Fe3+、Ba2+、Ca2+、Cu2+等对酶活力有提高作用,而Mn2+、Ag+对酶活力有抑制作用。不过在已有研究[76]中发现Ca2+也能够抑制外切聚半乳糖醛酸酶活性。因此对于金属离子对酶活性的影响,也要因菌株差异而加以确定。
此外,Bekli等[77]比较了源于解淀粉芽孢杆菌BacillusamyloliquefaciensS6果胶酸裂解酶和重组果胶酸裂解酶(PelS6)的生化性质。结果发现PelS6与枯草芽孢杆菌Bacillusamyloliquefaciens168果胶酸裂解酶的氨基酸序列同源性为100%。虽然这两者在基因序列上非常接近,但在生化性质上却差异显著,相比较Bacillusamyloliquefaciens168的酶活力(12.8±0.3) U/mg,重组酶活力更高,达到(49.6±0.4) U/mg。
5 果胶酶的固定化研究
酶固定化研究已形成了相对完善的技术体系,包括固定酶的载体材料体系和无载体固定化体系。目前果胶酶固定化以及应用已有诸多研究报道[78-79],主要从固定化载体、固定化条件对酶活性影响等方面进行介绍。
用于固定化的载体材料有很多种,如无机载体、磁性纳米材料、天然高分子和合成高分子载体等。其中磁性纳米材料以其可控的尺寸、比表面积大以及良好的生物相容性等特性广泛应用于果胶酶的固定化研究中[80-81]。例如,Fang等[82]开展了磁性复合材料Fe3O4@SiO2-NH2固定果胶酶的研究,结果发现固定化果胶酶在循环利用7次后仍保持64.4%的酶活性,且贮藏30 d后还能保持21.1%的酶活性。同样Dal-Magro等[83]报道磁性壳聚糖固定果胶酶的研究,结果发现在橙汁澄清处理工艺中,固定化的果胶酶循环使用25次后,仍然能保持85%的酶活性,这与de Oliveira等[84]报道海藻酸钠固定化Aspergillusaculeatus果胶酶处理苹果汁所起的作用相似。从这些研究中可以看出,利用这些磁性复合材料的应用极大地提高了果胶酶的重复利用率。
由于固定化酶的活性受载体类型、粒径、交联剂、缓冲体系以及超声波等诸多因素影响[85-86],因此在果胶酶固定化研究过程中也应重视。例如,Alagöz等[87]发现分别使用戊二醛和3-GPTMS将果胶酶固定在弗罗里硅土和纳米二氧化硅上,用3-GPTMS参与固定的果胶酶完全失去了活性,而用戊二醛固定在弗罗里硅土和纳米二氧化硅上的果胶酶分别保留了10%和75%的酶活性,而且纳米二氧化硅固定化的果胶酶催化效率比固定在弗罗里硅土的果胶酶高6.3倍。Rehman等[88]研究了琼脂包埋法固定化果胶酶的条件,结果发现当琼脂用量增加到3%时,固定化的果胶酶活力达到最高。同时还发现与游离酶相比,固定化的果胶酶最适反应温度和最适反应pH均发生了变化,分别由原来的45 ℃变为50 ℃,pH由10.0变为9.0。最适反应温度变化可能与固定化果胶酶反应需要更多的活化能有关,而最适pH发生改变则与在包埋微环境下果胶酶结构和构象稳定性有关。Mahesh等[57]采用纳米多孔活性炭固定化Aspergillusibericus果胶酶,同样发现与游离酶相比,固定化果胶酶热稳定得到提高。此外,Mahmoud等[89]比较了绿色木霉Trichodermaviride果胶酶在游离态、海藻酸钠微胶囊以及海藻酸钠纳米胶囊固定化条件下性质变化。其中纳米胶囊固定化果胶酶最适pH与游离酶相比,由原来的pH 6.0变为4.5,这与Rehman等[88]研究结果相似,同时经过固定化的果胶酶,pH稳定性和温度稳定性也会发生变化,固定化的果胶酶对酸和温度的耐受性进一步提高。
6 展望
果胶酶因其良好的生物催化功能而广泛应用于各类工业催化过程中。随着对微生物果胶酶的深入研究和应用实践,人们期望获得纯度更高、价格更为低廉的果胶酶。与此同时,中国学术界及产业界在果胶酶菌种筛选、诱变育种、工程菌构建、发酵工艺优化以及酶的固定化等方面进行了长期的研究和探索,使得具有各种特性的微生物果胶酶进一步应用成为可能。
结合中国微生物果胶酶研究现状,笔者认为今后在以下几个方面仍需要加强科学研究:① 如何开发热稳定性更高的耐高温果胶酶以及能够更好适应酸性或碱性环境下的果胶酶;② 如何构建过量表达的优良工程菌株;③ 如何开发先进的发酵工艺,有效提高生产效率及降低成本;④ 加强果胶酶固定化研究开发工作,进一步提高酶的稳定性以及重复利用率。另外从果胶酶的分子进化研究来看,依赖于生物信息学、蛋白质工程及分子生物学技术等,也有望获得具有全新特性的果胶酶并应用于新的领域,这也将是微生物果胶酶研究的一个重要方向。总的来说,筛选性能更好的果胶酶产生菌、加强优良菌种选育以及上下游发酵工艺的优化是个长期过程。
