SUD-35/羟丙基-β-环糊精包合物的制备及其小鼠体内药效学初步研究
2011-11-17潘振华刘焕龙陈雪彦向柏方瑜张永健
潘振华,刘焕龙,陈雪彦,向柏,方瑜,张永健#
(1.河北医科大学药学院,石家庄市050017;2.河北医科大学药理教研室,石家庄市 050017;3.河北医科大学附属第二医院药剂科,石家庄市 050003)
SUD-35/羟丙基-β-环糊精包合物的制备及其小鼠体内药效学初步研究
潘振华1*,刘焕龙2,陈雪彦3,向柏1,方瑜1,张永健3#
(1.河北医科大学药学院,石家庄市050017;2.河北医科大学药理教研室,石家庄市 050017;3.河北医科大学附属第二医院药剂科,石家庄市 050003)
目的:制备苯甲酰脲类微管微丝抑制剂SUD-35/羟丙基-β-环糊精包合物(SUD-35/HP-β-CD),以提高SUD-35的水溶性和稳定性,并对其小鼠体内药效学进行初步考察。方法:采用饱和水溶液法,以SUD-35/HP-β-CD投药比(A)、包合温度(B)、包合时间(C)、搅拌速度(D)为考察因素,以包合率为考察指标,设计正交试验筛选最佳制备工艺并进行验证试验和溶解度测定;以差示扫描量热(DSC)法及X射线衍射(XRD)法验证包合物;对肝癌H22细胞实体瘤模型小鼠腹腔注射包合物低、中、高剂量(以SUD-35计)每日1次,共7 d,计算末次给药后24 h的抑瘤率,并与环磷酰胺比较。结果:最佳制备工艺为A:1∶5,B:50℃,C:60 min,D:100 r·min-1;以此工艺所制3批包合物的平均包合率约为75.8%;SUD-35原料及其包合物在水中的溶解度分别为0.000 32、0.65 g·L-1;DSC和XRD法证实包合物形成;低、中、高剂量抑瘤率分别为(38.25±0.57)%、(63.45±1.20)%、(69.26±1.15)%,环磷酰胺组为(71.52±1.16)%。结论:SUD-35/HP-β-CD包合物的制备工艺简便、易行,可极大地提高SUD-35的水溶性,其高剂量对肝癌H22细胞在小鼠体内的生长具有与环磷酰胺相似的抑制作用。
微管微丝抑制剂;SUD-35;羟丙基-β-环糊精;包合物;正交试验;小鼠;肝癌H22细胞;抑瘤率
微管和微管蛋白是靶向筛选抗肿瘤药物的筛选模型之一。微管微丝抑制剂通过干扰细胞分裂中纺锤体的形成使细胞停滞在有丝分裂中期,阻断细胞分裂增殖,同时由于微管微丝是信号转导和物质运输的通道,干扰微管微丝的形成可影响与凋亡相关的信号转导通路引起细胞凋亡,该类药物称为微管微丝抑制剂。随着紫杉醇的出现和人们对于微管微丝生物学特性的认识[1],微管微丝类抗肿瘤药物的研究与开发日益引起人们的关注与兴趣。SUD-35(其分子量为419,属苯甲酰脲类,化名名称为N-[4-(4,6-二甲氧基-2-嘧啶氧基)-3-甲基苯基]-N′-[2-(二甲氨基)]苯甲酰脲)是我院药物化学教研室全合成的新型小分子微管微丝抑制剂。由于其几乎不溶于水,因此将其制成制剂必须首先解决其溶解性的问题,而对药物进行包合则是一种解决之法。羟丙基-β-环糊精(Hydroxypropyl-β-cyclodextrin,HP-β-CD)是一种低毒、安全、有效的水溶性包合材料[2]。本试验采用饱和水溶液法,通过正交试验设计,优选出最佳包合工艺,制备了SUD-35/HP-β-CD包合物,并对其进行了初步的小鼠体内药效学考察,为其制剂的制备和临床应用提供了基础和依据。
1 仪器与材料
1.1 仪器
差示分析仪(美国PerkinElmer公司);D/max2400转靶X射线衍射仪(日本理学株式会社);TU-1901型双光束紫外-可见分光光度计(北京普析通用仪器设备有限责任公司);DF-101S型集热式恒温加热磁力搅拌器(巩义市予华仪器厂);HR型分析天平(日本AND公司);精密pH计(上海雷磁仪器厂)。
1.2 试药
SUD-35对照品(批号:090615,含量:99.1%)、SUD-35原料药(批号:090618,含量:99.0%)、SUD-35/HP-β-CD包合物(批号:091216,含药量:10.8%)均为河北医科大学药学院药物化学教研室自制;HP-β-CD(西安德立生物化工有限公司,取代度:5.2);注射用环磷酰胺(通化茂祥制药有限公司,批号:091001,规格:每支0.2 g);其他试剂均为分析纯。
1.3 动物
6~8周龄清洁级昆明种小鼠,体重18~22 g,♀♂各半,由河北医科大学实验动物中心提供,合格证号:医动字第602086号。
1.4 细胞株
小鼠肝癌H22瘤株,由河北医科大学药理教研室提供。
2 方法与结果
2.1 包合物含量测定方法
2.1.1 测定波长的选择。精密称取SUD-35对照品及HP-β-CD适量,分别制备成一定浓度的80%甲醇溶液,在200~400 nm波长范围内扫描,结果表明,SUD-35在232 nm波长处有最大吸收,而HP-β-CD在此处无干扰,故选232 nm波长为测定波长。光谱见图1。
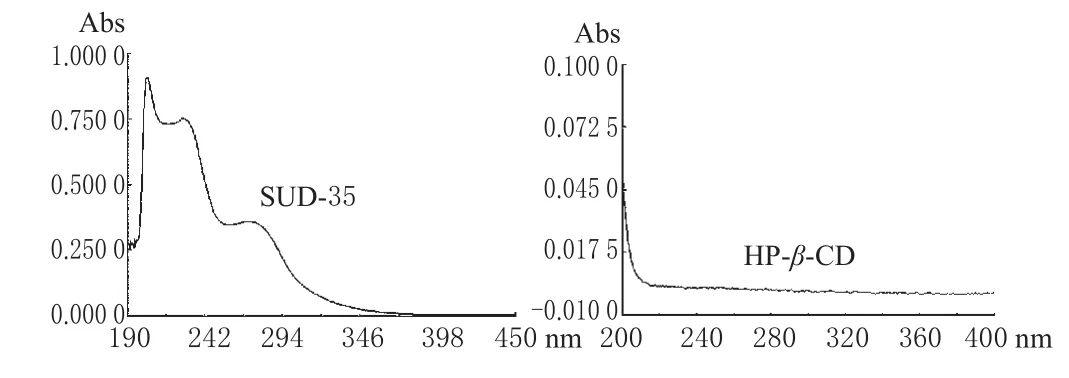
图1 紫外扫描光谱图Fig 1 UV scanning spectrum
2.1.2 标准曲线的制备。精密称取SUD-35对照品20 mg,置于100 mL容量瓶中,加80%甲醇溶解并稀释至刻度,作为贮备液。精密量取贮备液0.5、1.0、2.0、3.0、5.0、6.0 mL,置于100 mL容量瓶中,加80%甲醇稀释至刻度,摇匀,在232 nm波长处测定吸光度(A),以吸光度对浓度(c)进行线性回归,得回归方程为A=0.080 2c+0.000 3(r2=0.999 6)。结果,SUD-35检测浓度线性范围为1.0~12.0 μg·mL-1。
2.1.3 回收率试验。分别精密吸取对照品贮备液制备低、中、高(1.0、6.0、12.0 μg·mL-1)3种浓度的样品,加入相应量的HP-β-CD(摩尔比为1∶1),测定吸光度,计算平均回收率为98.82%,RSD=0.57%(n=6)。
2.1.4 精密度试验。取“2.1.3”项下制备的低、中、高3种浓度溶液,按相关方法分别测定日内及日间精密度,测得日内RSD分别为0.71%、0.39%、0.47%(n=6);日间RSD分别为0.46%、0.64%、0.53%(n=6)。
2.1.5 溶液稳定性试验。用80%甲醇制备浓度为6 μg·mL-1的对照品溶液,在室温下放置1、2、4、8、12、24 h,在232 nm波长处测定其吸光度,结果RSD=0.51%,表明溶液在24 h内稳定。
2.2 包合物的制备[3,4]
2.2.1 包合物的制备。采用饱和水溶液法,制备SUD-35/HP-β-CD包合物:精密称取HP-β-CD,加蒸馏水适量,搅拌制成一定温度下的饱和溶液。另精密称取一定量的SUD-35,用适量甲醇溶解后,不断搅拌下缓缓滴入HP-β-CD饱和溶液中,恒温搅拌至规定时间,放冷至室温,置于冰箱中冷藏24 h后取出,抽滤,沉淀用适量甲醇洗涤,收集沉淀物,低温真空干燥,得白色粉末状包合物。
2.2.2 SUD-35/HP-β-CD包合物最佳制备工艺的选择。根据预试验结果,选择SUD-35/HP-β-CD投药比(A)、包合温度(B)、包合时间(C)、搅拌速度(D)为考察因素,各取3个水平,用L9(34)正交试验表设计试验方案。以SUD-35包合率(包合物中SUD-35含量/投料量值)作为评价指标筛选最佳工艺条件。其因素水平见表1,试验设计及结果分析见表2、表3。
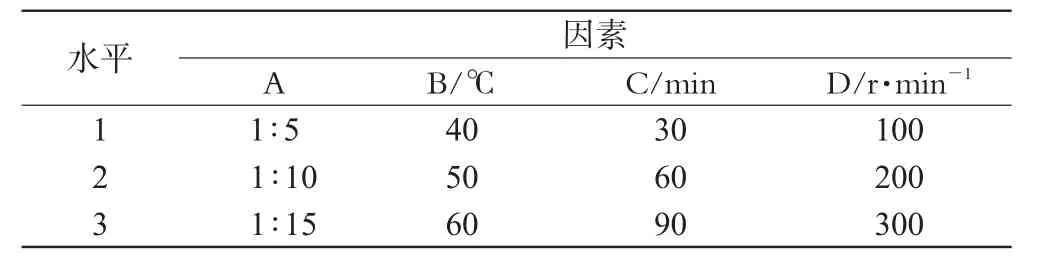
表1 因素水平表Tab 1 Factors and levels
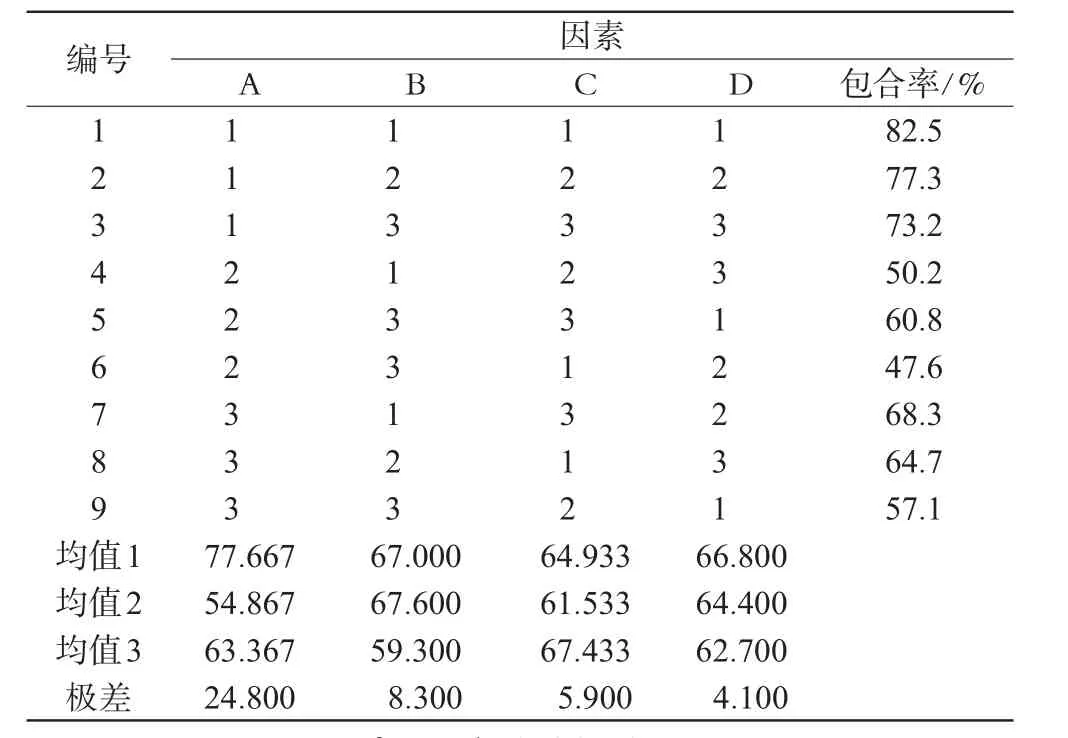
表2 正交试验结果Tab 2 Results of orthogonal experiment
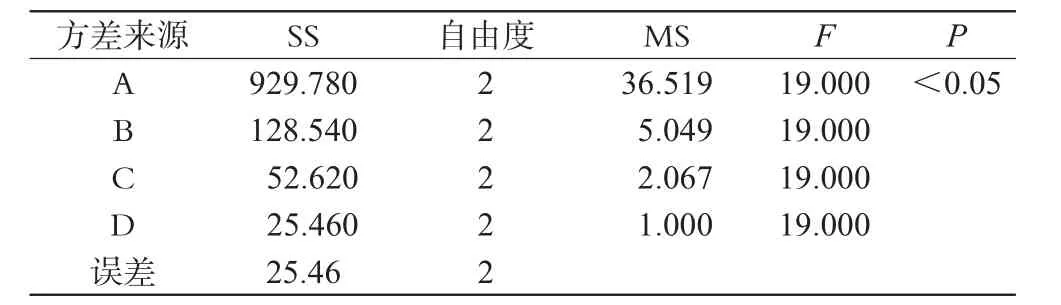
表3 方差分析结果Tab 3 Results of variance analysis
由表2可知,4因素对评价指标影响程度由大到小排列顺序为A>B>C>D,即投药比影响最大,搅拌速度影响最小。由表3可知,因素A对SUD-35的包合有显著性影响,因此结合实际情况选定最佳包合工艺条件为A1B2C3D1,即SUD-35与HP-β-CD投药比为1∶5,包合温度为50℃,包合时间为90 min,搅拌速度100 r·min-1。
按上述优选确定的方法制备包合物样品,共3批,结果其包合率分别为74.9%、78.5%、74.0%。表明用最佳处方及工艺制备的包合物包合率较高,平均包合率为75.8%(n=3),且结果稳定、可靠。
2.2.3 溶解度试验[5]。取SUD-35及其包合物适量,分别加新沸放冷的水制备成饱和溶液,涡旋30 min,经0.45 μm微孔滤膜滤过。取续滤液用纯化水稀释进行测定、计算。结果,SUD-35及其包合物在水中的溶解度分别为0.000 32、0.65 g·L-1,可见形成包合物后,SUD-35在水中的溶解度增大了2 000倍左右,这也从另一个侧面说明了包合物的形成。
2.3 包合物的鉴定
2.3.1 差示扫描量热(DSC)法鉴定包合物。分别将SUD-35原料、HP-β-CD、HP-β-CD与SUD-35的物理混合物及SUD-35/HP-β-CD包合物进行DSC分析。以空铝皿为参比,另一铝皿中放入样品,升温速度为10 ℃·min-1,N2流速为20 mL·min-1,升温范围是30~150℃。结果显示,各不相同的波峰和吸收峰的温度值,SUD-35为118.0℃,HP-β-CD为69 ℃,HP-β-CD与SUD-35的物理混合物分别为70℃和119℃,说明二者的混合是物理混合。包合物完全形成新的热分析图,在105℃有吸收峰,证明包合物已经形成,结果见图2。
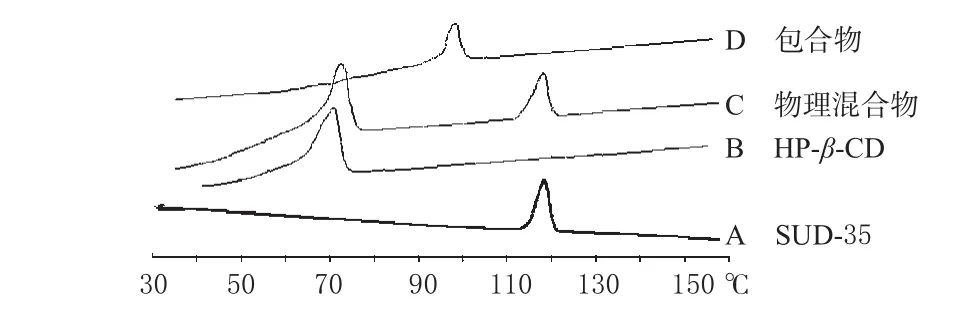
图2DSC图Fig 2 DSC patterns
2.3.2 X射线衍射(XRD)试验。分别将SUD-35、HP-β-CD、SUD-35与HP-β-CD物理混合物、包合物约0.05 g进行测定。测定条件:Cu靶,Ni滤波器,电压:20 kV,电流:20 mA,接受裂缝宽度:0.3 mm,扫描范围:5~40°(2θ),步长:0.05°·s-1。XRD试验结果见图3。
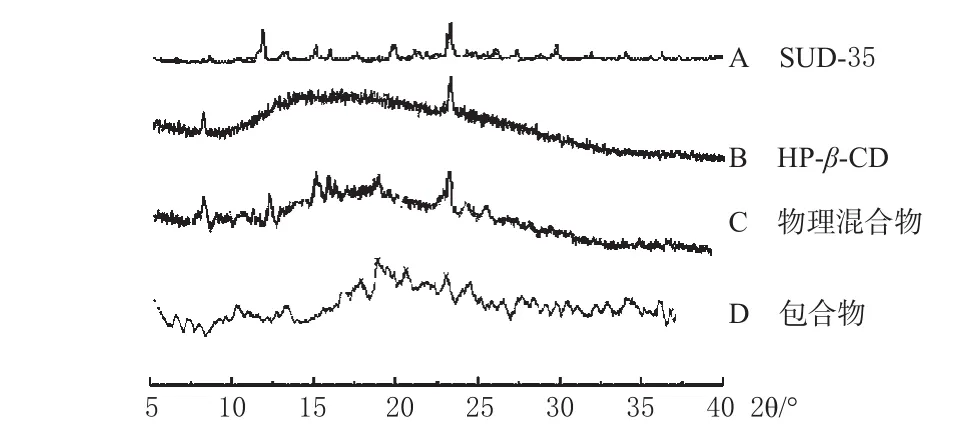
图3XRD图Fig 3 X-ray diffraction patterns
图3结果表明,SUD-35和HP-β-CD具有明显不同的衍射峰,物理混合物中既有HP-β-CD的衍射峰,又有SUD-35的衍射峰,是SUD-35和HP-β-CD的衍射峰叠加。包合物不同于物理混合物,SUD-35的部分特征衍射峰消失或位移,表明确实形成了包合物。
2.4 SUD-35/HP-β-CD包合物体内药效学考察
2.4.1 动物模型的建立[6]。取腹腔内传代7 d的肝癌H22小鼠,脱颈椎处死,用灭菌空针穿过腹肌,抽吸腹水,放入灭菌容器内,置于冰块上保存。腹水用灭菌生理盐水按1∶3稀释,制得H22肿瘤细胞悬液。无菌条件下每只小鼠右腋窝皮下注射H22肿瘤细胞悬液0.2 mL,制备H22实体瘤模型。
2.4.2 SUD-35/HP-β-CD包合物体内抗肿瘤作用的评价。制备H22实体瘤模型后,于接种次日,50只小鼠按体重随机分为5组,每组10只,分别为阴性对照组(腹腔注射生理盐水)、阳性对照组(腹腔注射环磷酰胺(CPP)5 mg·kg-1)和包合物低、中、高剂量组(分别腹腔注射相当于含SUD-35 5、10、15 mg·kg-1的SUD-35/HP-β-CD包合物),每日1次,共7 d(各给药剂量根据常见抗肿瘤药物紫杉醇的人用临床剂量换算而得)。于末次给药后24 h颈椎脱臼处死小鼠,完整剥取瘤组织,称瘤重,计算每组瘤重平均值与标准差,按下式计算各给药组抑瘤率:抑瘤率(%)=(1-T/C)×100%。式中,T为实验组即包合物组和阳性对照组平均瘤重,C为阴性对照组平均瘤重。各组抑瘤率结果见表4。

表4 各组抑瘤率结果(x ±s,n=10)Tab 4Tumor inhibition rate of each grou(px ±s,n=10)
表4结果表明,SUD-35/HP-β-CD包合物对肝癌H22细胞在小鼠体内的生长有显著的抑制作用,并呈现出剂量依赖关系。
3 讨论
由于CD具有独特的内疏水、外亲水的结构而可与许多尺寸适宜的客体分子形成包合物,因此其常用来增加药物的水溶性、增强稳定性、降低毒副作用、控制药物释放、提高生物利用率。
本试验结果表明,SUD-35与HP-β-CD简单的物理混合不能制备得到包合物。而采用饱和水溶液法,成功制得了SUD-35/HP-β-CD包合物。
利用HP-β-CD的包合,SUD-35溶解度提高了2 000倍左右,从而有可能提高SUD-35的口服生物利用度。同时,其水溶性的提高为今后开发成多种剂型提供了研究基础。
SUD-35制备成包合物后,通过其对小鼠体内药效学实验结果表明,SUD-35/HP-β-CD包合物对荷H22实体瘤小鼠有显著的抑瘤作用,为其进一步抗肿瘤研究提供了参考,因此,本实验具有一定的实用价值。
综上所述,SUD-35/HP-β-CD包合物的制备工艺简便、易行,可极大地提高SUD-35的水溶性,并对肝癌H22细胞在小鼠体内的生长有显著的抑制作用。
[1] 李建农,蒋建东.微管的生物学特性与药物研究[J].药学学报,2003,38(4):311.
[2] 冉懋雄,周厚琼.药剂辅料与新药开发[J].中国药房,1996,7(2):53.
[3] 何仲贵.环糊精包合物技术[M].北京:人民卫生出版社,2008:80-114.
[4] 陆 斌.药物新技术与新剂型[M].第2版.北京:人民卫生出版社,2005:40.
[5] 王 浩,顾吉晋,邓英杰.氢氯噻嗪-β-环糊精包合物的制备[J].中国药房,2008,19(25):1 963.
[6] 徐叔云,卞如濂.药理实验方法学[M].北京:人民卫生出版社,2006:1 647.
Preparation of Inclusion Compound of SUD-35/HP-β-cyclodextrin and Its Pharmacodynamics Study on Mice in Vivo
PAN Zhen-hua,XIANG Bai,FANG Yu(College of Pharmacy,Hebei Medical University,Shijiazhuang 050017,China)
LIU Huan-long(Dept.of Pharmacology,Hebei Medical University,Shijiazhuang 050017,China)
CHEN Xue-yan,ZHANG Yong-jian(Dept.of Pharmacy,The Second Affiliated Hospital of Hebei Medical University,Shijiazhuang 050003,China)
OBJECTIVE:To prepare the inclusion compound of benzoylurea antitubulin SUD-35/HP-β-CD in order to increase the solubility and stability of SUD-35,and to investigate its pharmacodynamics in vivo.METHODS:The inclusion compound was prepared by saturated solution method.The preparation technology of inclusion compound was optimized by orthogonal experiments using ratio of SUD-35/HP-β-CD(A),inclusion temperature(B),inclusion time(C)and stirring rate(D)as factors and with inclusion rate as index.The validation test and solubility determination were conducted.DSC and X-ray diffraction(XRD)were used to verify the complex.Hepatic cancer H22cell solid tumor model mice were given intraperitoneal injection of inclusion compounds at low-dose,medium-dose and high-dose(SUD-35)once a day for 7 days.The tumor inhibition rate was calculated 24 h after the last administration and compared with cyclophosphamide.RESULTS:The optimal preparation technology was as follows:A :1∶5,B:50 ℃,C:60 min,D:100 r·min-1.The average inclusion rate of 3 batches was 75.8%.The solubilities of SUD-35 raw material and inclusion compound in water were 0.000 32 g·L-1and 0.65 g·L-1.The formation of inclusion compound was verified by DSC and XRD method.The tumor inhibition rates at low-dose,medium-dose and high-dose were(38.25±0.57)%,(63.45±1.20)%,(69.26±1.15)%,the cyclophosphamide group was(71.52±1.16)%.CONCLUSION:The preparation technology of inclusion compound of SUD-35/HP-β-CD is simple and feasible.It strengthens the water-solubility of SUD-35,and the high dose of it has similar inhibition on the growth of hepatic cancer H22cells in mice with cyclophosphamide.
Antitubuli;SUD-35;HP-β-cyclodextrin;Inclusion compound;Orthogonal experiment;Mice;Hepatic cancer H22cells;Tumor inhibition rate
R943;R979.1
A
1001-0408(2011)21-1982-03
*讲师,博士研究生。研究方向:药物新剂型及肿瘤药理学。电话:0311-86265591。E-mail:aaapzh@sohu.com
#通讯作者:教授,博士。研究方向:心血管及肿瘤药理学。电话:0311-86266821。E-mail:zhangyj@hebmu.edu.cn
2010-08-17
2010-09-30)
