超临界反溶剂法制备叶酸介导吡柔比星葡聚糖纳米粒的工艺研究Δ
2011-11-30祖元刚赵修华祖柏实孙志强东北林业大学森林植物生态学教育部重点实验室哈尔滨市150040
姜 茹,祖元刚,赵修华,王 丹,祖柏实,孙志强(东北林业大学森林植物生态学教育部重点实验室,哈尔滨市 150040)
超临界反溶剂法制备叶酸介导吡柔比星葡聚糖纳米粒的工艺研究Δ
姜 茹*,祖元刚#,赵修华,王 丹,祖柏实,孙志强(东北林业大学森林植物生态学教育部重点实验室,哈尔滨市 150040)
目的:优化可主动靶向癌细胞的叶酸(FA)介导吡柔比星(PRB)葡聚糖(DEX)纳米粒(FA-PRB-DEX-NPs)的制备工艺。方法:采用超临界反溶剂法制备FA-PRB-DEX-NPs,采用二水平设计法,以PRB与DEX质量比(X1)、DEX浓度(X2)、混合液流速(X 3)、萃取釜温度(X4)、萃取釜压力(X5)为因素,以粒径、载药量、包封率等为指标筛选出最佳工艺条件,计算叶酸偶联度,通过扫描电镜、红外光谱、X射线衍射分析和差示扫描量热分析法表征纳米粒性质。结果:最佳工艺条件为X1=0.5、X2=9.98mg·m L-1、X3=3.3m L·m in-1、X4=50 ℃、X5=15 MPa。以此所制纳米粒的平均粒径、载药量和包封率分别为(178±15.8)nm、7.73%、33.2%,FA偶联度为2.97%。各表征方法结果显示纳米粒与原药比较粒径更小,呈无定形非晶态。结论:筛选的制备工艺成功地制备出了可主动靶向癌细胞表面的FA-PRB-DEX-NPs,且所采用的超临界反溶剂法方法简单,更适合工艺化生产。
吡柔比星;葡聚糖;叶酸;超临界反溶剂法;纳米粒;二水平设计法;制备工艺
吡柔比星(PRB)是一种蒽环类广谱肿瘤抗生素,可抑制RNA和DNA的合成,但其可致心脏毒性、骨髓抑制、脱发、黏膜炎及恶心、呕吐等严重毒副反应,因此长久以来一直限制着PRB的临床应用,也一直是化学结构改造和新剂型研发工作的焦点[1,2]。所以,制备一种靶向性好、低毒副作用的新型药物就成为了关键的问题。由于叶酸(FA)受体在正常组织中的表达高度保守,而在大部分恶性肿瘤组织中高度表达,因此,利用FA作为载体进行肿瘤靶向治疗受到人们的关注[3,4]。在本文中,笔者旨在选择一种合适的表面偶联FA的PRB葡聚糖(DEX)纳米粒(FA-PRB-DEX-NPs)制备工艺,以实现PRB对肿瘤细胞的靶向性、克服其毒副作用以及提高其生物利用度。
1 仪器与试药
红外光谱仪(日本岛津公司);激光粒度仪(美国布鲁克海文仪器公司);FEIQuanta 200扫描电镜(荷兰FEI公司);磁力搅拌器(杭州仪表电机有限公司)。
PRB对照品(浙江海正药业股份有限公司,批号:071101-3,纯度:98.5%);DEX(国药集团化学试剂有限公司,分子量:4万);FA(惠世生化试剂有限公司,批号:071008,纯度:>99.0%);FA-PRB-DEX-NPs(东北林业大学森林植物生态学教育部重点实验室研制,载药量:7.73%);冰乙酸、高碘酸钠、二甲基亚砜(DMSO)均为分析纯。
2 方法
2.1 二水平试验设计
本试验目的是将抗肿瘤药物PRB制备成FA介导、DEX包被的靶向纳米粒,以克服PRB毒副反应大且对肿瘤细胞无定向攻击能力的缺点。
设计思路:首先以未偶联FA的DEX与PRB为前体通过超临界反溶剂的方法制备DEX包载PRB纳米粒,对试验数据分析筛选出最佳条件,然后在最佳条件的基础上以FA偶联DEX(FA-DEX)取代上述未偶联FA的DEX,再经超临界反溶剂方法制备出具有FA靶向性的DEX包载PRB纳米粒。
最佳条件下FA-DEX包载PRB靶向纳米粒的制备过程如下:首先,将DEX的羟基氧化成醛基后与FA反应生成FA-DEX,目的是使制备出的药物表面带有FA,能够主动识别肿瘤细胞表面的FA受体,起到药物靶向定位的作用;然后,将FA-DEX和PRB同时溶解在DMSO中,经超临界反溶剂方法制备出FA-DEX包被的PRB靶向纳米粒,即FA-PRB-DEXNPs。超临界反溶剂方法过程如下:FA-DEX和PRB的DMSO混合溶液通过一定孔径的喷嘴喷入充满流动的、超临界态的CO2萃取釜中,因DEX和PRB不溶于CO2,而DMSO可快速与CO2相溶,致使FA-DEX包被PRB的粒子从DMSO溶液中析出,而被CO2带走的DMSO在非超临界态的分离釜中析出,CO2则可以继续循环利用。此过程制备的纳米粒粒径大小、载药量和包封率主要由PRB与DEX质量比(X1)、DEX浓度(X2)、混合液流速(X3)、萃取釜温度(X4)和萃取釜压力(X5)这5种因素决定。所以通过预试验首先确定这5种因素的范围(固定其他4种因素,改变1个因素大小,以能生成粒子为标准),然后利用二水平试验设计分析方法以粒径、载药量、包封率为判断指标选出最佳工艺处方。各因素水平见表1。

表1 二水平设计中各因素水平Tab 1 Factorsand levelsof two-level factorialdesign
2.2 纳米靶向DEX制备
2.2.1 氧化DEX的制备。取2 g DEX溶解在60m L水中,1.6 g高碘酸钠溶解在10m L水中,将两相混合后,室温避光搅拌24 h(DEX中的羟基氧化率为5%),得无色澄清溶液,将其冷冻干燥,即得白色粉末状氧化DEX。
2.2.2 FA-DEX的制备。将氧化DEX10mg溶于5m L水中,向其加入3.4mg FA后,室温避光搅拌24 h。加入与此溶液等体积的冰乙酸,FA-DEX析出,离心(8 000 r·m in-1),弃上清。冰乙酸洗涤沉淀至无DMSO后用无水乙醇清洗至无乙酸残留,最后将沉淀放入烘箱,60℃烘干,备用。
2.2.3 FA-DEX包载PRB的超临界反溶剂制备工艺。将FA-DEX与PRB按比例置于40m LDMSO中溶解,经超临界反溶剂方法制备FA-PRB-DEX-NPs粉体。步骤如下:启动CO2高压泵,将液化后的CO2以5~20 L·h-1的流速注入结晶釜,使其压力动态平衡在15~30MPa,温度40~55℃,稳定在超临界状态。用高压柱塞泵将FA-DEX与PRB的DMSO溶液以3.3~13.3m L·min-1的速度通过口径为150μm喷嘴注入到结晶釜内,溶剂瞬间溶解在CO2中,析出DEX包被的PRB粉体,CO2在结晶釜内继续运行1 h左右以干燥生成的纳米粉体,
DMSO与CO2在压力4~6MPa、温度25~45℃的分离釜中分离,DMSO回收后再利用,CO2气体直接循环使用[5~7]。
2.3 理化性质
2.3.1 FA偶联度测定。首先由FA浓度与其特定波长下的吸光度值制备FA标准曲线,然后将FA-DEX在DMSO中溶解,由于DEX在279 nm波长处无吸收峰,所以此时测定的吸光度值即为FA-DEX上FA的吸光度值,通过FA标准曲线换算出FA的浓度,然后通过公式计算出FA的偶联度:
FA偶联度=(FA浓度×体积)/FA-DEX质量×100%。
精密称取FA约5mg,置于100m L容量瓶中,加入适量DMSO,超声10min溶解,定容,使成浓度为50 μg·m L-1的FA贮备液,分别精密吸取贮备液0.2、1、2、4、6、16m L,置于各容量瓶中,以DMSO定容至刻度。紫外分光光度计测得溶液在279 nm波长处的紫外吸光度(y),并自动与浓度(x)进行直线回归分析。
精密称取适量的FA-DEX溶解于DMSO中,测定其吸光度,然后通过FA标准曲线计算FA的偶联度。
2.3.2 粒径测定。将少量FA-PRB-DEX-NPs样品放入10m L试管中,加入适量无水乙醇超声分散3m in后,用激光粒度仪测定粒径的大小及粒径分布情况,每个样品重复测3次。由于DEX在无水乙醇中的溶解速率比较慢,所以短时间内不会因为样品的溶解、释放等原因影响到粒径的大小。
2.3.3 载药量测定。精密称取PRB对照品约15mg,置于10 m L的容量瓶中,加入适量DMSO,超声10m in溶解,定容,使之成浓度为1.5mg·m L-1的PRB贮备液。依次稀释2倍共稀释10次得PRB对照液,分别检测254 nm波长处的峰面积,然后以峰面积与浓度回归作标准曲线方程。PRB高效液相效色谱(HPLC)法检测条件如下:色谱柱为Sigma C18(250mm×4.6 mm,5 μm);流动相为4%乙酸铵-乙腈(65∶35),冰乙酸调pH值至4;检测波长为254 nm;进样量为25μL;流速为1m L·m in-1。根据测得峰面积(y)与浓度(x)之间关系制备PRB标准曲线方程:y=57 158 376.933 9x-357 660.155 5(r2=0.999 8),即可计算出PRB的浓度,从而计算出其载药量。
精密称取FA-PRB-DEX-NPs样品 10 mg,置于0.5 m L DMSO中超声溶解,加入2.5m L流动相,震荡摇匀后,10 000 r·m in-1离心10min。分别吸取对照品和样品溶液25 μL,注入色谱仪,记录峰面积,利用标准曲线方程计算样品溶液中的PRB浓度:
载药量=被包裹药物质量/(载体质量+药物质量)×100%。
2.3.4 包封率测定。将样品载药量乘以所得样品的质量,即为被包载的PRB总质量,按以下公式计算包封率:
包封率=被包裹药物质量/投药量×100%
2.4 纳米粒表征
采用红外光谱、X射线衍射法(XRD)和差示扫描量热法(DSC)对PRB对照品、DEX和纳米粒进行表征。
3 结果与分析
3.1 二水平试验
应用二水平试验设计方法得回归模型如表2。
上述各水平下FA-PRB-DEX-NPs的粒径范围为121.16~487.27 nm,载药量和包封率分别为0.29%~8.00%、9.74%~38.41%。
表2 二水平设计模型Tab 2 Experim entaldesign of two-level factorialdesign
3.2 FA偶联度与最优条件
通过FA标准曲线y=0.068 7x+0.013 6(r2=0.998 6),计算出FA偶联度为2.97%,此时FA的量足够将FA-PRB-DEX-NPs介导到癌细胞表面,使癌细胞表面聚集大量药物从而起到抗癌的作用[5,8]。
将表2的结果经Design-Exper 7.0软件分析,得出最佳工艺条件如下:X1即PRB与DEX质量比为0.5;X2即DEX浓度为9.98mg·m L-1;X3即混合液流速为3.3m L·m in-1;X4即萃取釜温度为50℃;X5即萃取釜压力为15MPa。此条件下FA-PRB-DEX-NPs载药量为0.7%,包封率为5.4%,平均粒径为(172.3±21.1)nm,粒径分布均匀,见图1。
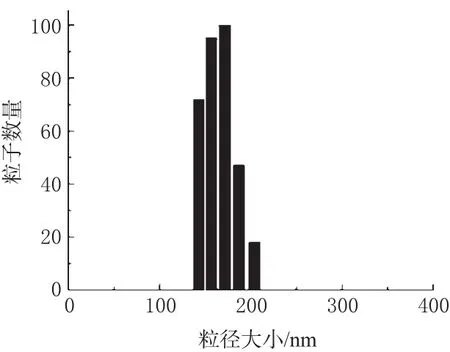
图1 粒径分布Fig 1 Distribution of particle size
尽管选择出的是各方面都比较优越的最佳条件,但载药量依然很低,因此笔者想通过改进制备方法以得到载药量、包封率更好的纳米粒。
保持处方不变,但在经超临界反溶剂制备之前,将FA-DEX与PRB按试验设计比例溶于含2%乙酸的水中,避光搅拌12 h后,冷冻干燥,此时的PRB大部分吸附在DEX上,将此冻干样品通过同样的超临界反溶剂方法在筛选出的最优条件下制备FA-PRB-DEX-NPs。而这种经过吸附的FA-DEXPRB制备出的纳米粒载药量和包封率都明显高于未经搅拌吸附的PRB,包封率达33.2%,载药量达7.73%,平均粒径为(178±15.8)nm。这样,经过搅拌吸附制得的FA-PRB-DEXNPs不仅粒径没有太大变化,同时极大地提高了DEX的载药量和包封率,使DEX包载PRB作为一种新药应用到临床成为可能。
3.3 粒径与形貌分析
药物溶解性是影响药物生物利用度的重要因素之一,难溶性药物因在水中的溶解度小,难以被机体吸收,导致生物利用度较差,因此,粒径的大小是影响药物分散、吸收利用的关键因素,所以本试验将粒径作为一项重要的评价指标。PRB对照品、DEX、FA-PRB-DEX-NPs粒径扫描电镜见图2。

图2 扫描电镜照片a.PRB对照品;b.DEX;c.FA-PRB-DEX-NPsFig 2 SEM photographsa.PRB control;b.DEX;c.FA-PRB-DEX-NPs
如图2所示,PRB对照品粒径大约50μm左右,DEX长径为大于20μm的长条形结晶,FA-PRB-DEX-NPs平均粒径为(178±15.8)nm,为分布均匀的球体。通过图2可以明显看出,经超临界反溶剂方法制备的样品粒径远远小于未经过处理的DEX与PRB对照品粒径。表明超临界方法的应用不仅可改善药物水溶性、载药量的问题,同时此方法制备出的纳米粉体无溶剂残留,在提高生物利用度的同时,也降低了对细胞的毒副作用。
3.4 红外光谱分析
先将PRB对照品、DEX和FA-PRB-DEX-NPs进行干燥后,以溴化钾压片法获得室温下的红外光谱图,见图3。
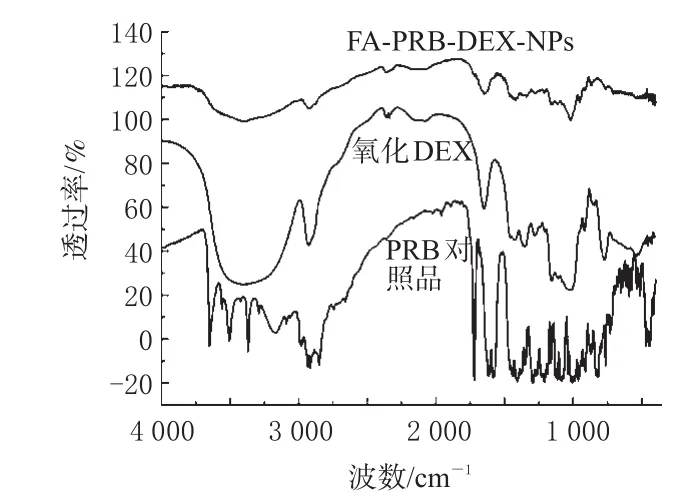
图3 红外光谱图Fig 3 FTIR spectra
通过图3可以明显看出,PRB经FA-DEX包裹后已经不再显示其原本的结构特征,而是显示DEX的结构特征,这说明用此方法获得的PRB已经完全被载体DEX所包裹。因此,在PRB进入生物体杀伤肿瘤细胞的过程中,FA能够真正地起到靶向诱导的作用,将药物带到特定部位。
3.5 XRD分析
采用测定纳米粒X射线的衍射强度来进一步确定纳米粒的晶体结构,见图4。
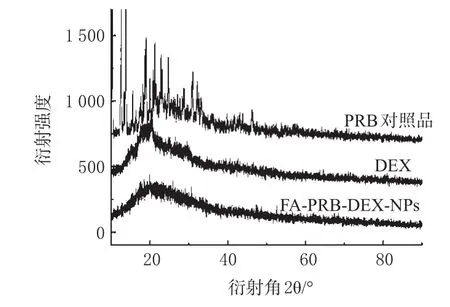
图4 XRD分析图Fig 4 XRD spectra
由图4 PRB在纳米化前、后XRD谱图的对比可以明显地看出,PRB对照品在2θ=10.32°、18.66°、21.26°、32.2°有明显峰值,证明未经处理的PRB有很强的X衍射强度,为晶体结构;而经过纳米化之后的粒子没有明显的X衍射峰,这就证明经过超临界反溶剂方法处理后的FA-PRB-DEX-NPs已经明显显示出了非晶体状态,极大地增大了药物的溶解度。
3.6 DSC分析
PRB对照品、DEX、FA-PRB-DEX-NPs的DSC分析见图5。
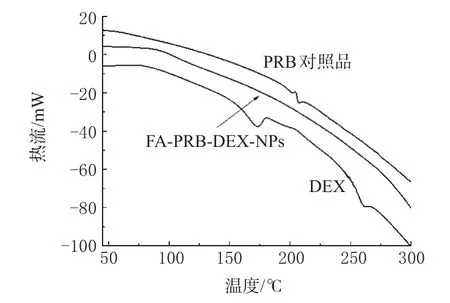
图5 DSC分析图Fig5 DSCspectra
由图5可以明显看出,PRB对照品在202.30℃处有1个吸热峰,DEX在172.84℃和263.80℃均有吸热峰,而经超临界纳米化处理之后的FA-PRB-DEX-NPs无任何吸收峰存在,说明经此纳米化后的粒子呈现无定形非晶态特征。
4 讨论
本试验采用二水平析因分析方法,以PRB为包被核心,选用DEX为包被载体(DEX与FA偶联),经超临界反溶剂法制备出表面有FA偶联的DEX包载PRB纳米粒。超临界反溶剂法制备纳米粒的优点在于,纳米粒分布均匀、无溶剂残留,制备方法简单且周期短,是一种良好的纳米化制备方法,应用也比较广泛。
经试验发现,纳米粒的载药量不高,但在相同处方中如果将FA-DEX与PRB通过搅拌冻干之后再经超临界反溶剂方法制备FA-PRB-DEX-NPs,载药量和包封率都明显高于未经搅拌冻干的FA-DEX-PRB。这说明在搅拌冻干的过程中PRB大部分吸附在DEX的表面;而将FA-DEX-PRB的DMSO混合液喷入萃取釜之前,由于时间短暂,PRB未脱离FA-DEX的表面即被强制包裹在DEX的纳米粒之中,形成比未经过吸附的FADEX载药量高近10倍的FA-PRB-DEX-NPs。
FA-PRB-DEX-NPs成功制备为今后PRB的活性研究提供了可靠的实验基础和科学依据。通过本试验改进方法之后的工艺条件更适合实际生产和应用。
[1] 李亚平,顾王文,陈伶俐.吡柔比星或盐酸吡柔比星脂质纳米粒及其制备方法[P].中国专利:101352418A,2009-01-28.
[2] Kumi K,Kozo T,Tsuneji N,et al.Preparation and pharmacokinetics of pirarubicin loaded dehydration-rehydration vesicles[J].International Journal of Pharmaceutics,2003,252(1-2):73.
[3]Zu Y,Zhang Y,Zhao X,et al.Optimization of the preparation process of vinblastine sulfate(VBLs)-loaded folate-conjugated bovine serum albumin(BSA)nanoparticles for tumor-targeted drug delivery using response surface methodology(RSM)[J].International Journal of Nanomedicine,2009,4:321.
[4] Reddy JA,Westrick E,Vlahov I,et al.Folate receptor specific anti-tumor activity of folate-mitomycin conjugates[J].Cancer Chemother Pharmacol,2006,58(2):229.
[5] Zhao X,Zu Y,Li Q,et al.Preparation and characterization of camptothecin powder micronized by a supercritical antisolvent(SAS)process[J].The Journal of Supercritical Fluids,2010,51(3):412.
[6] Iolanda D,Ernesto R.Supercritical antisolvent micronization of cyclodextrins[J].Powder Technology,2008,183(2):239.
[7] Varughese P,Li J,Wang W,et al.Supercritical antisolvent processing ofγ-indomethacin:Effects of solvent,concentration,pressure and temperature on SASprocessed indomethacin[J].Powder Technology,2010,201(1):64.
[8] 祖元刚,袁 帅,赵修华,等.叶酸介导EGCG白蛋白纳米粒的制备及体外靶向性与活性评价[J].药学学报,2009,44(5):525.
Preparation of Folic Acid-conjugated Pirarubicin-loaded Dextran Nanoparticles by Supercritical Antisolvent M ethod
JIANG Ru,ZU Yuan-gang,ZHAO Xiu-hua,WANG Dan,ZU Bai-shi,SUN Zhi-qiang(Key Laboratory of Forest Plant Ecology,M inistry of Education,Northeast Forestry University,Harbin 150040,China)
OBJECTIVE:To optim ize the preparation technology of folic acid(FA)-conjugated pirarubicin(PRB)-loaded dextran(DEX)nanoparticles(FA-PRB-DEX-NPs)for tumor-targeted drug delivery.METHODS:Supercritical anti-solventmethod was adopted to prepare FA-PRB-DEX-NPs.The ratio of PRB to DEX(X1),DEX concentration(X2),flow rate ofm ixture(X3),extraction temperature(X 4),and extraction pressure(X5)as factors and w ith particle size,drug-loading rate,entrapment efficiency as index were adopted to optimize the preparation technology of FA-PRB-DEX-NPs using two-level factorial design.The coupled conjugate rate of folic acid was calculated and the particles were detected by FTIR,XRD,DSC,SEM.RESULTS:Optimal condition was as follows:X1=0.5,X2=9.98mg·m L-1,X3=3.3 m L·m in-1,X4=50 ℃,X5=15 MPa.Mean particle size,drug-loading rate and entrapment efficiency of nanoparticleswere(178±15.8)nm,7.73%,33.2%.The coupled conjugate rate of folic acid was 2.97%.The particle size of nanoparticles was smaller than that of original ones,assumed as amorphous state.CONCLUSION:FA-PRB-DEX-NPs for tumor-targeted drug delivery have been prepared through the supercritical antisolventmethod,which is simple and suitable for industrialization.
Pirarubicin;Dextran;Folic acid;Supercritical antisolvent method;Nanoparticles;Two-level factorial design;Preparation technology
R943;R979.1
A
1001-0408(2011)21-1961-04
Δ国家林业局“948”项目(2010-4-20);林业公益性行业科研专项(2010040072);东北林业大学研究生论文资助项目
*在读本科生。研究方向:制剂学。E-mail:jiangyu224@163.com
#通讯作者:教授,博士。研究方向:植物化学与植物药。电话:0451-82191517。E-mail:zygorl@yahoo.com.cn
2010-12-17
2011-02-05)
