头孢克肟肠溶滴丸的制备及其质量评价
2011-11-17何艳高萌徐红蒋妮田舸田燕大连医科大学药学院大连市6044大连儿童医院药剂科大连市600大连医科大学技能实验室大连市6044
何艳,高萌,徐红,蒋妮,田舸,田燕#(.大连医科大学药学院,大连市6044;.大连儿童医院药剂科,大连市 600;.大连医科大学技能实验室,大连市 6044)
头孢克肟肠溶滴丸的制备及其质量评价
何艳1*,高萌1,徐红2,蒋妮3,田舸1,田燕1#(1.大连医科大学药学院,大连市116044;2.大连儿童医院药剂科,大连市 116001;3.大连医科大学技能实验室,大连市 116044)
目的:制备头孢克肟肠溶滴丸并评价其质量。方法:采用滴制法制备头孢克肟滴丸,并包肠溶衣,以圆整度、重量差异及溶散时限作为评定指标,设计正交试验对包衣材料、包衣液浓度、包衣层数进行考察,优选出肠溶滴丸的最佳包衣工艺并进行验证试验,同时考察制剂的体外累积释放度。结果:最佳包衣工艺为包衣材料聚丙烯酸树脂Ⅱ号,包衣液浓度10%,包衣层数3层。验证试验表明制剂的各项指标均符合《中国药典》2010年版相关要求;45 min时在碱性释放介质(pH=6.8)中体外累积释放度为(93.4±1.67)%。结论:头孢克肟肠溶滴丸的制备工艺合理,在碱性介质中释放完全,质量合格。
头孢克肟;肠溶滴丸;滴制法;制备;质量评价;体外释放度
头孢克肟[1,2](Cefixime,CFX),系日本藤泽药品工业公司于1980年开发,并于1987年投入市场的一种第3代口服头孢菌素类抗生素,化学名为7{[2-氨基-4-噻唑基(羧甲氨基)]亚胺-乙酰基}-氨基-3-乙烯基-8-氧-5-硫杂-卜氮杂二环[4.2.0]-2-辛烯-2-羧酸[3]。头孢克肟为白色或淡黄色结晶粉末,略有异臭,易溶于甲醇,较难溶于乙醇,在水、乙酸乙酯或己烷中几乎不溶;其对α-溶血性链球菌、溶血性链球菌和肺炎球菌有强大抗菌作用,对肠球菌无抗菌作用,能抑制94%以上的其他肠杆菌科细菌(大肠杆菌、枸橼酸杆菌和肺炎杆菌等),是一种抗菌谱广、抗菌作用强、血药浓度维持时间长、对多种内酰胺酶稳定、可口服的抗生素[4]。目前头孢克肟的剂型主要有胶囊、普通片、分散片、咀嚼片、颗粒剂、干混悬剂等,但药动学数据[5]提示口服头孢克肟各剂型相对生物利用度无明显差异(P>0.05)。
由于头孢克肟在水中溶解度小、口服后对胃刺激性较大,尤其是空腹时可引起恶心、呕吐、腹泻等,使其应用受到限制。鉴于头孢克肟主要从肠道吸收[6],根据头孢克肟本身的结构和性质,笔者采用滴制法制备头孢克肟滴丸,再包肠溶衣,通过选择包衣材料和包衣处方,达到使药物在肠道中定位释药的目的;同时对头孢克肟肠溶滴丸进行体外释放度测定,为其进一步开发和应用奠定基础。
1 仪器与试药
1.1 仪器
1100型高效液相色谱仪(美国安捷伦公司);ZBS-6G智能崩解试验仪(天津大学无线电厂);电子天平(上海精科仪器有限公司);RCZ-5A智能药物溶出仪(天津大学精密仪器厂);滴丸机(大连医科大学药剂学教研室制);BY300A型小型包衣机(上海黄海药检仪器厂)。
1.2 试药
头孢克肟标准品(中国药品生物制品检定所,批号:080610,纯度:97%);头孢克肟(上海天寰药业有限公司,批号:070330,纯度:98%);头孢克肟肠溶滴丸(大连医科大学药剂学教研室制,批号:20090325、20090326、20090327,主药含量:25%,规格:每丸10 mg,丸重:40 mg);明胶(辽宁省医药经贸公司试剂厂,批号:080923);羟丙甲基纤维素酞酸酯(HPMCP,山东泰安明天化工有限公司,批号:070816);聚丙烯酸树脂Ⅱ号(上海浦力膜制剂辅料有限公司,批号:080425);醋酸纤维素酞酸酯(CAP,上海昌为医药辅料技术有限公司,批号:081126);其余辅料均为药用级,所用试剂均为分析纯。
2 方法与结果
2.1 检测波长的选择
精密称取头孢克肟标准品适量,用流动相溶解稀释,制成浓度约20 μg·mL-1的标准品溶液,在200~400 nm波长范围内扫描。结果其最大吸收波长在288 nm处,而辅料在此条件下无干扰,故选择288 nm作为头孢克肟的检测波长。
2.2 色谱条件[7]与系统适用性试验
色谱柱:Hypersil C18(250 mm×4.6 mm,5 μm);流动相:乙腈-0.25%四丁基氢氧化铵溶液(取0.4 mol·L-1四丁基氢氧化铵溶液25 mL,用水稀释至1 000 mL,用1.5 mol·L-1磷酸调pH至7.0)=1∶2;检测波长:288 nm;流速:1.0 mL·min-1;温度:25℃。在此条件下,理论板数按头孢克肟计算不低于4 000。精密量取头孢克肟标准品10 mg和头孢克肟肠溶滴丸(样品)适量(含头孢克肟约10 mg),分别置于50 mL容量瓶中,用流动相溶解并稀释至刻度,按上述色谱条件,分别进样。结果,主峰保留时间在10.1 min左右,分离度符合要求,色谱见图1。
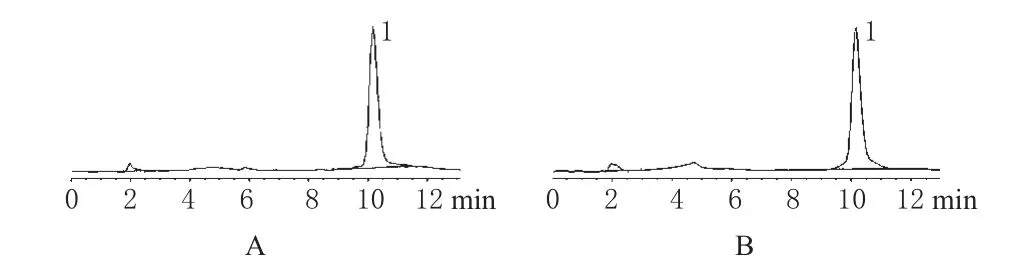
图1 高效液相色谱图A.标准品:B.样品;1.头孢克肟Fig 1 HPLC chromatograms A.standard substance;B.sample;1.cefixime
2.3 头孢克肟肠溶滴丸的制备
2.3.1 处方。头孢克肟原料药2.0 g,明胶2.0 g,纯化水4.0 mL,10%聚丙烯酸树脂Ⅱ号的乙醇溶液适量。
2.3.2 滴丸的制备工艺。精密称取明胶2.0 g,加10 mL纯化水浸泡30 min,待明胶完全溶胀后,将其置于水浴上加热溶解,然后蒸去多余的水分至明胶与水的比例为1∶2时,再按药物-基质=1∶3(重量比)加入头孢克肟2.0 g,充分搅拌使分散均匀,倒入自制滴丸机中,并使滴丸机保温到70℃。滴制过程中控制好滴丸速度,使物料通过滴丸机的滴头能以适当的速度均匀滴入并沉降于液体石蜡冷凝液中。收缩冷凝后取出小丸,用滤纸吸去表面的液体石蜡,室温下自然晾干,即得。
2.3.3 滴丸的包衣工艺。在包衣机内装入适当形状的挡板后,将滴丸放入包衣机内,喷入一定浓度包衣材料的乙醇溶液,使滴丸表面均匀湿润。吹入缓和的热风使溶剂蒸发(温度不超过40℃)。如此重复上述操作若干次,直至达到一定的层数为止,然后在室温下放置6~8 h,使之固化完全。
2.3.4 正交设计优选包衣工艺[8]。通过预试验并结合实际条件,固定滴口内径为6 mm,以丸重差异(10分,评分标准:精密称量20丸的重量,分数=40 mg/每粒丸重×10,再计算平均分数)、圆整度(10分,评分标准:用游标卡尺测量20粒滴丸的直径,分数=3.5 mm/每粒直径×10,再计算平均分数)、溶散时限(10分,评分标准:按2010年版《中国药典》二部附录[9]规定,在人工肠液中测定3批滴丸的溶散时间,分数=30 min/实际溶散时间×10,再计算平均分数)为考察指标,评价总分为30分。本次研究仅对包衣材料(A)、包衣液浓度(B)、包衣层数(C)进行考察,设计正交试验。因素水平见表1,试验结果见表2。用SPSS 11.5统计软件,多组资料采用方差分析,2组间比较采用t检验,结果见表3。

表1 因素水平表Tab 1 Factors and levels
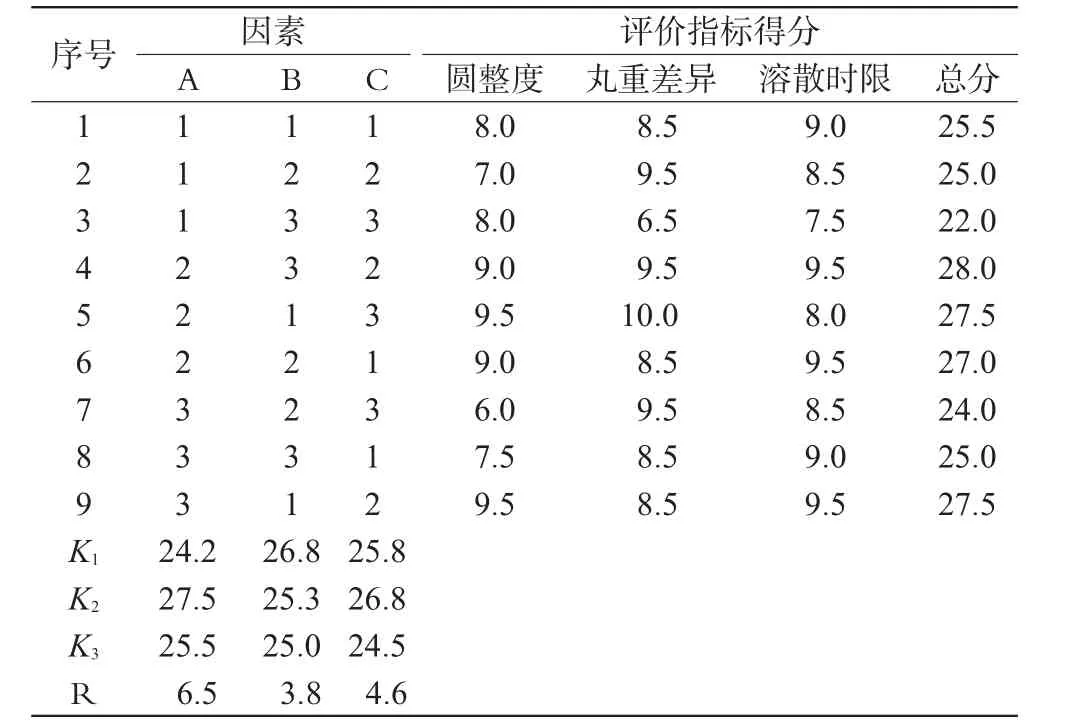
表2 正交试验及结果Tab 2 Results of orthogonal tests
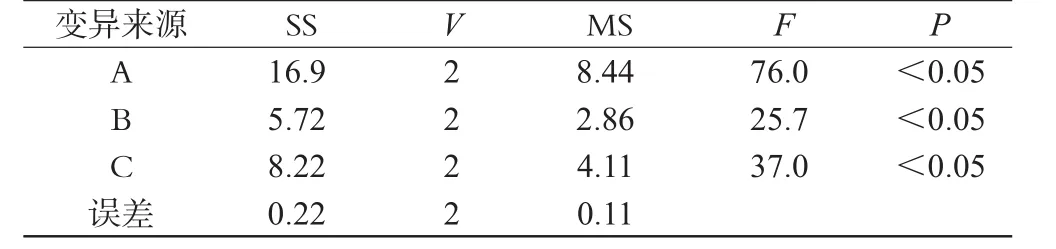
表3 方差分析表Tab 3 Results of variance analysis
表2、表3结果表明,3种因素对工艺影响大小为A>C>B,即包衣材料为影响肠溶滴丸的主要因素,其次是包衣层数,最后是包衣液浓度。由直观分析可见较好的组合为A2B1C2,即包衣材料为聚丙烯酸树脂Ⅱ号、包衣液浓度为10%、包3层。3个因素各水平之间差异均有显著性意义(P<0.05)。
2.4 质量评价
2.4.1 外观。按上述最佳工艺条件制备3批滴丸,结果外观均为淡黄色,直径为(3.5±0.4)mm,圆整度平均评分为9.7分,大小均匀,外观光滑,色泽一致,硬度适中。
2.4.2 丸重差异及溶散时限。按2010年版《中国药典》二部附录[9]规定操作,结果3批滴丸的丸重差异分别为±1.03%、±1.25%和±1.18%(平均评分:9.8分);3批滴丸在人工胃液中2 h不溶后,在人工肠液中的溶散时间为(30.9±1.4)min(平均评分:9.6分),结果符合规定。
2.4.3 含药量的测定。(1)标准曲线的制备。精密称取干燥至恒重的头孢克肟标准品10 mg,置于10 mL容量瓶中,用流动相溶解并稀释至刻度,得浓度为1 mg·mL-1的标准贮备液。精密量取标准贮备液100、200、400、800、1 200、1 600 μL,分别置于10 mL容量瓶中,制备成10、20、40、80、120、160 μg·mL-1的系列浓度标准液,分别进样分析,以浓度(c)为横坐标、峰面积(A)为纵坐标作图,进行线性回归,得标准曲线方程为A=4 253.6c-1 538.6(r=0.999 9)。结果表明,头孢克肟检测浓度线性范围为10~160 μg·mL-1。(2)精密度试验。取20、80、120 μg·mL-13个浓度头孢克肟标准液,连续测定5次和每天在同一时间进样、连续测定5 d,计算日内精密度和日间精密度,结果RSD分别为2.47%、1.98%、2.04%和2.91%、2.86%、2.53%,表明精密度良好。(3)重复性试验。取同一批号的头孢克肟肠溶滴丸5份,每份250 mg,分别置于50 mL容量瓶中,加入约50℃、60%甲醇溶液30 mL,使其溶解后再加甲醇定容至刻度,摇匀后过滤,弃去初滤液,精密量取续滤液800 μL,置于10 mL容量瓶中,用流动相稀释后分别进样分析,测定峰面积,用标准曲线方程计算含量。测得样品中头孢克肟含量的RSD为1.67%,表明该方法重复性好。(4)加样回收率试验。精密称取同一批号的头孢克肟肠溶滴丸9份,每份250 mg,分别置于50 mL容量瓶中,每3份分别精密加入1 mg·mL-1头孢克肟标准贮备液400、800、1 200 μL,测定峰面积,根据标准曲线方程计算含量,以测得量与加入量比较,计算回收率。结果,低、中、高浓度头孢克肟平均回收率分别为100.19%、99.22%、101.48%(RSD=1.86%),表明此法用于测定样品含量的准确度好。(5)稳定性试验。分别取低、中、高3个浓度的样品溶液,分别于0、0.5、1、2、4、6、12、24、36、48 h时测定峰面积。根据标准曲线方程计算含量,结果,低、中、高3个浓度的RSD分别为2.71%、1.85%、1.36%,表明样品溶液在48 h内稳定。(6)含药量的测定。精密称取相当于头孢克肟约50.0 mg的样品3批,余下按“(3)”项下方法操作,测定峰面积,用标准曲线方程计算含量。结果,样品中头孢克肟含量平均为(24.8±0.39)%(与理论含药量25%接近)。
2.4.4 有关物质检查。取样品3批各3份(每份含头孢克肟约100 mg),置于100 mL容量瓶中,加磷酸盐缓冲液(pH 7.0)溶解(必要时超声处理使溶解完全)并稀释至刻度,摇匀,过滤,取续滤液作为供试品溶液;同法制备标准品溶液。精密量取标准品溶液20 μL,按“2.4.3”项中的“(3)”项下方法操作,调节灵敏度,使主成分色谱峰的峰高为记录仪满量程的20%。再精密量取标准品和供试品溶液各20 μL,记录色谱图至主成分峰保留时间的2.5倍。用标准曲线方程计算各杂质的总量,结果,3批样品中有关物质平均含量分别为1.08%、0.97%、0.89%,符合规定。
2.4.5 释放度的测定。按照2010年版《中国药典》释放度测定法[9]规定采用小杯法,转速为100 r·min-1,以0.1 mol·L-1盐酸为酸性释放介质,pH 6.8的磷酸盐缓冲溶液(取0.2 mol·L-1磷酸二氢钾250 mL,加0.2 mol·L-1氢氧化钠118 mL,用水稀释至1 000 mL,摇匀,即得)为碱性释放介质。取200 mL酸性释放介质注入250 mL溶出杯中,加热使溶液温度保持在(37±0.5)℃,调整转数并保持稳定,称取样品(批号:20090325)6份,每份含头孢克肟约50 mg,分别投入溶出杯中,2 h后采样6 mL,立即经0.45 μm微孔滤膜过滤(自取样至过滤在30 s内完成);取续滤液4 mL,置于10 mL容量瓶中,加流动相定容至刻度。弃去溶出杯中的酸液,立即加入磷酸盐缓冲溶液,自样品与介质接触时开始记时,分别于5、15、30、45、60、120 min采样6 mL,并立刻补充同体积等温新鲜介质,按上述酸样液进行相同处理,进样分析,测定峰面积,用标准曲线方程计算含量及累积释放度,结果见表4。
表4结果表明,头孢克肟肠溶滴丸在酸性释放介质中120 min时的累积释放度小于10%,而在碱性释放介质中45 min时的累积释放度为(93.4±1.67)%,释放较完全,符合2010年版《中国药典》二部附录[9]规定。

表4 头孢克肟肠溶滴丸体外累积释放度的测定结果(n=6)Tab 4 Accumulative release rates of Cefixime enteric coated drop pills in vitro(n=6)
3 讨论
本试验以滴丸的制剂学有关参数为指标,筛选出了头孢克肟肠溶滴丸合理的包衣条件,即以10%聚丙烯酸树脂Ⅱ号为包衣液,包衣层数为3层。经验证表明,处方工艺合理,稳定可行,重量差异、溶散时限均符合相关规定。
滴制法制备滴丸是基于固体分散体的原理,将药物高度分散于药物基质中,药物以分子状态、胶态、微晶或无定形粉末等状态存在,同时能大幅度减小难溶性药物的粒度,增大其溶出面积,有利于药物的溶出,加快了有效成分的溶出速度,提高其吸收效果[8]。由于明胶是一种蛋白质,是在体内可生物降解的高分子材料,具有很好的生物相容性,同时可将药物表面润湿,能增加药物的溶出及释放,故本研究选用明胶为头孢克肟滴丸的基质。
本试验采用聚丙烯酸树脂Ⅱ号对头孢克肟滴丸进行包衣,从而使药物在胃液中不溶,在肠液中释放,最终达到肠溶的目的。衣层除了用于防潮、遮味、增加制剂稳定性和改善机械性能外,主要目的是控制药物的释放速率和释放位置。由于时间和条件有限,本次研究仅对包衣材料、包衣液浓度、包衣层数进行考察,其他影响因素的考察有待进一步的研究。
综上所述,头孢克肟肠溶滴丸的制备工艺合理,在碱性介质中释放完全,质量合格。
[1] 朱刚直,郭 歆,何小爱.头孢克肟口崩片在健康人体内的相对生物利用度研究[J].中南药学,2009,7(2):201.
[2] 林诗贵,曾环想,王 磊,等.头孢克肟胶囊剂的制备及其质量研究[J].中国新药杂志,2005,14(4):345.
[3] Kasner SE,Wein T,Piriyawat P.Acetaminophen for altering body temperature in acute stroke:a randomized clinical trial[J].Stroke,2002,33(1):130.
[4] Liu XD,Xie L,Gao JP,et al.Cefixime absorption kinetics after oral administration to humans[J].Eur J Drug Metab Pharmacokinet,1997,22(2):185.
[5] 张建国,王本杰,郭瑞臣,等.头孢克肟3种剂型的人体生物等效性评价[J].中国临床药学杂志,2005,14(5):297.
[6] Brogden RN,Campoli-Richards DM.Cefixime.A review of its antibacterial activity,pharmacokinetic properties and therapeautic potential[J].Drugs,1989,38(4):524.
[7] 毕津莲,李湘斌.高效液相色谱法测定头孢克肟胶囊的含量[J].中国现代医学杂志,2008,18(21):3 214.
[8] 洪 清,袁 曦,刘亦伟,等.天宁滴丸体外溶出度测定[J].中国药房,2008,19(9):678.
[9] 国家药典委员会编.中华人民共和国药典(二部)[S].2010年版.北京:中国医药科技出版社,2010:附录10-11、附录83-85、附录87-88.
Preparation and Quality Evaluation of Cefixime Enteric Coated Drop Pills
HE Yan,GAO Meng,TIAN Ge,TIAN Yan(Pharmaceutical College,Dalian Medical University,Dalian 116044,China)
XU Hong(Dept.of Pharmacy,Dalian Children’s Hospital,Dalian 116001,China)JIANG Ni(Skill Laboratory,Dalian Medical University,Dalian 116044,China)
OBJECTIVE:To prepare Cefixime enteric coated drop pills and to evaluate their qualities.METHODS:The drop pills were prepared by dropping method and coated with enteric materials.Enteric coated materials,concentration and the number of layers were checked by orthogonal test using spherical degree,dissolution time and weight difference as evaluation index.And optimal coating conditions were selected.The in vitro accumulative release rate of drop pills was investigated.RESULTS:Optimal coating conditions were as follows:polyacrylic resinⅡ,10%concentration of enteric coated materials,3 coating layers.Results of validation test indicated that the quality of drop pills was up to the requirements stated in Chinese Pharmacopeia(2010 edition).The in vitro accumulative release rate was(93.4±1.67)%at 45 min in the alkalescent medium(pH=6.8).CONCLUSION:Cefixime enteric coated drop pills are reasonable in preparation technology and have high release rate in the alkalescent medium.
Cefixime;Enteric coated drop pills;Dropping method;Preparation;Quality evaluation;In vitro drug release
R943;R978.1+1
A
1001-0408(2011)21-1973-03
*硕士研究生。研究方向:药物新制剂、新技术。电话:0411-86110420。E-mail:heyanrunning@163.com
#通讯作者:教授,硕士。研究方向:天然药物新制剂、新技术。电话:0411-86110420。E-mail:tiany2004@126.com
2010-09-01
2011-01-14)
