用HMO法探讨O3分子的结构和性质
2011-11-13林和成张琨赵光平
林和成张琨赵光平
(湖南科技学院 生命科学与化学工程系,湖南 永州 425100)
Huckel分子轨道法(HMO)是量子化学近似计算方法之一,其计算简便迅速,适用于有离域π分子轨道的共轭分子,在预测分子的结构、性质等方面有广泛的应用[1-2]。如对有机化合物的链状、环状共轭烯烃结构和性质进行了合理的预测和解释[3-5]。
在无机化学教学中,对无机分子几何结构进行解释时,常采用Pauling的价键理论(VBT)即杂化轨道理论,但是VBT对于分子的光谱的形成和分子的性质,不能给出恰当的解释,应用受到很大的局限。在大气中,O3分子能够稳定存在,但是有较强的氧化活性和分子极性[6]。由于化学本科教学的课程设置顺序是,“无机化学”设置在“结构化学”课程之前,所以在“无机化学” 课程中探讨O3分子的结构和性质时,不可能用分子轨道理论(MOT)去解释;而在“结构化学”课程中,主要是以丁二烯和苯分子的结构和性质为例,进行MOT探讨,对O3分子没有进行系统的论述和讨论。因此本文拟用MOT中的HMO法来解释和判断O3分子的结构和性质。
1. O3分子的HMO处理
1.1.三角型结构(图1 a)
其结构的 Huckel行列式为: 其中x=(α-Ε)/β
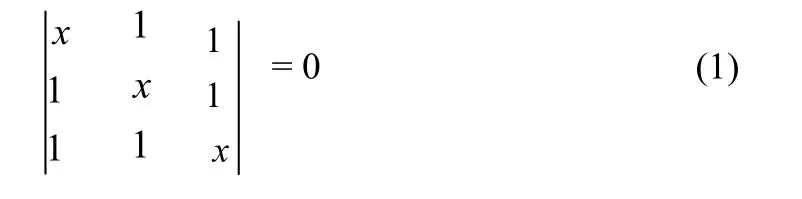
式(1)展开得x3−3x+2=0, 解方程得x1=-2,x2=x3=1.
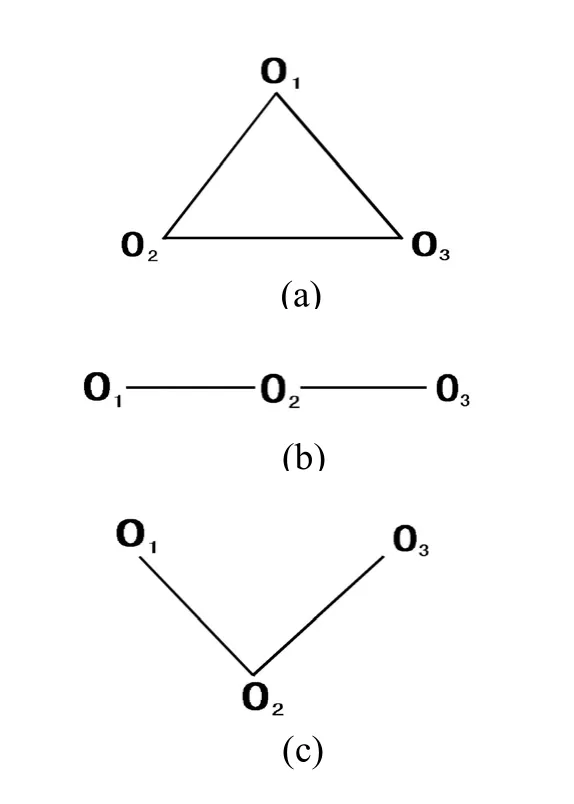
图1.3分子三种可能的几何结构
即 E1=α+2β(为成键轨道能),E2=E3=α+β(为反键轨道能),对应的π分子轨道波函数分别为:

式中Ψ1为成键轨道,Ψ2、Ψ3为简并的反键轨道;形成正三
O3为同核三原子分子,其可能的分子几何结构有正三角形、直线形和V形三种类型,见图1。下面分别对这三种可能的分子结构进行HMO处理,三种结构的π型分子轨道的变分函数均为:ψ=c1φ1+c2φ2+c3φ3。角形结构的每个氧原子各提供2个π电子进入分子轨道中,O3分子的π-MO电子组态为Ψ12Ψ22Ψ32,相应的轨道能级简图见图2。
由式(2)和其π-MO的电子组态,根据文献[2]的电荷密度和键级计算公式可知,分子中各个氧原子的电荷密度分别为q1= q2= q3=2.000; 各原子间的π键键级均为0,即P12=P13= P23=0。

图2.三角形的O3分子轨道能级简图
1.2.线型和V型结构(图1 b和c)
O3分子如为直线形和V形结构,其Huckel行列式均为:其中x=(α-Ε)/β
式(3)展开得x3−2x=0, 解方程得x1=−x2=0, x3=即 E1=α+(为成键轨道能),E2=α(为非键轨道能),E3=α-(为反键轨道能),相对应的π分子轨道波函数分别为:
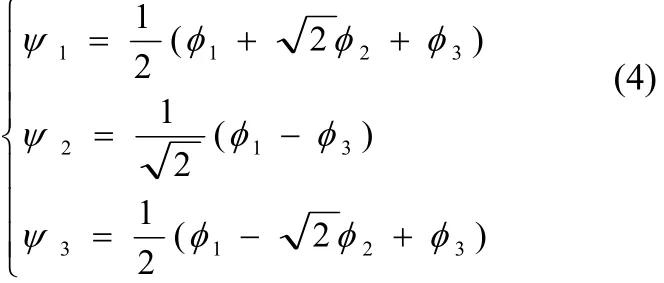
式中Ψ1为成键轨道,Ψ2为非键轨道、Ψ3为反键轨道;其中氧原子“1”和“3”各提供1个π电子进入分子轨道中,氧原子“2”提供2个π电子,形成π-MO的电子组态为Ψ12Ψ22Ψ30,相应的轨道能级简图见图3。

图3.线形和V形结的O3分子构轨道能级简图
同理“1.1”,由式(4)和其π-MO的电子组态可知,分子中各个氧原子的电荷密度分别为q1=q3=1.500, q2=1.000;各原子间的π键键级均分别为:P12= P23=0.707。
2. 讨论与结论
由文献[6]可知,O3分子是具有反磁性(即无成单电子)、偶极矩为0.51D的极性分子,在室温下性质稳定且具有较强的氧化性。根据上述不同O3分子HMO处理的结果和分子点群理论,下面分别对O3分子的结构和性质进行讨论。
2.1.三角形结构
如果O3分子为正三角形结构:(1)由HMO法计算结果知道,分子中各个原子上的电荷密度均为 2.000, 且两原子间的π键级为0,由此可知,此结构的分子不会形成π键。(2)根据HMO形成共轭π-MO的条件,即π-MO的电子数必须小于原子轨道数目的两倍。由于正三角形结构的O3分子有6个π键电子,所以O3分子不能形成离域π- MO,其只可能形成只含α键的三角形分子。(3)由文献可知,分子是否存在偶极矩的判定依据是:分子中只要有两个对称元素仅仅相交于一点时,则分子就不存在偶极矩[2];或只有属于Cn、Cnv群的分子才有偶极矩[7]。对于同核三原子的O3分子,如果为正三角形结构,则属于D3h群,不会形成分子的极性,即产生分子偶极矩,但是现有实验证明 O3为极性分子[6]。由上可知,正三角形结构的O3分子就会与实验结果相矛盾,即O3分子不能形成正三角形结构。
2.2.线型结构
如果O3分子为直线型结构:由HMO法计算结果知道,分子中各个氧原子的电荷密度分别为q1=q3=1.500,q2=1.000;各原子间的π键键级均分别为:P12= P23=0.707,P13=0 。直线型三原子分子属于 D∞h群,分子中的中心氧原子(2#)与两端氧原子(1#、3#)的电荷密度是不同的,从而在1#与2#氧原子和2#与3#氧原子之间会产生不为零的键矩,但是对于分子整体结构而言,分子的偶极矩为零,这与O3分子存在偶极矩相矛盾,由此可知,O3分子不可能形成直线型结构。
2.3.型结构
如果O3分子为V型结构:由HMO法计算结果知道,V型结构的O3分子中各个原子的电荷密度和各原子间的键级与直线型结构的结果是相同的,1#与2#氧原子和2#与3#氧原子之间会产生不为零的键矩。由于分子为 V型结构,属于 C2v群,对于分子整体结构而言,其分子的偶极矩不为零,这与其具有极性的实验结果是一致的,所以O3分子为V型结构是合理的解释。
由V型分子的能级图可知,其π-MO的电子组态为Ψ12Ψ22Ψ30,4个π电子会成对地填充到π-MO中,使MO中无单电子存在,从而很好地说明O3是反磁性分子。
O3分子形成后的总能量为4α+2(βπ0),组成这些π-MO的原子轨道的总能量为4α,因此O3分子形成离域的π-MO后,体系总能量降低了2,从而使分子更加稳定,因此O3分子在常温下能够稳定存在。但是由于形成的是π-MO,其能级相对较高,所以其化学活性在一定条件下就会被激发起来,其主要表现是强氧化性。
[1]周公度,段连运.结构化学基础[M].北京:北京大学出版社.2002.
[2]潘道皑,赵成大,郑载兴.物质结构[M].北京:高等教育出版社,1989.
[3]范明舫.用 HMO 理论估算链状同系物的临界温度[M].分子科学学报,2006,21(1):59-62.
[4]朱宏耀,江元生.苯型烃的 HMO-VB 理论分析[J].化学学报,1992,50:772-777.
[5]王义,徐光宪.直链烷烃的HMO处理[J].科学通报,1990,19:1472-1473.
[6]北京师范大学等.无机化学[M].北京:高等教育出版社,1992.
[7]夏少武.简明结构化学教程[M].北京:化学工业出版社,2001.
