HPLC 法测定蝙蝠葛碱与大鼠和人血浆蛋白的结合率
2011-08-07高秀蓉蒋学华王婷四川大学华西药学院临床药学与药事管理学系成都市6004成都医学院药学院药剂教研室成都市60083
高秀蓉,蒋学华,王婷(.四川大学华西药学院临床药学与药事管理学系,成都市6004;2.成都医学院药学院药剂教研室,成都市 60083)
北豆根为防己科蝙蝠葛属多年生藤本植物蝙蝠葛Menispermum dauricumDC的干燥根茎,1977年版《中国药典》始见北豆根,具有抗炎、抗菌、抗癌、清热解毒、消肿利咽和止痛的功效,以及心血管系统作用,目前临床用于治疗扁桃体炎、咽喉肿痛、牙龈肿痛等[1]。北豆根主要成分为生物碱,现已知北豆根中含有近20种生物碱,总碱含量为1%以上,其中含量最高的为蝙蝠葛碱(Dauricine)[2,3]。蝙蝠葛碱是一种广谱的抗心律失常药,适用于快速型心律失常,尤其对房性、交界性和室性早搏效果较佳;对预激综合征伴室性心动过速效果也好[4,5]。
血浆蛋白结合率是药物重要的药动学参数,药物与血浆蛋白结合后将不能被机体处置(如分布、代谢和排泄),仅游离药物能发生这些药动学过程和发挥药理作用,所以血浆蛋白结合率的高低将直接影响药物在血中游离药物的浓度,从而影响药物药理作用的发挥和毒性作用[6]。蝙蝠葛碱属于双苄基异喹啉类生物碱,属于毒性药物,治疗窗较窄,本课题组对蝙蝠葛碱在大鼠体内药动学过程进行了研究,发现其口服生物利用度低(约15%),生物半衰期较长(大鼠血浆中约5~7 h),对其血浆蛋白结合率进行测定将有助于解释这些体内药动学参数和体内过程。而目前尚未见文献对蝙蝠葛碱血浆蛋白结合率进行测定,故笔者采用高效液相色谱(HPLC)法对蝙蝠葛碱的人和大鼠血浆蛋白结合率进行了测定,以期为临床合理设计蝙蝠葛碱给药方案提供依据,也为蝙蝠葛碱制剂的研发提供参考。
1 仪器与材料
1.1 仪器
LC-2010C HT型高效液相色谱仪(日本Shimdazu公司);BP210S型、CP235D型电子天平(德国Sartorius公司);Votex Genius 3型旋涡混合仪(德国IKA公司);HGC-36AC型氮吹仪(上海泉岛科贸有限公司);CQ-205型超声清洗仪(上海超声波仪器厂);TDL-5型台式离心机(上海安亭科学仪器厂);超纯水机(成都品成科技有限公司);透析袋(上海欧韦达仪器科技有限公司,截留分子量8 000~15 000 Da)。
1.2 试药
蝙蝠葛碱原料药(纯度:>98.0%)、蝙蝠葛碱标准品(纯度:>99.0%)均由深圳市维琪生物科技有限公司提供;粉防己碱(内标,中国药品生物制品检定所,纯度:>99.5%);HPLC所用试剂为色谱纯,其余试剂均为分析纯,水为超纯水。
1.3 动物
SD大鼠10只,♂,体重220~250 g,由四川大学实验动物中心提供(动物生产许可证号:SCXK(川)2005-02);大鼠腹主动脉取血,肝素抗凝,离心,分离血浆,-20℃贮藏,备用。人血浆由成都市血液中心提供。
2 方法与结果
2.1 溶液的制备
2.1.1 空白透析液的制备 称取磷酸二氢钠1.563 g,氯化钠4.437 g,加超纯水溶解,用1 mol·L-1的氢氧化钠调节pH值至7.4,定溶至500 mL,0.45 μm的微孔滤膜过滤后,即得0.02 mol·L-1、pH7.4的磷酸二氢钠缓冲液(含0.15 mol·L-1氯化钠)。
2.1.2 标准曲线工作溶液的制备 称取干燥至恒重的蝙蝠葛碱标准品,用甲醇溶解制备成浓度为302.00µg·mL-1的蝙蝠葛碱贮备液,吸取该贮备液2 mL,甲醇定容于10 mL容量瓶中,得浓度为60.40µg·mL-1的工作溶液①,精密吸取工作溶液①5 mL,置10 mL量瓶中,以甲醇定容,得浓度为30.20µg·mL-1的工作液②;依次往下稀释,分别得浓度为15.10、7.55、3.78、1.89和0.94 µg·mL-1的系列工作液,4 ℃贮藏,备用。
2.1.3 内标液的制备 称取粉防己碱1.44 mg,用甲醇溶解并定容至50 mL,得28.8 μg·mL-1的内标贮备液。
2.2 色谱条件
色谱柱:Sepax C18(250 mm×5.6 mm,5 μm);流动相:甲醇-水(78∶22,含1%三乙胺和0.21%磷酸);流速:1.0 mL·min-1;检测波长:284 nm;柱温:30 ℃;进样量:20 μL。
2.3 样品处理
2.3.1 透析内液样品的处理 精密吸取透析袋内液100 μL,加入25 μL内标液,涡旋混匀后加入500 μL乙酸乙酯、100 μL 2 mol·L-1的氢氧化钠溶液碱化,强力混旋5 min,13 000 r·min-1离心5 min,取上清液用N2吹干,用100 μL流动相复溶,混旋,13 000 r·min-1离心5 min,取上清液于“2.2”项下色谱条件测定。
2.3.2 透析外液样品的处理 取透析袋外液100 μL,13 000 r·min-1离心5 min,取上清液于“2.2”项下色谱条件测定。
2.4 方法学验证
2.4.1 方法专属性考察 分别取空白血浆、空白透析液及含蝙蝠葛碱的血浆样品或透析液样品,按照“2.3”项下方法处理样品,在“2.2”项下色谱条件测定,可见空白血浆、空白透析液在此条件下对蝙蝠葛碱的测定无干扰。蝙蝠葛碱HPLC见图1。
2.4.2 标准曲线的制备 (1)透析外液:取标准曲线工作溶液各25µL,加入75µL空白透析液,涡旋混匀,得蝙蝠葛碱溶液浓度分别为15.10、7.55、3.78、1.89、0.94、0.47、0.24 µg·mL-1的透析外液标准溶液。按“2.3”项下方法进行样品处理和“2.2”项下色谱条件测定。以蝙蝠葛碱的峰面积积分值(Y)为纵坐标,蝙蝠葛碱浓度(X)为横坐标,进行线性回归,得蝙蝠葛碱回归方程为Y=34 026.70X+2 801.21(r=0.999 6)。结果表明,透析外液中的蝙蝠葛碱检测浓度在0.24~15.10 μg·mL-1范围内与其峰面积积分值线性关系良好。(2)透析内液(大鼠血浆):取标准曲线工作溶液各25µL,分别加入75µL空白大鼠血浆,涡旋混匀,得蝙蝠葛碱溶液浓度分别为15.10、7.55、3.78、1.89、0.94、0.47、0.24 µg·mL-1的含药血浆,然后分别加入25 µL内标液。按“2.3”项下方法处理样品和“2.2”项下色谱条件进行测定。以蝙蝠葛碱标准品和粉防己碱内标液的峰面积之比(Y)为纵坐标,血浆中的蝙蝠葛碱浓度(X)为横坐标,进行线性回归,得回归方程为Y=0.155 8X+0.005 7(r=0.998 8)。结果表明,大鼠血浆中蝙蝠葛碱检测浓度在0.24~15.10 μg·mL-1范围内与蝙蝠葛碱标准品和粉防己碱内标液的峰面积之比线性关系良好。(3)透析内液(人血浆):取标准曲线工作溶液各25µL,加入75µL空白人血浆,涡旋混匀,得蝙蝠葛碱浓度分别为15.10、7.55、3.78、1.89、0.94、0.47、0.24 µg·mL-1的含药血浆,然后分别加入25µL内标液。按“2.3”项下方法处理样品和“2.2”项下色谱条件测定。以蝙蝠葛碱标准品和粉防己碱内标液的峰面积之比(Y)为纵坐标,血浆中的蝙蝠葛碱浓度(X)为横坐标,进行线性回归,得回归方程为Y=0.172 3X+0.004 0(r=0.998 9)。结果表明,人血浆中蝙蝠葛碱检测浓度在0.24~15.1 μg·mL-1范围内与蝙蝠葛碱标准品和粉防己碱内标液的峰面积之比线性关系良好。
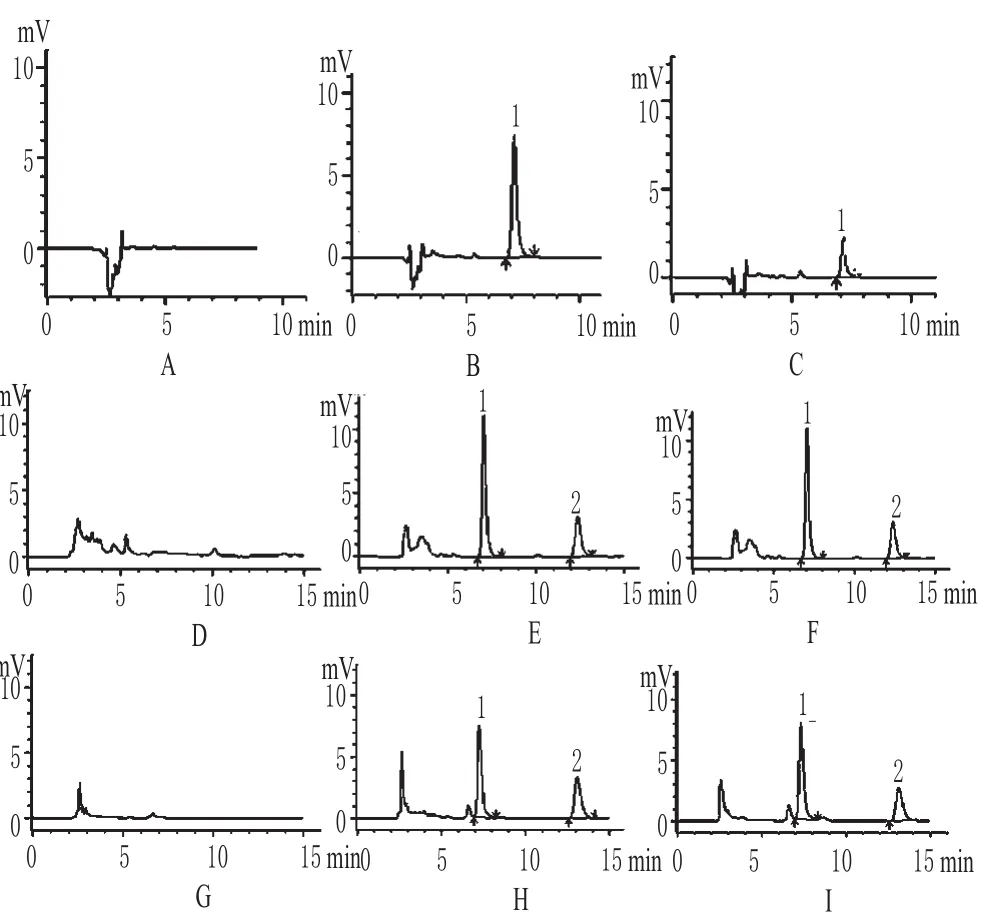
图1 蝙蝠葛碱的HPLC图Fig 1 HPLC chromatograms of dauricine
2.4.3 血浆样品提取回收率考察 精密吸取大鼠血浆(或人血浆)75 μL,加入25 μL标准曲线工作溶液,配制蝙蝠葛碱高、中、低浓度(7.55、1.89、0.47 µg·mL-1)样品,以提取后的蝙蝠葛碱峰面积与未经提取直接进样所获得色谱峰面积之比,考察样品的绝对提取回收率,每个浓度平行测定5份。结果表明,蝙蝠葛碱在大鼠和人血浆中提取回收率较高,基本达到80%以上。蝙蝠葛碱和内标在大鼠和人血浆中的萃取回收率见表1(表中IS为内标)。
2.4.4 精密度和方法回收率考察 (1)透析外液精密度考察:按“2.4.2”项下方法操作,测定蝙蝠葛碱高、中、低(7.55、1.89、0.47µg·mL-1)浓度样品,测定日内精密度和一周内3 d的日间精密度,每个浓度平行5份,结果见表2。(2)大鼠血浆精密度考察:按“2.4.2”项下方法测定蝙蝠葛碱高、中、低(7.55、1.89、0.47µg·mL-1)浓度样品,测定日内精密度和一周内3 d的日间精密度,每个浓度平行5份,结果见表2。(3)人血浆精密度考察:按“2.4.2”项下方法测定蝙蝠葛碱高、中、低浓度(7.55、1.89、0.47 µg·mL-1)样品,测定日内精密度和一周内3 d的日间精密度,每个浓度平行5份,结果见表2。
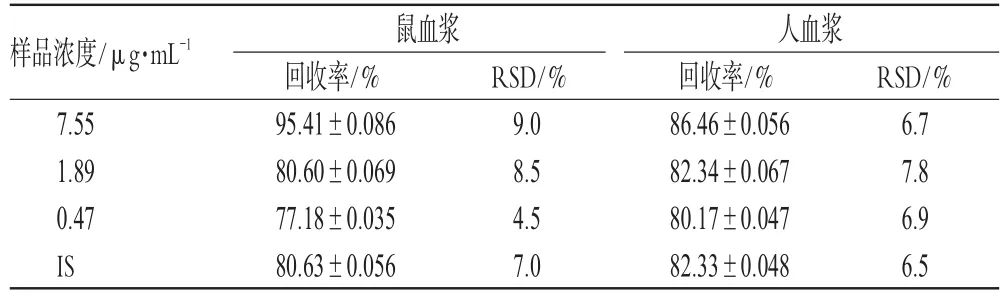
表1 蝙蝠葛碱和内标在大鼠和人血浆中的萃取回收率(%,n=4)Tab 1 Extraction recovery rates of dauricine and IS in rat and human plasma(%,n=4)
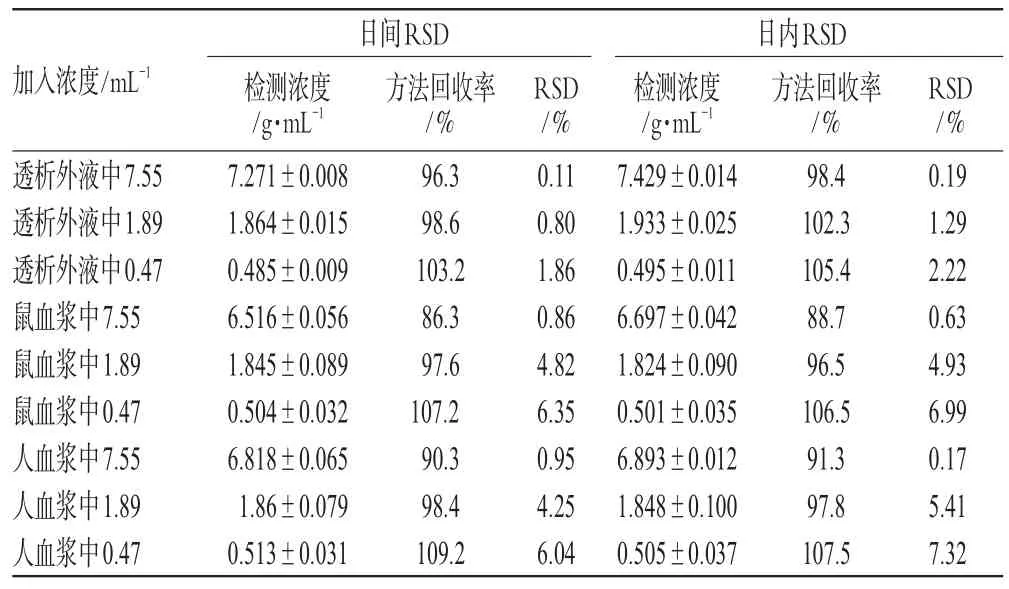
表2 精密度试验结果Tab 2 Results of precision tests
2.4.5 蝙蝠葛碱稳定性考察 (1)蝙蝠葛碱在透析外液和透析内液中稳定性考察:按“2.4.2”项下方法配制蝙蝠葛碱高、低(7.55、0.47 µg·mL-1)浓度样品,于4 ℃放置,分别于0、12、24、36 h取样进行测定。结果,RSD=2.63%,表明4℃条件下蝙蝠葛碱在透析外液中放置36 h稳定。(2)蝙蝠葛碱在大鼠血浆中的稳定性考察:按“2.4.2”项下方法,配制蝙蝠葛碱高、低(7.55、0.47 µg·mL-1)浓度样品,于4℃放置,分别于0、12、24、36 h取样进行测定。结果,RSD=3.13%,表明4℃条件下蝙蝠葛碱在大鼠血浆中放置36 h稳定。(3)蝙蝠葛碱在人血浆中的稳定性考察:按“2.4.2”项下方法,配制蝙蝠葛碱高、低(7.55、0.47µg·mL-1)浓度样品,于4 ℃放置,分别于0、12、24、36 h取样进行测定。结果,RSD=4.25%,表明4℃条件下蝙蝠葛碱在人血浆中放置36 h稳定。
2.5 透析膜物理吸附的考察
2.5.1 蝙蝠葛碱供试液的制备 称取蝙蝠葛碱2.59 mg,用稀盐酸溶解后用1 mol·L-1氢氧化钠调节pH值至6~7,用PBS定容至250 mL,得10.36 μg·mL-1高浓度供试液;取高浓度供试液50 mL,用PBS定容至100 mL,得5.18 μg·mL-1的中浓度供试液;取高浓度供试液10 mL,用PBS定容至100 mL,得1.04 μg·mL-1低浓度供试液。
2.5.2 考察透析膜对药物的物理吸附作用 先将透析袋预处理后在空白透析液中室温浸泡24 h。取一端扎紧的透析袋,除去袋内外水分,透析袋内加入2 mL(V1)空白透析液,将其放人盛有20 mL(V2)含药(药物浓度为c1)透析液的广口瓶中,4℃中放置36 h至其平衡,然后测定透析袋外的药物浓度(c外)(n=3)。透析膜对药物的吸附率用下式计算:
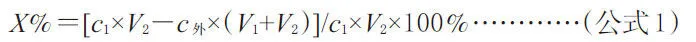
结果,蝙蝠葛碱在高、中、低(10.36、5.18、1.04 μg·mL-1)浓度下的吸附率分别为4.1%,3.3%,1.61%,表明透析袋对蝙蝠葛碱几无吸附作用。
2.6 大鼠血浆中平衡时间的考察及血浆蛋白结合率的测定[7]
试验前先将透析袋预处理后在空白透析液中室温浸泡24 h。取一端扎紧的透析袋,除去袋内外水分,精密吸取2 mL空白大鼠或人血浆加至透析袋中,扎紧袋口,悬浮于盛有20 mL含药透析液的广口棕色瓶中,调整透析袋位置使袋内外液面保持同一水平,并避免贴瓶壁,密封瓶口,置于4℃中放置,分别于6、12 h取透析袋内外样品100µL,待测。待24 h透析结束时,吸取透析外液,加入三氯醋酸溶液,若有白色絮状物出现,则证明有血浆蛋白漏出,该样品作废;无血浆蛋白漏出者,分别取透析袋内外样品并测定药物浓度,计算血浆蛋白结合率。血浆蛋白结合率的计算公式如下:

结果表明,蝙蝠葛碱在24 h时在大鼠或人血浆中透析已达到平衡;在高、中、低(10.36、5.18、1.04 μg·mL-1)浓度下,蝙蝠葛碱大鼠血浆蛋白结合率分别为(69.63±1.3)%、(68.64±1.10)%、(72.54±0.50)%,人血浆蛋白结合率分别为(82.10±1.00)%、(84.96±0.70)%、(78.79±0.6)%,经过t检验分析,同种属内高、中、低浓度下无显著性差异(P>0.05)。表明在1.04~10.36 μg·mL-1浓度范围内,蝙蝠葛碱的大鼠或人血浆蛋白结合率无浓度依赖性,蝙蝠葛碱具有中等偏强的血浆蛋白结合率。蝙蝠葛碱的大鼠和人血浆蛋白结合率测定结果见表3。
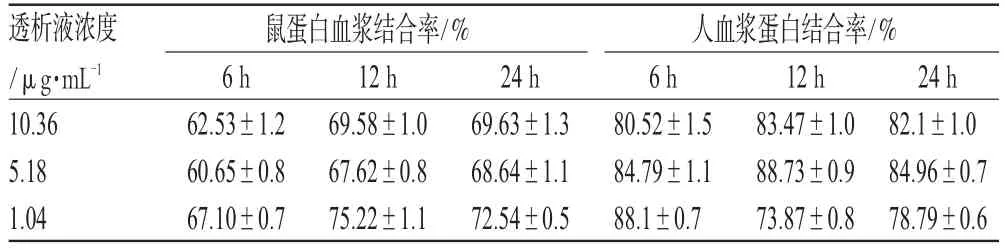
表3 蝙蝠葛碱的大鼠和人血浆蛋白结合率测定结果(n=3)Tab 3 Results of binding rate of dauricine to rat and human plasma protein(n=3)
经过t检验分析,比较蝙蝠葛碱在大鼠和人血浆中蛋白结合率,蝙蝠葛碱血浆蛋白结合率具有种属差异性(P<0.05),且人血浆蛋白结合率较大鼠血浆蛋白结合率高。
3 讨论
目前,血浆蛋白结合率最常用的方法为平衡透析法,与其他方法比较,该方法具有简单、快速和成本较低的特点,但同时也存在一些缺点,如通常平衡时间较长、血浆和药物在37℃下长时间放置易不稳定或变质、透析膜可能对药物存在吸附等问题。为克服血浆变质的问题,有许多选择在低温条件下(如4℃)进行试验,本试验在预试验时发现蝙蝠葛碱在37℃条件下长时间放置(放置12 h)不稳定,血浆蛋白也易变质,故选择在4℃条件下进行试验。
本研究结果表明,蝙蝠葛碱在1.04~10.36 μg·mL-1范围内,蝙蝠葛碱的大鼠或人血浆蛋白结合率无浓度依赖性,说明蝙蝠葛碱在该浓度下与血浆蛋白的结合未达到饱和。本课题组在前期的对蝙蝠葛碱在体实验中研究发现,蝙蝠葛碱大鼠iv后半衰期期较长(约5~7 h),推测与其较高强度的血浆蛋白结合率有直接关系。
由于体外试验条件(透析温度、药物浓度和缓冲液pH值等)均不能完全模拟药物在体内的环境,故体外试验结果不能完全代表药物的体内血浆蛋白结合率,该结果可作为体内真实血浆蛋白结合率的参考。可进一步进行体内实验,研究蝙蝠葛碱在组织中(如血浆、心、肝、脾、肺、肾、脑等)的分布,比较药物在血浆和组织中浓度差异,从而判断其与血浆蛋白结合的程度,体内、外研究结果结合起来,结果将更为可靠。
[1] 国家药典委员会编.中华人民共和国药典(一部)[S].2010年版.北京:中国医药科技出版社,2010:92.
[2] 潘锡平,胡崇家,曾繁典.咸宁产编蝠葛生物碱成份的分离与鉴定[J].中药材,1998,21(9):456.
[3] 潘锡平,胡崇家.咸宁产编蝠葛生物碱成份分析[J].中药材,1991,14(12):31.
[4] 郭东林,夏敬生,顾世芬,等.蝙蝠葛碱对奎尼丁诱发的豚鼠乳头肌早后去极化及触发活动的作用[J].中国药理学与毒理学杂志,1998,12(4):253.
[5] XIA Jing-Sheng,TU Hong,LI Zhen,et al.Dauricine suppressed CsCI-induced early after depolarizations and triggered arrhythmias in rabbit heart in vivo[J].Acta Pharmacologica Sinica,1999,20(6):513.
[6] 梁文权.生物药剂学与药物动力学[M].第3版.北京:人民卫生出版社,2007:106.
[7] 黄必义,徐 勤.芒果苷与大鼠体外血浆蛋白结合率的测定方法研究[J].中国药房,2009,20(30):2 333.
