花椒RAPD-PCR反应体系的建立与优化Δ
2011-08-07宋丽刘友平成都中医药大学药学院中药材标准化教育部重点实验室成都市611137成都医学院药学院成都市610083
宋丽,刘友平(1.成都中医药大学药学院中药材标准化教育部重点实验室,成都市611137;2.成都医学院药学院,成都市 610083)
随机扩增的多态性DNA(Random amplified polymorphic DNA,RAPD),是美国的Williams和Welsh两个研究小组于1990年同时提出的一种以聚合酶链式反应(Polymerase chain reaction,PCR)为基础,运用随机引物扩增,寻找多态性DNA片段的遗传标记技术,具有快速、简便、成本低、DNA用量少、应用范围广等优点[1]。
花椒(Zanthoxyli Pericarpium)为芸香科花椒属植物青椒(Zanthoxylum schinifoliumSieb.et Zucc.)或花椒(Z.bungeanumMaxim.)的干燥成熟果皮,具有“温中止痛,杀虫止痒”的功效[2]。花椒为川产道地药材,甘孜、阿坝、凉山州等地均有栽培,但各地药材质量存在差异[3],因此有必要研究不同产地花椒与青椒的遗传多样性,为花椒的鉴定、选种提供依据。由于目前还未见有关花椒与青椒RAPD-PCR分析方面的报道,因此本文所建立的反应体系可为花椒与青椒的遗传多样性研究打下良好基础。
1 仪器与试药
1.1 仪器
MyCycler型梯度PCR仪、Geldoceq型紫外凝胶成像分析仪(美国Bio-Rad公司);TGL-16G型高速离心机(上海嘉鹏科技有限公司);HB-100型恒温金属浴(杭州博日科技有限公司);DYY-Ⅲ2型稳压稳流电泳仪(北京市六一仪器厂);MDF-U50V型超低温冰箱(日本Sanyo公司)。
1.2 试药
花椒采自四川省内花椒(Z.bungeanumMaxim.)、青椒(Z.schinifoliumSieb.et Zucc.)的嫩叶或嫩芽。花椒的产地见表1。样品采集后,立即装入放有干燥剂变色硅胶的封口袋内,于4℃贮藏,备用。十六烷基三甲基溴化铵(CTAB)、核糖核酸酶A(RNase A)、琼脂糖、DNA Maker DL 15 000、三磷酸脱氧核糖核苷酸(dNTPs)、Taq聚合酶、DNA Maker DL 2000(大连宝生物工程有限公司);随机引物(北京赛百盛基因技术有限公司);聚乙烯吡咯烷酮(PVP)、β-巯基乙醇、氯仿、异戊醇、异丙醇、乙醇、氯化钠(成都市科龙化工试剂厂)。

表1 花椒的产地Tab 1 The habitat of Zanthoxyli.pericarpium
2 方法与结果
2.1 DNA的提取
采用CTAB法提取总DNA。取样品约50 mg,加入少量石英砂和PVP粉,于-80℃超低温冰箱中放置过夜。快速研磨成细粉,转移到干净灭菌的1.5 mL Eppendorf(EP)管中,加入65℃预热的3%CTAB缓冲液700 μL和β-巯基乙醇50 μL,混匀,置65℃金属浴中,约10 min震荡1次。冷至室温,加等体积的氯仿-异戊醇(24∶1)抽提2次,每次抽提后10 000 r·min-1离心10 min,将水相转移到另一干净灭菌的1.5 mL EP管中。加入1/2体积5 mol·L-1的NaCl溶液和等体积预冷至-20℃的异丙醇,轻轻颠倒混匀,置于-20℃冰箱中沉淀1 h。10 000 r·min-1离心10 min,小心倾去上清液,用70%乙醇50 μL洗涤2次,每次洗涤后10 000 r·min-1离心2 min,倒置于滤纸上自然干燥1 h。加入50 μL ddH2O,置于37℃金属浴中0.5 h溶解。加入1 μg·μL-1的RNase A 2 μL,置于37 ℃金属浴中水解1 h。冷至室温,4℃贮藏,备用。
考察提取时间30、45、60 min,均可获得足够的DNA用于PCR,故采用提取时间为30 min。DNA提取时间的优化见图1。

图1 DNA提取时间的优化Fig 1 The optimization of DNAextracting time
2.2 DNA的检测
采用1.0%琼脂糖凝胶电泳检测总DNA。取DNA样品5 μL,与6×Loading Buffer 1 μL混匀后点于凝胶孔中,与3 μL DNA Maker DL 15 000同置1×TAE缓冲液中,于100 V电压下电泳,紫外成像检测。
2.3 PCR体系
考察MgCl2、dNTPs、引物、模板DNA和Taq酶5个因素,每个因素取4个浓度水平,采用正交设计进行优化。因素水平见表2;正交试验结果见表3。

表2 因素水平Tab 2 Factors and levels

表3 正交试验结果Tab 3 Results of orthogonal experiment
11号试验方案可获得清晰、稳定的PCR扩增条带,故在25 μL反应体系中应加入ddH2O 13.5 μL、25 mmol·L-1的 MgCl22.0 μL、2.5 mmol·L-1的 dNTPs 2.0 μ L、10 ×Buffer 3.0 μL、10 ng·μL-1的引物2.0 μL、模板DNA2.0 μL和 5 IU Taq 酶 0.5 μL。PCR体系的优化见图2。
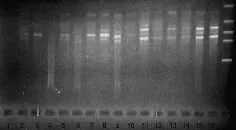
图2 PCR反应体系的优化Fig 2 The optimization of PCR reaction system

图3 退火温度的优化Fig 3 The optimization of renaturation temperature

图4 循环次数的优化Fig 4 The optimization of circulation number
2.4 PCR程序
考察退火温度和循环次数,43.8℃的退火温度和45次循环可获得清晰、稳定的PCR扩增条带,故PCR程序为95℃预变性3 min,94℃预变性2 min,94℃变性50 s,43.8 ℃退火1 min,72 ℃延伸 1 min 20 s,45 个循环,72℃最后延伸5 min。退火温度的优化见图3;循环次数的优化见图4。
2.5 扩增产物的检测
采用1.7%琼脂糖凝胶电泳检测扩增产物。取扩增产物 5.0 μL,与 6×Loading Buffer 1.0 μL混匀后点于凝胶孔中,与 3.0 μL DNA Maker DL 2 000同置1×TAE缓冲液中于100 V电压下电泳,紫外成像检测。
2.6 RAPD-PCR体系的稳定性考察
按“2.3”、“2.4”项下方法操作,对表1中的花椒样品进行PCR扩增,均可获得清晰、稳定的PCR扩增条带。花椒与引物TGCTCTGCCC扩增产物的电泳图见图5。
3 讨论
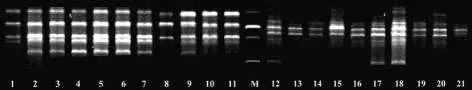
图5 花椒与引物TGCTCTGCCC扩增产物的电泳图Fig 5 Electrophoretogram of amplified products of Zanthoxyli Pericarpium and primer TGCTCTGCCC
花椒中的杂质如多糖、多酚、蛋白质等会影响DNA的提取、纯化以及PCR扩增,因此笔者以往参考文献[4]采用改良的CTAB法提取DNA,并加入石英砂增加植物细胞壁的破碎,加入氯仿-异戊醇(24∶1)抽提蛋白质,加入PVP、β-巯基乙醇和 5 mol·L-1的 NaCl除去多糖、多酚等杂质[4,5]。此外,由于RAPD反应对DNA的质量要求不高,因此在加入少量Rnase酶除去RNA后,不再抽提蛋白质,试验证明,这样可减少DNA的损失,并且不影响PCR扩增。
RAPD反应的影响因子较多,反应体系中Mg2+、dNTP、模板DNA、引物,Taq聚合酶等的浓度直接影响着试验结果的准确性和重复性,若是每项一一考察,不仅操作烦琐,而且耗费大量的时间和试验经费,因此本文采用正交试验考察各影响因子,大大简化了试验过程,节约了时间和经费。此外,PCR的各成分之间的浓度比例是一个动态过程,反应体系中改变某成分的浓度时相应改变其他成分的浓度才能有效扩增,因此通过正交试验可得到多种有效组合,有利于根据试剂情况选用不同的组合[6]。
[1] 白 音,包英华,王文全,等.美花石斛RAPD-PCR反应体系的建立[J].时珍国医国药,2007,18(3):521.
[2] 国家药典委员会编.中华人民共和国药典(一部)[S].2010年版.北京:中国医药科技出版社,2010:149.
[3] 徐国钧,徐珞珊,王峥涛.常用中药材品种整理和质量研究(第3册)[M].福州:福建科学技术出版社,2001:532.
[4] 童巧珍,周日宝,刘湘丹,等.药用百合鳞叶中总DNA提取方法的研究[J].中国药房,2008,19(6):406.
[5] 王 婷,李爱贤,郭庆梅,等.忍冬叶片基因组DNA的提取与分析[J].山东中医药大学学报,2008,32(3):247.
[6] 李劲平,王培训.正交设计在RAPD-PCR条件优化中的应用[J].中药新药与临床药理,2004,15(4):265.
