内毛细胞带状突触结构及功能的研究进展
2011-07-28陈丽平综述商秀丽审校
陈丽平(综述),商秀丽(审校)
(中国医科大学附属第一医院神经内科,沈阳110001)
耳蜗能够编码不同频率和强度的声音信号,这一过程由内毛细胞及外毛细胞参与。外毛细胞对声音信号具有放大作用,使耳蜗对声音频率有高度的敏感性和选择性[1]。内毛细胞将不同频率、强度、时间性质的声音信号传递给中枢神经系统。内毛细胞将声波的振动由化学信号转换为电信号,形成电势差,刺激神经递质释放到相应的螺旋神经元,再由螺旋神经元投射到中枢神经系统。听感觉突触——带状突触对信号的传递必需准确,并且能维持很长一段时间。毛细胞上带状突触的形态和数量对听觉系统具有重要作用[2,3]。带状突触在形态学和功能学上具有独特性:其活动区只位于几个固定的区域,即快速囊泡释放区,但其主要特征是被称为带状突触的结构。带状突触通过动态作用精确、快速而又持续地释放囊泡,该过程非常复杂[4]。但是其精确的功能和作用方式是如何完成的仍不清楚。
1 带状突触的超微结构
带状突触指位于突触前膜的特殊结构,因其呈带状而被命名[5]。内耳的内毛细胞通过带状突触将不同的声音信号传递给听觉传入神经。内毛细胞形成带状突触的突触前膜,传入神经形成具有突触后电子致密体的突触后膜。带状突触的囊泡分为三种:①胞质内游离囊泡;②与带状突触相连的囊泡;③在带状突触小体的底端为锚定突触前膜的囊泡(图1)。不同类型的细胞,带状突触的结构、数量及大小不同,即使在同一个毛细胞上,带状突触的形状也不相同。带状突触主要存在于毛细胞、视网膜上[6]。在视网膜上,视杆细胞、视锥细胞和双极细胞形成带状突触;内耳带状突触位于内毛细胞及前庭毛细胞下[5]。在不同动物耳蜗轴上的不同位置以及不同发育阶段,带状突触的形态、大小及数量均有所不同,甚至在同一个毛细胞的不同活性区域上带状突触的阈值、形态、大小及数量也不同[4]。随着听力水平的变化,带状突触的形态和数量也发生变化。越来越多的研究表明,即使在一个哺乳动物耳蜗的毛细胞内,不同带状突触上的钙离子通道数量也不同[7]。因而,带状突触后传入纤维对声音信号的敏感性相差很大。在不同动物及不同部位毛细胞上,毛细胞的传入神经支配数量相差很大,如前庭传入纤维形成分支连接毛细胞上大约有20个甚至上百个带状突触信息的释放与传入。相反,哺乳类动物耳蜗内毛细胞上的一个带状突触通常只与Ⅰ型传入纤维的一个树突相连[8]。毛细胞的带状突触(也叫致密小体)具有形态特异性,可以为球形、平面或长方体形,大小不一,聚集20~400个囊泡。非哺乳类毛细胞上的带状突触可能更大(直径为200~400 nm),但哺乳类的毛细胞带状突触的长度≤200 nm,与视网膜上双极细胞的带状突触大小相近。哺乳类动物耳蜗毛细胞带状突触聚集100~200个囊泡,在每个带状突触上伴随100~200个电压-门控钙通道[7]。
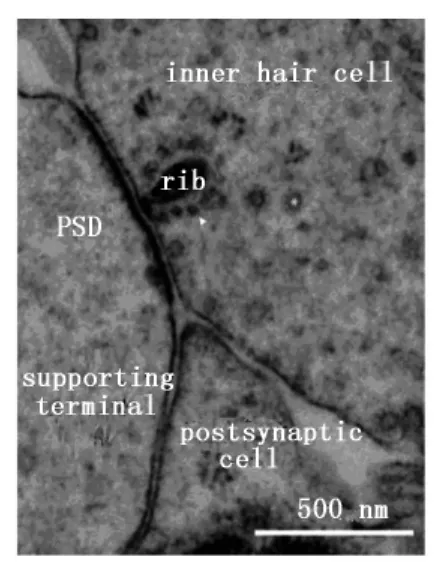
图1 内毛细胞下带状突触的结构
2 带状突触的分子组成
RIBEYE是带状突触上所知的唯一结构蛋白[9],可能具有酶活性,并具有C-末端结合蛋白1(C-terminal binding protein 1,CtBP1)[10]转录共抑制及溶血磷脂酸乙酰辅酶转移酶活性[11]。已经克隆出RIBEYE的cDNA,RIBEYE具有一个特异的氨基末端富含脯氨酸的A区域,这是在其他细胞上所没有的蛋白结构,其与CtBP2具有基因同源性。
CtBP1与RIBEYE的B区域相关,是带状突触的一个组成部分[5]。CtBP1与高尔基的分裂相关,但其在带状突触上的功能至今尚不清楚。CtBP1和CtBP2/RIBEYE(B)-区域连接至位于带状突触活性区域的胞质蛋白Bassoon上。Bassoon与Piccolo一样,都是位于活性区域的细胞基质大分子物质,很有可能与活性区域上带状突触的锚定有关[12,13]。带状突触减少可造成突触病理源性的听力损伤,即耳蜗的扩音能力正常,而听觉诱发电位异常。Rab3反应蛋白对于启动囊泡释放和Ca2+依赖性囊泡释放具有重要的作用[14]。KIF3A是驱动蛋白Ⅱ的构成部分[15]。因为在带状突触上只找到了KIF3A,而未找到驱动蛋白Ⅱ的其他构成部分,因此对带状突触的具体功能至今还不清楚。在视网膜的动力蛋白还有MyosinVa和MyosinⅦa,MyosinⅤa基因突变时,将出现畸形带状突触[4]。
在耳蜗毛细胞带状突触上含有一个C2区域的跨膜蛋白Otoferlin。OTOF基因有28个编码外显子,在成年鼠的内毛细胞和壶腹晴的Ⅰ、Ⅱ型毛细胞中都有表达(Ⅱ型毛细胞中表达微弱),其编码的蛋白质是Otoferlin,由1997个氨基酸组成,相对分子质量量为140.5 ×103[16]。它是带状突触信号释放所必需的结构成分,而在一些耳聋患者中Otoferlin也发生了突变[17]。研究发现,Otoferlin位于与带状突触相连的囊泡上,它的主要功能是将Ca2+与水溶性N-乙基马来酰亚胺敏感因子黏附蛋白受体突触融合蛋白1和突触连接蛋白体连接在一起,使突触囊泡膜与突触前膜融合,通过胞吐作用释放神经递质[13]。目前,对于这些带状突触所特有的复合物的具体功能还不是很清楚。尽管Otoferlin和其他很多钙结合蛋白在耳蜗毛细胞中起重要作用,但具体功能还不确定[18,19]。而且,不同细胞类型的带状突触引起突触囊泡释放钙感受器的敏感性不同。钙感受器具有高亲和性和低协同性,这就允许了个别钙通道的任意开放,从而兴奋信号能使突触后靶点除极,引起突触囊泡释放[20]。相反,耳蜗毛细胞具有低亲和性和高协同性,适合于高同步性释放的特征[21]。
3 带状突触的可塑性
即使在一种细胞类型上,带状突触的结构、功能也可能不同。带状突触具有动态结构,其结构改变可由自身改变或外界环境改变所引起。在光照下,某种结构从小鼠视杆细胞带状突触上解离出来,无光照时,该物质又回到带状突触上。带状突触结构的改变反映了其功能的变化,且与突触的活性相关。当光感受突触释放大量神经递质时(在黑暗中),带状突触延长;在光照时带状突触缩短,胞吐功能降低[22]。毛细胞带状突触的形状与其功能性质也密切相关。在耳蜗高频和低频区域上带状突触的结构不同导致胞吐作用对Ca2+的依赖性不同[12],而在高频听力的带状突触表面积更大。这些反映了带状突触的数量与带状突触的功能具有相关性。
4 带状突触的胞吐作用
现在关于带状突触功能的认识主要基于两类实验:毛细胞突触前膜电容的电压-驱动的改变和对传入神经兴奋性突触后电位的记录。它们的主要差别在于电容是记录整个细胞上所有带状突触的变化,而兴奋性突触后电位显示的是单个带状突触的释放。突触前电容记录与突触后兴奋性突触后电位记录都反映了瞬时释放与钙离子内流的增多呈线性关系。因此,钙通道打开后兴奋性突触后电位增高,给予强的钙离子阻滞剂后兴奋性突触后电位降低。
通过高分辨率显像技术发现,虽然在带状突触上囊泡释放位置不是严格局限于带状上,但连在带状上的囊泡是胞吐“热点”[23]。通过膜片钳技术可以详细地记录到突触递质的释放始于电压门控钙通道的开启[24]。在哺乳类动物内耳毛细胞上的100~200个钙通道中,仅需一小部分(数十个)钙通道的开放就可引起突触囊泡释放。因此,在活动区域钙通道的总数量对囊泡的释放具有重要意义。
5 带状突触的特性
同光感受器细胞一样,内毛细胞传入神经突触缺少突触素、突触体素以及突触结合蛋白1和2[25]。突触素在突触的囊泡运动中发挥作用,突触体素几乎存在于所有的神经终末,而突触结合蛋白在中枢神经系统和神经内分泌细胞的囊泡融合中起钙传感器的作用[26]。
研究发现,带状突触对突触囊泡的持续融合起重要作用,带状突触的每个活动域都拥有一个准备囊泡释放池,以维持囊泡的持续释放[5]。依据细胞类型的不同,带状突触准备囊泡释放池数也不同。电镜观察到,突触囊泡的释放至少有两个动力部分组成:①快速释放,在几毫秒内就能释放。②慢释放,在强刺激时能维持数百毫秒的释放。刺激强度越低,释放时间越长。每个准备释放池有数十个囊泡,可在几微秒内释放。这意味着每个活动域都可能同时释放大量囊泡,从而获得快速的递质释放。
6 带状突触的胞吞作用
胞吞作用与胞吐作用的平衡对避免突触囊泡耗竭具有重要意义[27]。突触末端细胞膜的再摄取非常困难,因为此过程需要大的胞膜翻转[28]。通过电生理分析显示在视网膜和内毛带状突触上至少有两种动力模式参与胞吞过程[27]:快速摄取机制(每次只持续1~2 s)和缓慢模式(10~30 s)。快速过程受突触前Ca2+的调节和细胞内Cl-选择性抑制的调节,缓慢胞吞作用具有Ca2+依赖性。电子显微镜跟踪分析显示带状突触前膜管状内陷入胞内[29]。
7 问题与展望
关于带状突触的报道虽然很多,但其中仍有很多问题不明确,如囊泡是如何连接至带状突触上的?它们间又是如何调节的?作为囊泡的传送带,启动装置带状突触是如何影响这些功能的?不同成分对带状突触精确、快速释放的作用?要回答这些问题,需要遗传学、细胞生物学、生理学及成像技术等多个学科的共同参与。应用新的技术(如在活细胞的高分辨率的光学成像、捕获囊泡的超微方法及电生理实验中改变带状突触功能等方法)有助于理解和观察突触的特性。
[1]Dallos P,Corey ME.The role of outer hair cell motility in cochlear tuning[J].Curr Opin Neurobiol,1991,1(2):215-220.
[2]Liu K,Li S,Jiang X.Quantitative analysis of the ribbon synapse number of cochlear inner hair cells in C57BL/6J mice using the three-dimensional modeling method[J].Sci China C Life Sci,2009,52(9):807-812.
[3]施磊,赵宁,陈丽平,等.C57BL/6J小鼠耳蜗内毛细胞传入神经突触的免疫学标记观察及其意义[J].中华耳科学杂志,2010,8(4):456-460.
[4]LoGiudice L,Matthews G.The role of ribbons at sensory synapses[J].Neuroscientist,2009,15(4):380-391.
[5]Nouvian R,Beutner D,Parsons TD,et al.Structure and function of the hair cell ribbon synapse[J].J Membr Biol,2006,209(2/3):153-165.
[6]Thoreson WB.Kinetics of synaptic transmission at ribbon synapses of rods and cones[J].Mol Neurobiol,2007,36(3):205-223.
[7]Meyer AC,Frank T,Khimich D,et al.Tuning of synapse number,structure and function in the cochlea[J].Nature Neurosci,2009,12(4):444-453.
[8]Matthews G,Fuchs P.The diverse roles of ribbon synapses in sensory neurotransmission[J].Nat Rev Neurosci,2010,11(12):812-822.
[9]Zenisek D,Davila V,Wan L,et al.Imaging calcium entry sites and ribbon structures in two presynaptic cells[J].J Neurosci,2003,23(7):2538-2548.
[10]tom Dieck S,Altrock WD,Kessels MM,et al.Molecular dissection of the photoreceptor ribbon synapse:physical interaction of Bassoon and RIBEYE is essential for the assembly of the ribbon complex[J].J Cell Biol,2005,168(5):825-836.
[11]Valente C,Spano S,Luini A,et al.Purification and functional properties of the membrane fissioning protein CtBP3/BARS[J].Methods Enzymol,2005,404:296-316.
[12]Khimich D,Nouvian R,Pujol R,et al.Hair cell synaptic ribbons are essential for synchronous auditory signaling[J].Nature,2005,434(7035):889-894.
[13]Martinez-Dunst C,Michaels RL,Fuchs PA.Release sites and calcium channels in hair cells of the chick's cochlea[J].J Neurosci,1997,17(23):9133-9144.
[14]Castillo PE,Schoch S,Schmitz F,et al.RIM1alpha is required for presynaptic long term potentiation[J].Nature,2002,415(6869):327-330.
[15]Muresan V,Lyass A,Schnapp BJ.The kinesin motor KIF3A is a component of the presynaptic ribbon in vertebrate photoreceptors[J].J Neurosci,1999,19(3):1027-1037.
[16]Yasunaga S,Grati M,Cohen-Salmon M,et al.A mutation in OTOF,encoding otoferlin,a FER-like protein,causes DFN9,a nonsyndromic form of deafness[J].Nature Genetics,1999,21(4):363-369.
[17]Roux I,Safieddine S,Nouvian R,et al.Otoferlin,defective in a human deafness form,is essential for exocytosis at the auditory ribbon synapse[J].Cell,2006,127(2):277-289.
[18]Johnson SL,Franz C,Kuhn S,et al.Synaptotagmin Ⅳ determines the linear Ca2+dependence of vesicle fusion at auditory ribbon synapses[J].Nature Neurosci,2010,13(1):45-52.
[19]Pangrsic T,Lasarow L,Reuter K,et al.Hearing requires otoferlindependent efficient replenishment of synaptic vesicles in hair cells[J].Nature Neurosci,2010,13(7):869-876.
[20]Duncan G,Rabl K,Gemp I,et al.Quantitative analysis of synaptic release at the photoreceptor synapse[J].Biophys J,2010,98(10):2102-2110.
[21]Beutner D,Voets T,Neher E,et al.Calcium dependence of exocytosis and endocytosis at the cochlear inner hair cell afferent synapse[J].Neuron,2001,29(3):681-690.
[22]Spiwoks-Becker I,Glas M,Lasarzik I,et al.Mouse photoreceptor synaptic ribbons lose and regain material in response to illumination[J].Eur J Neurosci,2004,19(6):1559-1571.
[23]Midorikawa M,Tsukamoto Y,Berglund K,et al.Different roles of ribbon-associated and ribbon-free active zones in retinal bipolar cells[J].Nat Neurosci,2007,10(10):1268-1276.
[24]Platzer J,Engel J,Schrott-Fischer A,et al.Congenital deafness and sinoartrial node dysfunction in mice lacking class D L-type Ca2+channels[J].Cell,2000,102(1):89-97.
[25]Zanazzi G,Matthews G.The molecular architecture of ribbon presynaptic terminals[J].Mol Neurobiol,2009,39(2):130-148.
[26]Safieddine S,Wenthold RJ.SNARE complex at the ribbon synapse of cochlear hair cells:analysis of synaptic vesicle and synaptic membrane-associated proteins[J].Eur J Neurosci,1999,11(3):803-812.
[27]Wu LG,Ryan TA,Lagnado L.Modes of vesicle retrieval at ribbon synapses,calyx-type synapses,and small central synapses[J].J Neurosci,2007,27(44):11793-11802.
[28]Khimich D,Nouvian R,Pujol R,et al.Hair cell synaptic ribbons are essential for synchronous auditory signaling[J].Nature,2005,434(7035):889-894.
[29]Lenzi D,Crum J,Ellisman MH,et al.Depolarization redistributes synaptic membrane and creates a gradient of vesicles on the synaptic body at a ribbon synapse[J].Neuron,2002,36(4):649-659.
