广东屠猪肉样品中大肠杆菌耐药性与毒力特征的分析
2011-05-21廖晓萍王秀梅刘宝涛朱恒乾张美君刘雅红
孙 迎,廖晓萍,王秀梅,孙 坚,刘宝涛,朱恒乾,张 悦,王 杨,张美君,刘雅红*
(1.华南农业大学兽医学院,广东 广州 510642;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/细菌病研究室,黑龙江 哈尔滨 150001)
大肠杆菌( Escherichia coil)存在于人和动物的肠道内,正常情况下,为非致病性共栖菌,特殊条件下(如人体虚弱、免疫力降低或胃肠受损)具有致病性,会导致大肠杆菌病的发生。致病性E.coli是威胁人类和动物健康的常见病原菌,也是食品卫生和流行病学调查的对象。细菌的毒力基因(粘附素和毒素)是细菌致病的基础,能够导致宿主发病或造成隐性感染[1]。因此,通过血清型、毒力相关基因和系统进化背景等研究可以分析大肠杆菌病的流行特点。faeG是K88粘附素的主要粘附性蛋白,与猪腹泻有关。比较流行肠毒素有耐热肠毒素(STa/STb),肠聚集性耐热肠毒素(EAST1)和志贺毒素(Stx2e),丝氨酸蛋白酶转运子毒素(SepA),此外,还有潜在的毒力基因,如溶血素基因(hlyF)[2-3]等。
国外学者已经报道了E.coli耐药性与致病性间的关系,但非致病性E.coli的耐药性与毒力基因间的关系尚不明确。Lucia对弥散粘附型E.coli进行研究发现大多数菌株(70%)呈多重耐药现象,耐药基因与融合黏附素位于同一结合质粒上[1]。Boerlin对患病猪源和健康猪源E.coli的比较研究表明,某些耐药基因和毒力基因位于相同质粒上[2]。Leigh利用统计学分析显示健康猪源E.coli的耐药性和毒力基因无绝对联系[3]。国内的研究主要集中在对人源和动物源病原菌的耐药性和致病性的调查分析上[4-6],本研究对广东屠宰猪肉样品中分离的E.coli进行耐药性和毒力相关特征流行特点的研究,为大肠杆菌病的控制以及合理使用抗生素提供实验依据,避免共选择出耐药性增强的新型致病菌。
1 材料和方法
1.1 菌 株 2009年在广东14个地区的猪屠宰厂随机无菌采集猪肌肉样品,通过革兰氏染色镜检,伊红美兰和麦康凯培养特性观察,以及生化鉴定后分离出112株E.coli;质控菌株(ATCC25922)为本实验室保存。
1.2 主要试剂 LB肉汤、MH肉汤、麦康凯琼脂、MH琼脂和伊红美蓝琼脂均购自广东环凯微生物科技有限公司;大肠杆菌属O型诊断血清购自中国兽医药品监察所;氟苯尼考(FLR)、环丙沙星(CIP)、左氧氟沙星(LEV)、链霉素(STR)、庆大霉素(GEN)、氯霉素(CHL)、头孢曲松钠(CRO)、四环素(TET)、多西环素(DOX)、氨苄西林(AMP)和肠杆菌生化鉴定管均购自杭州天河微生物试剂有限公司;rTaq酶、dNTP和PCR Buffer均购自TaKaRa公司。
1.3 E.coliO血清型鉴定 血清型的鉴定按照中国兽医药品监察所提供的产品说明书进行操作,所有分离株经玻板凝集试验进行初筛,通过试管凝集试验确定是否为O血清型。定型标准为血清的试管凝集价不小于 1∶640。
1.4 药物最小抑菌浓度(MIC) 采用临床与试验标准协会(CLSI)推荐的琼脂板稀释法。10种抗菌药物及其含量分别为:FLR(90%)、CIP(90%)、LEV(96%)、STR(91%)、GEN(96%)、CHL(90%)、CRO(85%)、TET(93%)、DOX(95%)和 AMP(90%)。
1.5 毒力基因的PCR检测 挑取单个菌落接种于2 mL~3 mL的LB肉汤,37℃培养12 h~16 h,提取菌液DNA。根据文献[2-3]和[7]的序列,分别设计7种相关毒力基因的引物(表1),引物由上海生工生物工程技术服务有限公司合成,PCR扩增检测相关毒力基因。
1.6 系统进化背景的多重PCR判定 按照文献[8]方法分别合成扩增chuA基因、YjaA基因和TSPE4.C2基因的引物:chuA(279 bp):5'-GACGAACCA ACGGTCAGGAT-3'和5'-ACAGAAACCATGACCGC CGT-3';YjaA(211 bp):5'-TGAAGTGTCAGGAGAC GCTG-3'和 5'-CAACTCCTTGCGTAAGAGGTA-3';TSPE4.C2(152 bp):5'-GAGTAATGTCGGGGCATT CA-3'和 5'-GCATTATGAAACAACCGCGC-3', 引 物由上海生工生物工程技术服务有限公司合成。多重PCR体系及程序参照文献[8]进行,同时设立阴性对照。根据chuA基因、YjaA基因和TSPE4.C2基因的多重PCR扩增结果,参考文献[8]中E.coli系统进化性别图谱,将E.coli分为A组、B1组、B2组和D组(表2),判断E.coli的分型。

表1 PCR引物序列和退火温度Table 1 Sequences of primers and annealing and fragment size used for PCR

表2 大肠杆菌的系统进化性别检索表Table 2 The chart for identification of E.coliphylogentic group
2 结果
2.1 E.coli血清型鉴定结果 分离获得的112株E.coli分离株通过O抗原定型血清进行鉴定,定型菌株为95株 (84.8%),分属于15个血清型:O6、O8、O13、O18、O62、O65、O78、O83、O92、O126、O131、O133、O158、O159、O163, 其 中 O65(23 株 ,20.5%)、O131(22株,19.6%)、O8(12株,10.1%)和 O158(8株,7.1%)为优势血清型,这4种血清型占定型血清型的67%。剩余菌株包括6株O13(5.4%),6株O78(5.4%),4 株 O83(5%),3 株 O62(3.8%),两株O18(2.5%)、两株 O92(2.5%)、两株 O6(2.5%)和 14株(13.4%)未定型。定型的菌株中,致病性血清型O8和O78分别占定型血清的12%和6%。
2.2 药敏试验和耐药性检测结果 112株E.coli分离株对FLR、DOX、TET、AMP和CHL高度耐药,耐药率分别为99%、89%、88%、78%和68%。而对CIP、LEV和CRO比较敏感,尤其对CRO高度敏感,未检测出耐药菌株(表3)。
耐药性检测结果表明,两株菌株只对一种药物有耐药性;79株菌株能够耐5种以上受试药物,占总受试菌株的71%;检测出107株(96%)为多重耐药菌株(≥3种),最常见的多重耐药谱为FLR/CHL/DOX/TET/AMP(图 1)。

表3 112株E.coli对10种抗生素的药敏试验Table 3 Susceptibility of 112E.coliisolates from pork to 10 antibiotics

2.3 毒力基因的PCR调查结果 PCR结果显示,在分离的112株E.coli分离株中比较流行的毒力基因有Stx2e和EAST1,STb基因仅在一株菌中检测到,而faeG基因未检测到。受试菌株中,有51株未检测到所调查的任何毒力基因,而毒力基因阳性菌株中38%至少拥有两个毒力基因,以EAST1+Stx2e和hlyF+Stx2e较为常见(表4)。
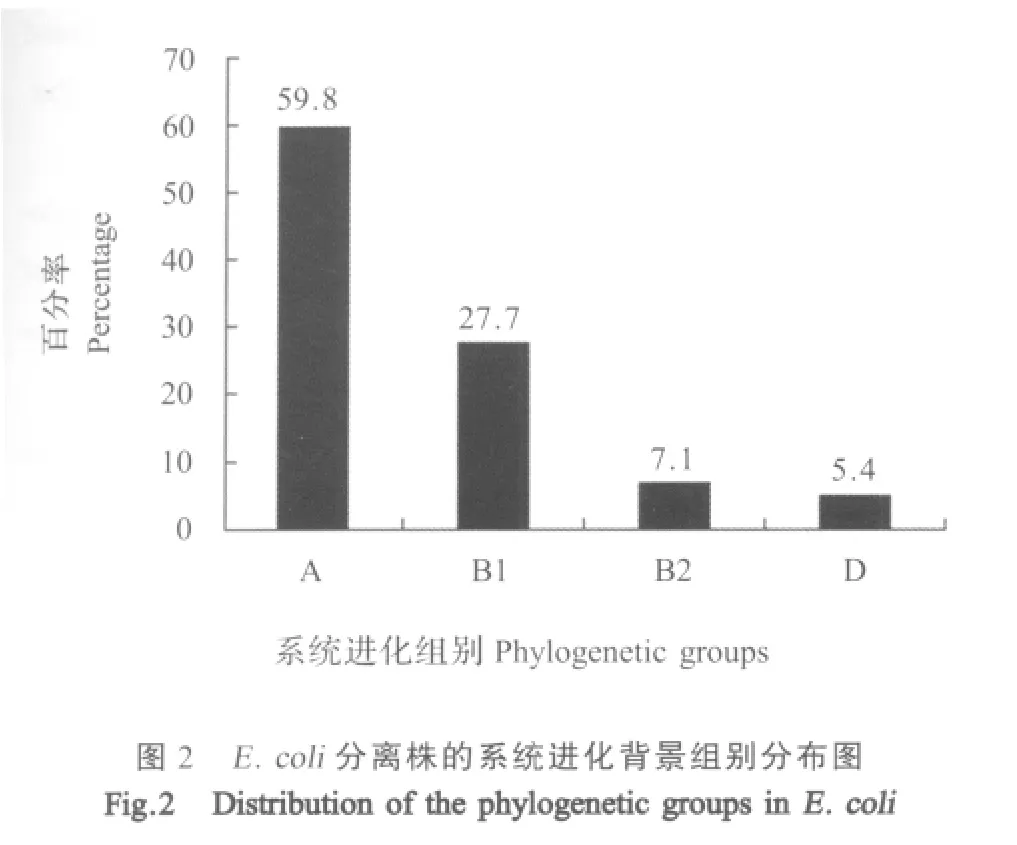
2.4 系统进化背景的判定结果 分离自屠猪肉样品的112株E.coli的系统进化背景调查结果表明,大多数菌株属于A组(67株,59.8%)和B1组(31株,27.7%),两者占菌株总数的87.5%,而在B2组(8株,7.1%)和D组(6株,5.4%)中分布较少(图2)。

表4 E.coli毒力基因的PCR检测结果Table 4 The virulence genes detected by PCR of E.coliisolates from pork
3 讨论
目前,我国已有健康动物体内分离出的E.coli中有致病血清型的报道,引起猪患病的常见E.coli血清型有 O8、O9、O20、O45、O60和 O64等[9]。本研究从猪肉样品中分离出的E.coli血清型,包括经典的禽源致病性血清型O8和O78。
对抗生素的药物敏感性试验结果表明,广东屠猪肉样品中E.coli分离株对常用抗生素的耐药性程度较高,在受试的10种药物中,TET、DOX、CHL、FLR和AMP对大部分E.coli分离株已基本失去抗菌作用,但对CIP、LEV和CRO均较敏感。分离株中普遍存在多重耐药现象,其中有84%的菌株表现为多重耐药(≥3耐),只对一种药物有耐药性的菌株仅有两株。受试菌株对TET类药物的耐药率达90%,此结果与只帅等2009年对陕西地区食源性E.coli耐药性的检测结果相似[10],这可能与TET在中国使用时间早、使用领域广泛有关。DOX和FLR是近几年被批准用于食品动物的药物,目前已经在畜禽疾病预防和治疗中广泛应用。而本研究中的受试菌株对DOX和FLR已显示较高的耐药性,该结果与Bischoff报道相符[11],可能与这些药物在兽医临床的不合理应用有关,也可能与同类药物如TET和CHL引起的交叉耐药有关。
广东地区屠猪肉样品分离株中至少携带一种毒力基因的检出率为54.5%,而携带3种毒力因子的菌株占2.7%(3株),携带两种毒力因子的菌株占19.6%(22株)。检出率最高的Stx2e为致猪水肿病的主要毒力因子,而从屠猪肉样品中分离的受试菌中未检出粘附素faeG毒力因子。因此,本研究Stx2e在健康猪源E.coli中流行较广,但检测率(31%)比王秀梅研究的疾病猪源E.coli的检出率(63%)结果低[12-14],表明屠猪肉样品E.coli携带的毒力基因比疾病源的少。本实验未检测出粘附素毒力因子,屠猪肉样品分离株携带的毒力基因可能由于缺失粘附素因子而未能表达出致病性。其他几种毒力基因检出率比较低,可能是由于从屠猪肉样品分离的E.coli携带的毒力基因较少,也可能与地域有关。
系统进化研究用于调查E.coli的进化起源[15],可作为预测E.coli是否构成健康风险的工具,有助于了解不同种群的E.coli的病原性和毒力特征。本研究通过对112株屠猪肉样品E.coli分离株系统进化背景的调查,得出受试菌株主要分布在偏向共生型的A组和B1组,与Johnson等调查猪源E.coli主要分布的结果相一致[16],虽比率稍有偏差,但总体上仍符合共生型E.coli是人和动物肠道内的正常菌群的结论。
E.coli的质粒上常携带耐药基因,通过共同选择作用,抗菌药物的使用可能会与相关毒力基因和耐药基因存在联系。通过对屠猪肉样E.coli的研究有利于证明是否存在这种潜在的联系,为大肠杆菌病的控制以及合理使用抗生素提供实验依据。
[1]Lucia M L,Sandra H F,Antonio J P,et al.Heterogeneity among strains of diffusely adherent Escherichia coliisolated in Brazil[J].J Clin Microbiol,2005,43(4):1968-1972.
[2]Boerlin P,Travis R,Gyles C L,et al.Antimicrobial resistance and virulence genes of Escherichia coliisolates from swine in Ontario[J].Appl Environ Microbiol,2005,71(11):6753-6761.
[3]Leigh B R,Cheryl L W,Richard J R.Associations between antimicrobial resistance phenotypes,antimicrobial resistance genes,and virulence genes of Fecal Escherichia coliisolates from healthy grow-finish pigs[J].Appl Environ Microbiol,2009,75(5):1373-1380.
[4]陈祥,赵李祥,高崧,等.猪源大肠杆菌(ETEC、STEC、AEEC)毒力基因及其与O抗原型的关系[J].微生物学报,2008,48(7):857-862.
[5]张铁,王春光,王谦,等.猪源大肠杆菌的分离、鉴定及耐药性监测[J].中国农学通报,2005,21(12):23-25.
[6]宋立,宁宜宝,张秀英.猪源大肠杆菌血清型耐药性整合子调查[J].中国兽医杂志,2008,44(5):14-15.
[7]Vu-Khac H,Holoda E,Pilipcinec E,et al.Serotypes,virulence genes,intimin types and PFGE profiles of Escherichia coli isolated from piglets with diarrhoea in Slovakia[J].Vet J,2007,174:176-187.
[8]Clermont O,Bonacorsi S E.Rapid and simple determination of the Escherichia coliphylogenetic group[J].Appl Environ Microb,2000,66:4555-4558.
[9]孙广力,孙刚,李书华,等.黑龙江省规模化养猪场大肠杆菌病血清型流行病学调查[J].黑龙江畜牧兽医,2004,32(7):90-91.
[10]只帅,席美丽,申进玲,等.食源性大肠杆菌耐药性检测[J].西北农业学报,2009,18(6):377-381.
[11]Bischoff K,White D,McDermott P,et al.Characterization of chloramphenicol resistance in beta-hemolytic Escherichia coli associated with diarrhea in neonatal swine[J].J Clin Microbiol,2002,40:389-394.
[12]Lanz R,Kuhnert P,Boerlin P.Antimicrobial resistance and resistance gene determinants in clinical Escherichia colifrom different animal species in Switzerland[J].Vet Microbiol,2003,91(1):73-84.
[13]Christine M,Sadjia B,Francois S,et al.Heterogeneity among virulence and antimicrobial resistance gene profiles of extraintestinal Escherichia coliisolates of animal and human origin[J].J Clin Microbiol,2004,42(12):5444-5452.
[14]Wang Xiu-mei,Jiang Hong-xia,Liao Xiao-ping,et al.Antimicrobial resistance,virulence genes,and phylogenetic background in Escherichia coliisolates fromdiseased pigs[J].Fed Eur Microbiol Soc,2010,306:15-21.
[15]Ishii S,Meyer K P,Sadowsky M J.Relationship between phylogenetic groups,genotypic clusters,and virulence gene profiles of Escherichia colistrains from diverse human and animal sources[J].Appl Environ Microb,2007,73(18):5703-5710.
[16]Johnson J,Kuskowski M,Owens K,et al.Phylogenetic origin and virulence genotype in relation to resistance to fluoroquinolones and/or extended-spectrum cephalosporins and cephamycins among Escherichia coliisolates from animals and humans[J].J Infect Dis,2003,188:759-768.
