大熊猫IgG双抗体夹心ELISA定量检测方法的建立
2011-05-21张焕容王海瑞
张焕容,海 泉,王海瑞,侯 蓉*
(1.西南民族大学生命科学与技术学院,四川 成都 610041;2.成都大熊猫繁育研究基地,四川 成都 610081)
大熊猫是我国特有的濒危保护动物,野外现存数量为1600只左右,圈养个体数量为161只。为了保护和拯救大熊猫,我国政府采取了一系列措施,包括建立自然保护区,以及通过人工繁育增加大熊猫种群数量等。同时,对疫病的预防和早期诊断已成为圈养大熊猫保护工作的重要内容之一。免疫球蛋白G(IgG)是人和动物血液、组织液和淋巴液中含量最高的免疫球蛋白,占免疫球蛋白总量的70%~80%,在机体防御系统中发挥着重要作用。监测大熊猫体内免疫球蛋白含量的变化,对某些疾病的诊断和临床治疗有指导意义。因此,建立一种特异、敏感监测大熊猫血清中免疫球蛋白IgG变化的方法是十分必要的,特别是通过该方法测定大熊猫幼畜血清中IgG的含量,评价幼畜的体液免疫状况,为大熊猫幼畜制定科学合理的哺育程序,提高幼龄大熊猫免疫力和成活率,具有重要的意义。双抗体夹心ELISA(DAS-ELISA)已应用于不同动物免疫球蛋白的定量检测[1-2],不同病毒抗原以及生物活性物质的定量检测[3-6]。本研究的目的在于建立定量检测大熊猫IgG的DAS-ELISA方法,为临床快速、准确地定量检测大熊猫IgG提供可靠的方法。
1 材料和方法
1.1 主要试验材料 大熊猫血清由成都大熊猫繁育研究基地提供;Protein A琼脂糖亲和基质购于北京道格拉斯生物技术有限公司;辣根过氧化物酶(HRP)标记山羊抗豚鼠IgG酶标免疫球蛋白购于美国Biotech公司;BSA购于美国Sigma公司;BCA蛋白定量检测试剂盒购于北京Biomed科技发展有限公司;邻苯二胺(OPD)购于美中Amerso公司;酶标板购自Costar公司;680型酶标仪为美国Bio-Rad公司产品;DU800核酸蛋白检测仪为Beckman公司产品。
1.2 实验动物 体质量为2.5 kg~3 kg的成年健康家兔、体质量为300 g~500 g的豚鼠,均购自四川省实验动物专委会养殖场。实验动物的饲养及处置严格按照四川省实验动物专委会实验动饲养及使用规程操作。
1.3 大熊猫血清IgG的纯化和蛋白含量测定 参照Protein A琼脂糖亲和基质使用说明书,纯化大熊猫血清中IgG,经SDS-PAGE电泳检测其纯度。采用BCA蛋白定量检测试剂盒,绘制标准曲线,确定相关系数和回归方程,计算大熊猫IgG蛋白含量。
1.4 兔抗和豚鼠抗大熊猫IgG高免血清的制备将纯化的大熊猫IgG 1 mg/mL与弗氏完全佐剂等量混合乳化,颈部、胸部皮下分点注射,免疫成年健康家兔,1 mL/只;两周后相同部位接种弗氏不完全佐剂等量乳化的1 mg/mL大熊猫IgG,进行第二次免疫,1 mL/只;于第4周再按第二次免疫剂量重复免疫;10 d后耳缘静脉采血分离血清,采用琼脂扩散试验测定血清的效价,当琼扩效价达1∶64时,心脏采血分离兔血清。同时,按照相同免疫程序免疫豚鼠,剂量减半,制备豚鼠抗大熊猫IgG高免血清。
1.5 兔抗大熊猫IgG高免血清中IgG的纯化和含量检测 方法按照1.3中的方法。
1.6 大熊猫IgG DAS-ELISA定量检测方法的建立
1.6.1 DAS-ELISA的基本程序 4℃过夜包被纯化的兔抗大熊猫IgG做为捕获抗体,次日封闭后加待检大熊猫血清,孵育后加豚鼠抗大熊猫IgG高免血清做为检测抗体,37℃孵育,加山羊抗豚鼠IgG辣根过氧化物酶标抗体,显色,测定OD490nm值。
1.6.2 正交试验测定影响DAS-ELISA的因素 根据影响DAS-ELISA的主要因素(捕获抗体浓度、封闭液、检测抗体最佳工作浓度、酶标抗体工作浓度、洗涤液中Tween-20使用量),设计4个水平的正交试验。根据正交试验结果,确定DAS-ELISA中各因素的最佳使用浓度或稀释倍数,并根据优化反应程序确定Cut-off阈值。
1.6.3 定量DAS-ELISA标准曲线的建立 将纯化的大熊猫IgG经BCA法定量后,调整浓度至100 μg/mL,做为标准品。根据上述正交试验确定最佳捕获抗体浓度和封闭液,包被和封闭酶标板。将IgG 标准品两倍系列稀释(100 μg/mL~1.5625 μg/mL),加入各反应孔,37℃孵育1 h。根据既定的DASELISA反应程序加入最佳工作浓度的豚鼠抗大熊猫IgG高免血清和辣根过氧化物酶标记山羊抗豚鼠IgG酶标抗体。反应完毕后测定OD490nm值。以OD490nm值为横坐标,以浓度的自然对数Lg(x)为纵坐标,绘制标准曲线,确定相关系数和回归方程。
1.6.4 特异性检测 用已优化好的反应条件,检测纯化的大熊猫IgM、IgA抗体和兔血清、豚鼠血清、鸭血清、鸡血清、小鼠血清,同时取纯化的大熊猫IgG做为阳性对照,不加抗原作为阴性对照。各样品均做100倍稀释,平行3次。比较OD490nm平均值与Cut-off阈值大小,确定其特异性。
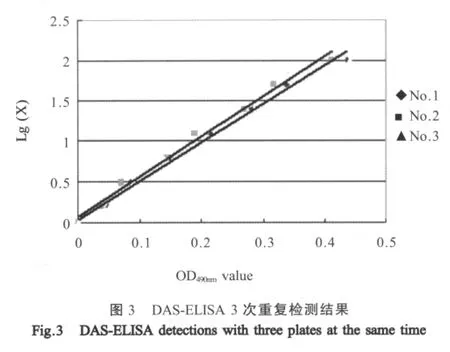
1.6.5 稳定性检测 分别用3块已包被好的酶标板重复检测不同稀释度的大熊猫IgG,结果比较。
2 结果
2.1 纯化IgG的SDS-PAGE检测及其含量 经protein A琼脂糖亲和基质纯化,获得了重链分子量和轻链分子量分别约为50 ku和25 ku的高度纯化的大熊猫IgG和兔抗大熊猫IgG。BCA法制作标准曲线分析显示相关系数R2=0.9924,回归方程为y=660.39x,根据回归方程测得纯化的大熊猫IgG为0.46 mg/mL。
2.2 DAS-ELISA反应条件优化结果及Cut-off阈值的确定 根据正交试验结果,兔抗大熊猫IgG捕获抗体浓度、豚鼠抗大熊猫IgG高免血清作为检测抗体的稀释倍数以及山羊抗豚鼠辣根过氧化物酶标抗体浓度为影响试验结果的最显著因素,优化各因素得:当捕获抗体浓度为5 μg/mL,豚鼠抗大熊猫IgG高免血清稀释倍数为1∶1200,酶标抗体使用浓度为1∶6000时,可有效减少非特异性反应,降低背景值。利用已优化好的反应条件对10个阴性孔OD490nm,求其平均值()为0.107,标准差(SD)为 0.062,得Cut-off(±2SD)值为 0.16。当 OD490nm大于 0.16为阳性,小于0.16为阴性。
2.3 定量DAS-ELISA标准曲线 从图1可知,随着大熊猫IgG标准品浓度的增加,DAS-ELISA检测的OD值也随之增加,呈一定的线性关系。由图2得出大熊猫IgG的浓度(Y)和其DAS-ELISA检测的OD值(X)之间的回归方程为Y=4.718X+0.0444,相关系数(R2)为0.9911。
2.4 DAS-ELISA特异性检测结果 特异性检测结果显示,各待检样品中只有大熊猫血清检测结果为阳性,其它均为阴性(表2),说明该方法具有良好的特异性。
2.5 DAS-ELISA稳定性检查结果 从图3可见,3块不同的酶标板(No.1、No.2、No.3)对系列稀释的大熊猫IgG的检测重复性良好,且呈线性分布,表明该方法稳定性好。
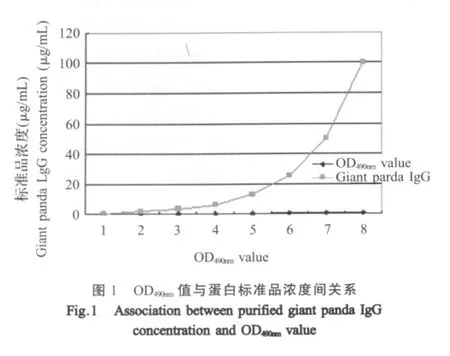
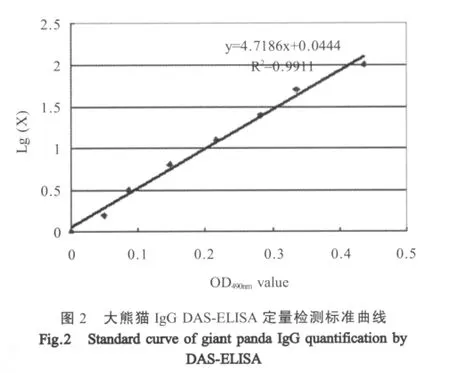

表2 DAS-ELISA检测不同动物血清Table 2 OD values of various animal origin sera detected by DAS-ELISA
3 讨论
本研究建立DAS-ELISA用于定量检测大熊猫血清中IgG的含量,为优化该方法,我们分析了DAS-ELISA中各因素,包括捕获抗体浓度、检测抗体和酶标抗体的最佳工作浓度以及封闭缓冲液和洗涤缓冲液等,各步骤的反应温度和反应时间,以最大程度地降低背景值和减少非特异性反应,同时保证该方法中免疫反应和酶反应的正常进行。为减少各步骤之间的交叉反应和弱结合反应,DAS-ELISA各步骤孵育后,参考其他文献[1-2],每步均进行5次洗涤,可以最大限度地减少各步骤之间的交叉反应和弱结合反应,提高检测的特异性。在DAS-ELISA中,纯化的兔抗大熊猫IgG作为捕获抗体,一定稀释度的豚鼠抗大熊猫高免血清作为检测抗体,两种抗体分别和待检大熊猫血清中的IgG不同抗原决定簇结合,大大提高了该方法的检测灵敏度和特异性,虽然没有把本研究建立的DAS-ELISA同其他ELISA方法进行比较,但DAS-ELISA方法的特异性更好,灵敏度更高[7-9]。
纯化的大熊猫IgG作为标准品,系列稀释后经DAS-ELISA检测所得OD490nm值,并建立OD490nm值和大熊猫IgG含量之间的相关曲线,结果表明,两者之间呈良好的线性关系,相关系数0.9911,且线性范围广。本研究建立的检测大熊猫血清中IgG的DAS-ELISA法特异性好,与大熊猫IgA、IgM以及兔血清、豚鼠血清、鸡血清和鸭血清等为阴性反应,且稳定性好。
本研究建立的大熊猫IgG DAS-ELISA定量检测方法是研究大熊猫免疫球蛋IgG的第一步,接下来我们会用该方法检测不同年龄、不同健康状况的大熊猫血清中IgG的存在情况,特别是研究大熊猫血清中IgG含量的变化和大熊猫健康状况之间关系。
[1]Bianchi A T,Moonen-Leusen H W,Van Der Heijden P J,et al.The use of a double antibody sandwich ELISA and monoclonal antibodies for the assessment of porcine IgM,IgG and IgA concentrations[J].Vet Immunol Immunopathol,1995,44(3-4):309-317.
[2]Klein-Schneegans A S,Gavériaux C,Fonteneau P,et al.Indirect double sandwich ELISA for the specific and quantitative measurement of mouse IgM,IgA and IgG subclasses[J].J Immunol Methods,1989,119(1):117-125.
[3]Chand K,Biswas S K,De A,et al.A polyclonal antibody-based sandwich ELISA for the detection of bluetongue virus in cell culture and blood of sheep infected experimentally[J].J Virol Methods,2009.160(1-2):189-192.
[4]Luo Q,Huang H,Zou W,et al.An indirect sandwich ELISA for the detection of avian influenza H5 subtype viruses using anti-hemagglutinin protein monoclonal antibody[J].Vet Microbiol,2009,137(1-2):24-30.
[5]Luo Q,Huang H,Zou W,et al.An indirect sandwich ELISA for the detection of avian influenza H5 subtype viruses using anti-hemagglutinin protein monoclonal antibody[J].Vet Microbiol,2009,137(1-2):24-30.
[6]Xu Z W,Zhang T,Song C J,et al.Application of sandwich ELISA for detecting tag fusion proteins in high throughput[J].Appl Microbiol Biotechnol.2008,81(1):183-189.
[7]刘翼珑,乔惠理,邓泽沛.测定牛IgG的化学发光自显影法的建立[J].中国免疫学杂志,1998,258(1):187.
[8]熊勇华,许杨,魏华,等.HPIC法检测牛初乳中IgG含量[J].食品工业科学,2003,(9):80-82.
[9]李忠秋,刘春龙,李勐,等.免疫胶体金半定量检测牛初乳IgG含量方法的建立及初步应[J].中国奶牛,2006,(1):12-14.
