进展期胃癌患者O6-甲基鸟嘌呤-DNA-甲基转移酶蛋白表达与预后的关系
2011-04-09贾存慧禹立霞魏嘉邹征云钱晓萍刘宝瑞
贾存慧,禹立霞,魏嘉,邹征云,钱晓萍,刘宝瑞
0 引言
胃癌是我国高发的消化道肿瘤之一,病死率在恶性肿瘤中居第2位,进展期胃癌患者手术切除后的5年生存率仅为20%左右。以全身化疗为主的综合治疗是目前进展期胃癌的重要治疗方法,常见化疗药物主要是铂类、紫杉类、氟脲嘧啶类、喜树碱类、蒽环类等类药物,联合化疗有效率多在50%以下。如何提高化疗药物疗效、尽可能避免无效化疗及提高总生存期是我们目前亟待探讨和解决的问题。MGMT能够特异性地修复烷化剂对DNA造成的损伤,同时也是逆转烷化剂如替莫唑胺、司莫司汀等抗肿瘤作用的关键酶。随着药物遗传学/药物基因组学在化疗药物作用机制等方面的研究获得了突破性进展,研究者发现化疗药物对肿瘤细胞的杀伤效应与特定的一种(一组)基因或蛋白的表达显著相关。通过相应的检测结果,预测该化疗药物的疗效,选择合适的药物进行化疗,已经成为提高疗效、减少无效治疗的合理选择[1]。关于MGMT与肿瘤的关系虽有文献报道,但是MGMT在进展期胃癌患者中表达的相关性研究,特别是采用较为精确的免疫组化量化评价标准在国内报道不多。我们采用免疫组化SP法探讨MGMT在进展期胃癌患者肿瘤组织中的表达,分析其表达情况与胃癌临床病理参数及预后的关系,也为可能的个体化药物治疗提供相关的实验依据。
1 材料与方法
1.1 研究对象收集158例2004至2008年间行胃癌根治术,经病理确诊并具有随访结果的手术切除患者的临床资料。患者中男126例,女32例,年龄33~92岁,中位年龄64.5岁。所有患者术前均未接受任何放疗和化疗。
1.2 切片制备将晚期患者的胃癌组织标本经10%的甲醛固定,常规石蜡包埋,行连续切片,厚度为4 μm,载玻片经多聚赖氨酸处理,防止脱片。其中一张用于HE染色和病理诊断,其余切片于60℃烤片2 h并储存,待随后进行免疫组化染色。
1.3 实验试剂及免疫组化方法
1.3.1 实验试剂小鼠抗人MGMT单克隆抗体(ZM-0461),工作浓度为1∶100,二抗试剂盒PV-6000-G(二步法免疫组化检测试剂),DAB显色剂均购自北京中杉金桥公司。0.01 mmol/L PBS代替一抗作为阴性对照,以公司提供的阳性切片作为阳性对照。
1.3.2 免疫组化方法主要步骤包括梯度乙醇脱蜡,5%H2O2室温放置15 min以灭活内源性酶,柠檬酸缓冲液(pH6.0)中微波抗原修复12 min
后,置室温冷却30 min,一抗4℃冰箱孵育过夜,然后按SP试剂盒说明书步骤进行操作,DAB显色,苏木精复染,自来水充分冲洗,梯度乙醇二甲苯脱水透明,中性树胶封固。
1.4 免疫组化结果判定方法MGMT的阳性表达主要在细胞核中,部分表达存在于细胞质或两者均有表达。采用盲法观察切片,根据阳性染色强度和阳性细胞数比率综合计分[2-3]:阳性染色强度无染色为0分,弱阳性为1分,中度阳性为2分,强阳性为3分,并分别记录上述各个染色强度的阳性细胞百分率。将染色强度分值与相应染色强度的阳性细胞百分率相乘得到最终的评分结果,分值范围在0~300之间。评分公式为:
分值=0×a%+1×b%+2×c%+3×d%其中a、b、c、d分别为0分、1分、2分、3分细胞所占的百分数。此种判定方法能够定量判定免疫组化的结果,更大程度避免主观因素造成的误差。结果判定在不了解患者临床资料的情况下进行。
1.5 统计学分析组间等级资料比较采用秩和检验,生存分析采用Kaplan-Meier法及COX回归模型,双变量等级资料的关联性分析采用Spearman等级相关性分析,数据分析用SAS 9.1.3统计软件包,以P≤0.05为有显著性统计学意义。
2 结果
2.1 胃癌中MGMT蛋白表达与临床病理参数的关系158例胃癌组织中,121例MGMT蛋白为阳性染色,阳性率为76.58%,阳性颗粒主要位于肿瘤细胞的细胞核中,少数位于肿瘤细胞的细胞质中,间质中部分淋巴细胞为阳性表达,且MGMT低表达组和MGMT高表达组的阳性表达有明显不同,见图1。MGMT蛋白阳性表达与患者的肿瘤部位、肿瘤大小、肿瘤分期、分化程度、神经是否侵犯、脉管是否存在癌栓均无相关性(P>0.05),见表1。
2.2 MGMT蛋白表达与胃癌预后的关系158例患者中,我们根据上述免疫组化判定标准对MGMT表达情况进行评分,根据评分的结果,将阳性表达的病例按评分结果划分为低表达(分值≤30,n=61)和高表达(分值>30,n=60),30分为所有分值的中位值。MGMT低表达患者的中位总生存期为14.2个月,而高表达患者的中位总生存期为13.4个月,差异无统计学意义(P>0.05)。生存曲线图见图2。
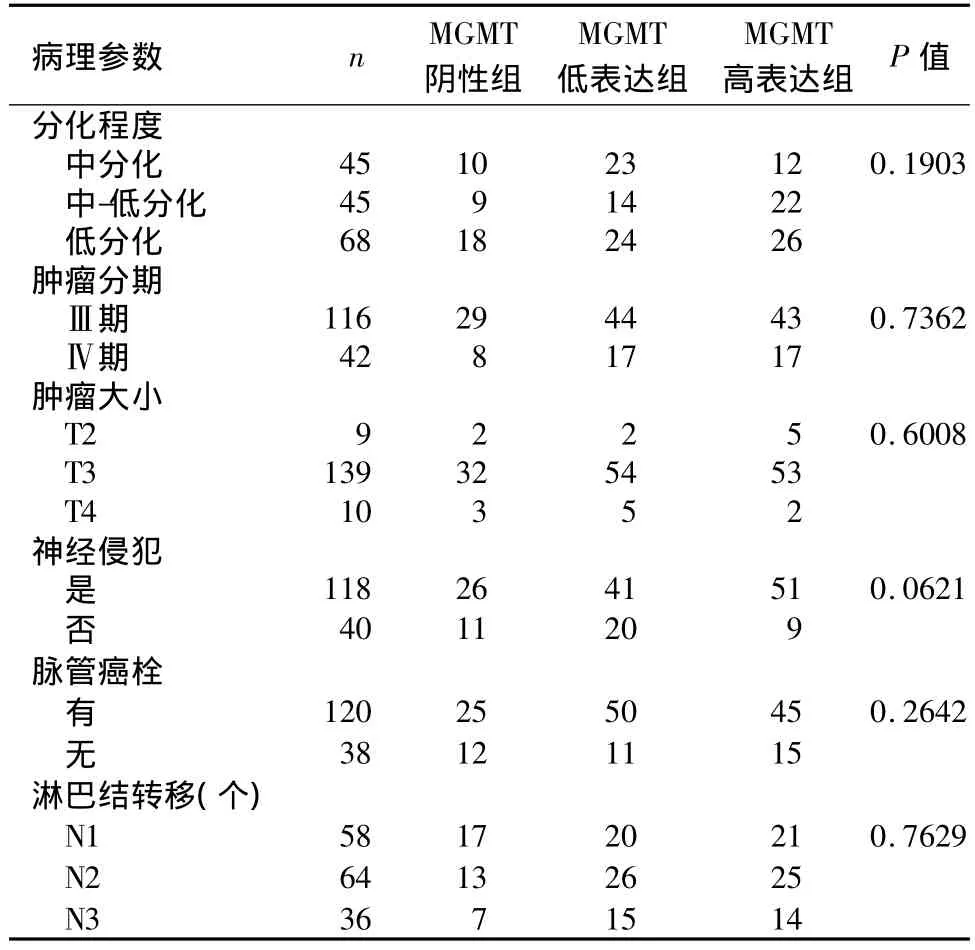
表1 胃癌组织中MGMT蛋白表达与临床病理参数的关系Table 1 The relationship between MGMT protein expression and the clinicopathological features of advanced gastric carcinoma
由图2可知,以MGMT表达分值的中位值30划分得到的低表达和高表达的总生存期曲线差异无统计学意义,P>0.05。MGMT阳性表达组生存期与MGMT阴性表达组比较,差异无统计学意义,P>0.05。
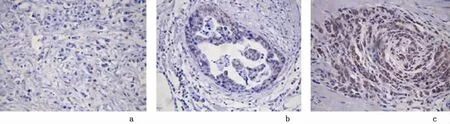
图1 MGMT蛋白在进展期胃癌组织中的表达情况Figure 1 The expression of MGMT protein in advanced gastric carcinoma tissues
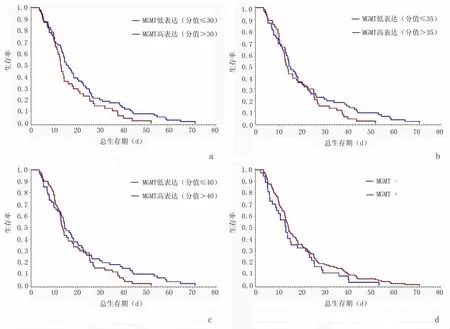
图2 MGMT蛋白表达情况与进展期胃癌患者生存期的关系Figure 2 The relationship between MGMT protein expression and OS of advanced gastric carcinoma patients
2.3 联合分析MGMT蛋白表达和p53蛋白表达与进展期胃癌患者预后的关系结合病例标本的临床病理检测结果,我们联合分析了MGMT蛋白和p53蛋白的表达情况与胃癌患者总生存期之间的关系,发现MGMT(+)、p53(-)组的总生存期要明显长于MGMT(+)、p53(+)组,P<0.05,见图3。
接着,我们进一步分析了根据MGMT阳性表达情况所划分的低表达组和高表达组的胃癌患者的总生存期,见图4。当p53(-)、MGMT低表达组的总生存期与MGMT高表达组的总生存期差异无统计学意义(P>0.05);当p53(+)、MGMT低表达组的总生存期要显著高于MGMT高表达组(P<0.05)。
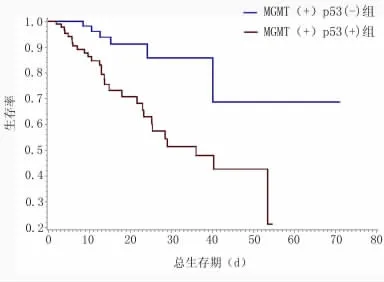
图3 联合分析MGMT和p53的表达与进展期期胃癌患者生存期的关系Figure 3 Combined evaluation the relationship between the expression of MGMT and p53 and OS of advanced gastric carcinoma patients
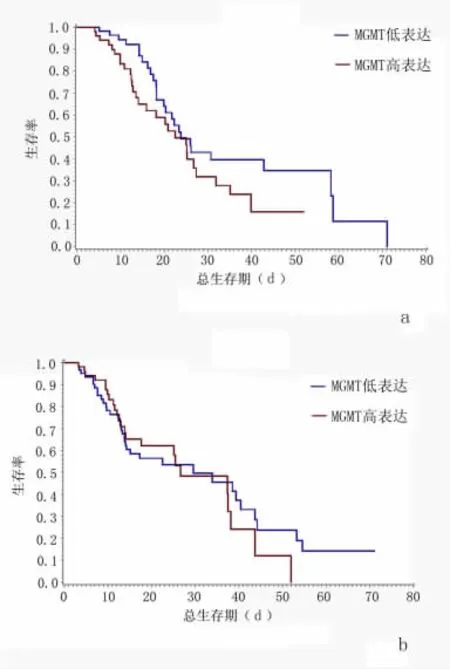
图4 联合分析MGMT低表达组、高表达组和p53的表达与晚期胃癌患者生存期的关系Figure 4 Combined evaluation the relationship amongMGMT low expression group,high expression group and p53 and OS of advanced gastric carcinoma patients a:p53(+);b:p53(-)
2.4 MGMT蛋白表达与p53蛋白表达之间的关系Spearman相关系数分析显示MGMT蛋白和p53蛋白的蛋白表达水平呈负相关:r=-0.2534,P=0.0023,见表2。

表2 MGMT和p53蛋白表达相关性分析Table 2 The relationship between the expression of MGMT ptotein and p53 protein
2.5 多变量分析各参数与患者预后的关系多变量COX比例风险模型分析,MGMT(P=0.1363)和p53(P=0.4082)不能作为生存时间的独立预测指标(MGMT的相对危险度:1.339;p53的相对危险度:1.174)。见表3。
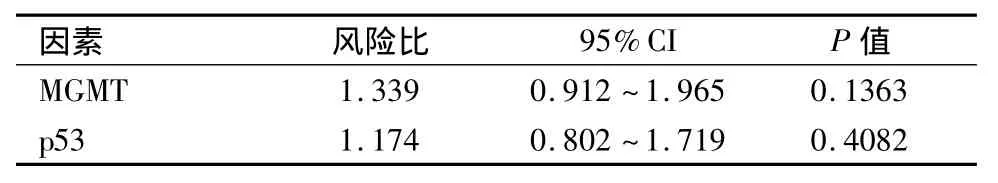
表3 COX回归多因素分析与患者总生存期关系Table 3 The relationship between Cox regression analysis and OS of advanced gastric carcinoma patients
3 讨论
MGMT蛋白是由MGMT基因编码的207个氨基酸组成的含磷蛋白,能够特异性地修复鸟嘌呤第6位氧原子烷基化对DNA造成的损伤,在维持正常细胞的生理功能和基因组的稳定性中发挥重要作用[3]。MGMT在人体的正常组织和多种肿瘤组织中均有表达(称Mer+表型),并且部分肿瘤组织中的MGMT蛋白活性低于其在相应的正常组织中的活性。有20%的肿瘤细胞株检测不到MGMT的表达(称Mer-表型)[4]。MGMT蛋白的活性减少或缺失、MGMT mRNA的表达缺失及其酶活性的缺失与MGMT基因的异常表达密切相关,特别是MGMT基因的启动子区的超甲基化状态[5]。据文献报道,MGMT基因启动子区的甲基化异常在结肠癌、脑胶质瘤、黑色素瘤和胃癌等肿瘤组织中均有发生[6-9]。Bartchewsky等[3]对64例胃癌患者的MGMT基因和蛋白表达情况进行检测,胃癌患者的MGMT蛋白活性显著降低,根据免疫组化定量判断评分标准发现MGMT在胃癌组织中的表达平均分值为14.52,远低于临近的正常胃黏膜组织中的60.33,提示胃癌中MGMT蛋白的表达减少可能与MGMT基因的异常表达有关。近年来,研究发现脑胶质瘤患者的MGMT基因的启动子区如果出现高甲基化,那么对于替莫唑胺的敏感性会显著提高,可能从化疗中更多的获益,并且患者的总生存期也有所延长[10]。提示MGMT的甲基化状态或者MGMT蛋白的表达可能作为脑胶质瘤患者预后的预测因子和替莫唑胺的敏感性指标。目前对于该蛋白的表达与胃癌化疗敏感性及预后的相关关系研究较少。
p53基因是一种重要的抑癌基因,其蛋白产物p53蛋白的抑制活性由多种因素调节,如p53凋亡刺激蛋白(apoptosis stimulating protein of p53,ASPP)家族等,并且在细胞信号传导通路中处于关键环节[11-12]。当其发生突变或缺失时,抑癌效应削弱,进而导致肿瘤的发生。同时,p53蛋白的半衰期明显延长,可用免疫组化方法在多种肿瘤组织中检测到突变型p53蛋白。而p53蛋白的突变多发生于CpG序列,特别是G:C→A:T的转变[13]。Wu等[14]研究证实,MGMT蛋白的活性表达能够阻止p53基因G:C→A:T的突变,对p53基因进行保护。而当启动子处于高甲基化时,突变型p53蛋白增加,可以通过免疫组化进行检测。本研究表明MGMT蛋白与p53蛋白的表达呈负相关(r=-0.2534,P=0.0023),提示MGMT的活性表达对p53基因具有保护作用,当MGMT蛋白表达为阴性或低表达时可能会增加p53基因的突变频率,进而导致p53蛋白的表达增强。Wiewrodt等[15]对复发性脑胶质瘤患者在放化疗后的MGMT表达和p53状态以及预后的关系进行了研究,发现MGMT低表达和p53阳性表达具有一定的相关性趋势,且MGMT蛋白表达量<30 fmol/mg时,能够更好地从烷化剂的治疗以及放疗中获益。
基于以上研究的提示,我们收集了158例进展期胃癌患者临床手术标本,采用免疫组化的方法检测肿瘤组织中MGMT蛋白的表达情况,并联合p53蛋白的临床检测结果进行综合统计学分析,MGMT蛋白的阳性率为76.58%(121/158),与文献报道相近[16]。中分化型和中-低分化型胃癌组织中MGMT的阳性表达率高于低分化型胃癌组织中MGMT的阳性表达率。
同时,根据随访资料对实验结果进行生存分析,阳性表达的病例被划分为低表达(分值≤30,n=61)和高表达(分值>30,n=60)。对免疫组化结果所采取的判断标准相较于以往的评判标准而言,能够更为定量的分析MGMT蛋白的表达情况,更大程度地避免一些人为因素的影响,增加了结果的可信度。MGMT低表达患者的中位总生存期为14.2个月,而高表达患者的中位总生存期为13.4个月,差异无统计学意义(P>0.05),但由于检测的病例均为进展期胃癌,患者的身体机能状况可能是其生存期长短的重要影响因素,在一定程度上影响了实验的结果。根据COX回归模型分析结果,MGMT和p53均不能作为生存期的独立预测因素(P>0.05)。因此,我们联合分析了MGMT蛋白表达和p53蛋白表达与患者总生存期之间的关系,发现MGMT(+)、p53(-)组的总生存期要明显长于MGMT(+)、p53(+)组(P<0.05)。以上实验结果也提示我们单独以MGMT的表达情况作为胃癌患者的预后指标的敏感性远较脑胶质瘤低。
近年来,诸多文献报道脑胶质瘤中MGMT的表达情况对于患者个体化用药的具有一定指导作用,特别是替莫唑胺[16-17]。提示应对胃癌患者MGMT的表达在指导个体化用药上是否也存在参考意义进行研究,结果有23.42%的胃癌患者肿瘤组织中不表达MGMT蛋白,38.61%的胃癌患者MGMT低表达。是否这些胃癌患者可以从替莫唑胺的治疗中获益是今后需要深入探讨和回答的问题。在我们的临床实践中,有1例贲门中分化腺癌术后复发转移的患者,已行多方案化疗及放疗后再度出现肿瘤复发,提示肿瘤继发性耐药,预计治疗效果不佳。而胃癌的全身化疗无标准三线方案,结合患者入院前免疫组化MGMT检测结果为阴性,考虑尝试使用了替莫唑胺抗肿瘤治疗。结果患者于1个化疗周期后即达到部分缓解,提示胃癌治疗中根据MGMT蛋白的表达情况选择是否选用替莫唑胺,对患者的病情控制可能会发挥一定作用。通过本实验发现,联合检测p53蛋白和MGMT蛋白在胃癌患者肿瘤组织中的表达情况,可能更有助于判断患者的化疗疗效和预后,指导临床治疗中根据患者MGMT的表达情况选择化疗药物,对于MGMT表达评分较低,p53为高表达的患者可以考虑选择含有烷化剂的化疗方案,根据不同的患者情况制订个体化的治疗方案,可使患者从化疗中得到更多的获益。
[1]刘宝瑞.努力探讨肿瘤的个体化药物治疗[J].医学研究生学报,2007,20(11):1121-1125.
[2]RaphaëM,John RM,Raymend L,et al.Human Equilibrative NucleosideTransporter 1and Human Concentrative Nucleoside-Transporter 3 Predict Survival afterAdjuvant GemcitabineTherapyi n Resected Pancreatic Adenocarcinoma[J].Clin Cancer Res,2009,15(8):1158-1078.
[3]Bartchewsky WJr,Martini MR,Squassoni AC,et al.Influence of Helicobacter pylori infection on the expression of MLH1 and MGMT in patients with chronic gastritis and gastric cancer[J].Eur J Clin Microbiol Infect Dis,2009,28(6):591-597.
[4]Stanton LG.MGMT:Its role in cancer aetiology and cancer therapeutics[J].Nature Review Cancer,2004,4(4):296-307.
[5]Chen JM,Zhang YP,Wang C,et al.O6-Methylguanine-DNA methyltransferase activity in human tumors[J].Cardnogenesis,1992,13(9):1503-1507.
[6]Anthony EP.Repair of O6-alkylguanine by alkyltransferases[J].Mutation Res,2000,462(2-3):83-100.
[7]Shuji O,Aditi H,Gregory JT,et al.MGMT germline polymorphism is associated with somatic MGMT promoter methylation and gene silencing in colorectal cancer[J].Carcinogenesis,2007,128(9):1985-1990.
[8]Parkinson JF,Wheeler HR,Clarkson A,et al.Variation of O6-methylguanine-DNA methyltransferase(MGMT)promoter methylation in serial samples in glioblastoma[J].J Neurooncol,2008,87(1):71-78.
[9]Verena V,Annie-Claire D,Alexandre M,et al.Infrequent promoter methylation of the MGMT gene in liver metastases from uveal melanoma[J].Int J Cancer,2008,123:1215-1218.
[10]Carolina B,Macarena V,Francisco O,et al.DNA methylation profile in diffuse type gastric cancer:evidence for hypermethylation of the BRCA1 promoter region in early-onset gastric carcinogenesis[J].Biol Res,2008,41(3):303-315.
[11]蔡云,高兴,辛海明,等.人完整p53凋亡刺激蛋白家族抑制成员多克隆抗体的制备及鉴定[J].医学研究生学报,2009,22(3):240-243.
[12]沈勤,陈德滇,高倩,等.P14ARF和E2F1在结直肠肿瘤中的表达及意义[J].医学研究生学报,2009,22(1):16-23.
[13]Donson AM,Addo-Yobo SO,Handler MH,et al.MGMT promoter methylation correlates with survival benefit and sensitivity to temozolomide in pediatric gioblastoma[J].Pediatr Blood Cancer,2007,48(4):403-407.
[14]Wu JY,Wang J,Lai JC,et al.Association of O6-Methylguanine-DNA methyltransferase(MGMT)promoter methylation with p53 mutation occurrence in non-small cell lung cancer with different histology,gender,and smoking status[J].Annals Surgical Oncol,2008,15(11):3272-3277.
[15]Wiewrodt D,Nagel G,Dreimüller N,et al.MGMT in primary and recurrent human glioblastomas after radiation and chemotherapy and comparison with p53 status and clinical outcome[J].Int J Cancer,2008,122(6):1391-1399.
[16]张晖,梁寒,战忠利,等.MGMT与hMLH1在胃癌组织中的表达及其临床相关性研究[J].中华肿瘤防治杂志,2007,14(8):819-821.
[17]Jennifer AQ,Sara XJ,David AR,et al.PhaseⅡtrial of temozolomide(TMZ)plus irinotecan(CPT-11)in adults newly diagnosed glioblastoma multiforme before radiotherapy[J].J Neurooncol,2009,95(3):393-400.
