腹腔间隙综合征小肠黏膜显微和超微结构改变的观察
2011-04-09赵允召龚冠文李宁黎介寿
赵允召,龚冠文,李宁,黎介寿
0 引言
IAH多见于坏死性胰腺炎、腹腔内或腹膜后出血、大量液体复苏所致的肠道广泛水肿、肠梗阻以及腹腔脓肿等腹腔严重病变的外科患者[1],发生率很高,占外科患者的41%[2]。如继续发展,会出现ACS,导致威胁生命的急性肾功能衰竭、呼吸衰竭和心力衰竭等的严重后果[3]。
ACS对心脏、呼吸以及肾功能的影响已见较多临床和实验研究报道[4]。动物研究显示:IAH能造成肠道黏膜缺血,进而导致肠道细菌易位。这可能是临床ACS患者出现脓毒症和多器官功能障碍的主要原因[5]。但ACS对肠道屏障功能影响的机制尚未阐述。本研究观察20mmHgIAH状态下,小肠绒毛光镜改变和TJ超微结构变化对肠道屏障功能的影响。
1 材料与方法
1.1 动物雄性清洁级SD大鼠40只,体重(250±25)g。动物生产许可证:SCXK(苏)2003-0004,由南京军区医学动物实验中心提供。12 h昼夜循环饲养,标准饲料,自由进食、饮水。试验前不禁食、水。
1.2 实验方法
1.2.1 IAH模型的制备实验动物称重。50 mg/kg氯胺酮和0.5 mg/kg甲苯噻嗪腹腔内注射麻醉。术中依据需要静脉追加12.5mg/kg氯胺酮和0.5mg/kg甲苯噻嗪。暴露气管,插入14G套管针。接鼠用呼吸机,机械通气,呼吸频率60次/min,潮气量1.5mg/100g。
整个实验过程持续监测肛温,电热毯保温在36~38℃。剔除腹毛,下腹正中戳孔,插入14 g带侧孔塑料管充氮气。荷包缝扎腹壁戳孔。导管连接氮气枕和压力表以监测腹腔内压力(intra-abdominal pressure,IAP)。通过控制氮气输入量维持腹腔内压力在20 mmHg。
1.2.2 实验过程依据IAH时间不同将实验动物随机分为A、B、C、D组(n=10)。A组,假实验组(无IAH)。B、C、D组腹腔内压升至20 mmHg,分别维持1、2、4 h。IAH组大鼠IAP首先升至10 mmHg,适应5 min后再进一步升至20 mmHg。所有实验组无静脉输液,以排除其他因素所致IAH。每组实验末期,正中剖腹5 cm。距回盲部约5 cm切取末段回肠5cm,等渗盐水清洗,仔细清除粪便。留作光镜和透射电镜检查。
1.2.3 组织学检查4%甲醛固定,石蜡包埋小肠标本。组织切片(4 μm),HE染色,双盲观察。每一段组织,观察3张切片。每一切片观察4个完整绒毛和小凹。光镜下目镜测微计测量绒毛长度,测量每一绒毛上皮覆盖部分绒毛高度。并依据公式:绒毛表面积=2π×1/2[(4/π)d]h计算绒毛表面积。d为绒毛中部直径(宽度),h为绒毛高度。通过扣除绒毛基底面积并依据每一绒毛的切面位置的不同乘以系数来校正公式[7]。通过绒毛总面积和绒毛上皮覆盖面积之比得出绒毛表皮细胞脱落面积百分比。绒毛表皮脱落的百分率为上皮受损的指数。
1.2.4 透射电镜收取磷酸缓冲液浸泡的动物末段回肠。2.5%戊二醛浸泡固定2 h,再用1%OSO4固定。Epon 812包埋。超薄切片,乙酸双氧铀-枸橼酸铅染色。透射电镜(Hitachi子JEM-1200 EX,Japan)80kV放大20000~30000倍观察。每一标本分别由3位医师观察3个TJ。
1.3 统计学分析用SPSS13.0软件进行数据的统计学处理。定量数据以均数±标准差(x±s)表达。各组均数间比较采用方差分析(ANOVA),组间两两比较视方差整齐与否分别选择LSD检验或Tamhane′s T2检验。方差不齐时用U检验(P≤0.05为方差不齐),方差齐时用配对的t检验。P≤0.05为具有显著性统计学意义。
2 结果
2.1 组织学对照组显示正常柱状上皮(图1a)。实验组在IAH后表现从上皮水肿到不同程度退变的结构改变,以及绒毛剥脱和萎陷。损害程度与IAH维持的时间相关。B组标本显示柱状上皮不规则变形,胞浆基底空泡形成(图1b)。C组表皮细胞上浮并在绒毛顶端脱落,上皮脱落面积达12.3%(表1,图1c)。D组组织学分析显示绒毛广泛脱落、萎陷,绒毛上部的肠上皮细胞上浮,与绒毛分离(图1d),24%表层上皮细胞脱落(表1)。绒毛表面积损伤的百分率与IAH时间密切相关。
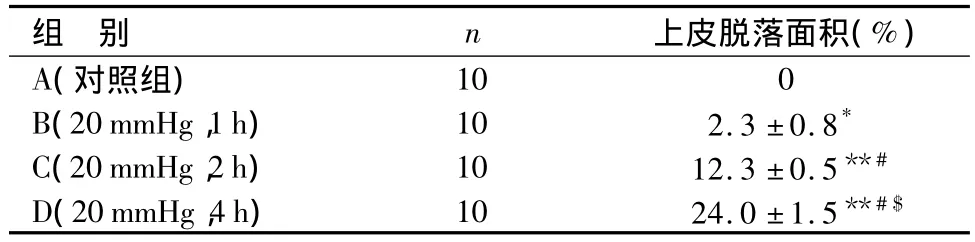
表1 ACS绒毛脱落面积(上皮损伤指数)Table 1 Denuded villous surface area(as an index of epithelial damage)in ACS
2.2 透射电镜TJ和其他超微结构的形态学变化见图2。A组(图2a)TJ完整,其他超微结构正常。黏膜屏障功能正常。B组,在IAH维持1 h情况下,TJ轻度疏松(图2b)。C组,IAH维持2 h,TJ肿胀(图2c)。D组,IAH维持4 h,TJ和细胞周围明显膨胀。黏着的上皮细胞明显松散,部分视野可见微绒毛变钝(图2d)。提示IAH状态下,TJ完全疏松,上皮通透性显著增加。
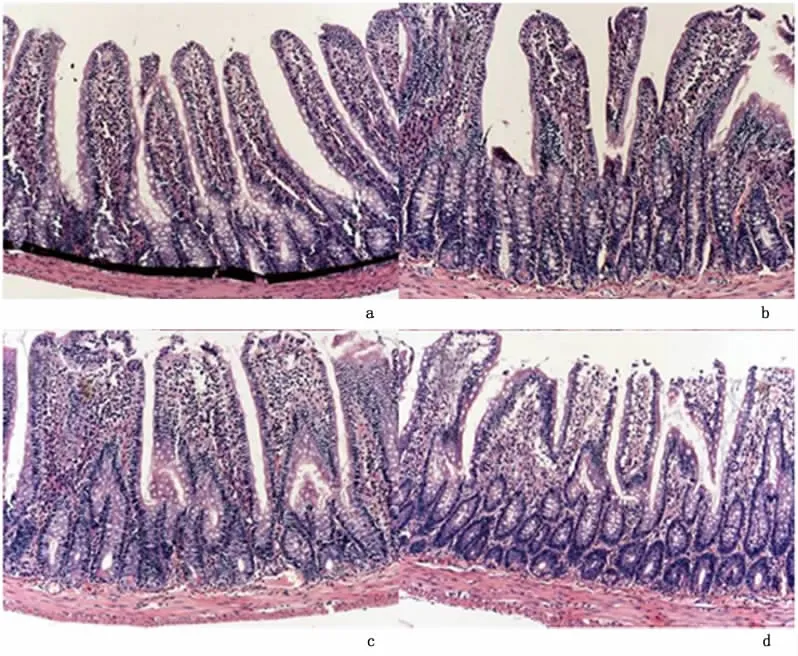
图1 IAH损伤大鼠回肠黏膜的组织学表现(HE×400)Figure 1 Histologic appearancc of the IAH-injured rat ileal mucosa(HE×400)
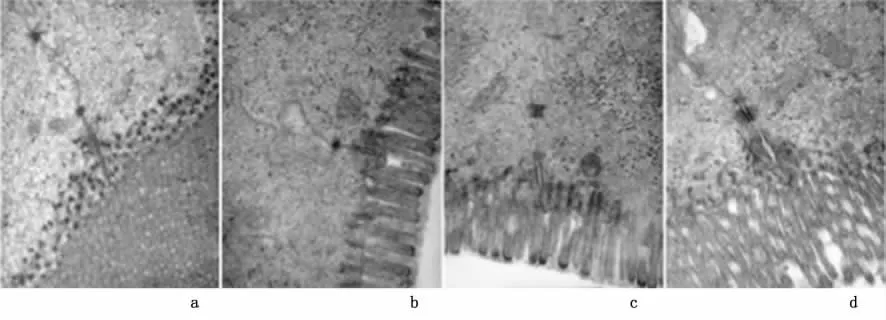
图2 IAH小肠黏膜TJ区域透射电镜照片(×20000)Figure 2 Transmission electron microscopy of the IAH-injured rat ileal mucosa(×20000)
3 讨论
在临床重危患者常见IAH。并且严重并发症和死亡率的发生率都很高。近年来,IAH和ACS以及随后发生的严重并发症之间关系的相关研究日益增多[8]。并已认识到,急性ACS是多器官功能障碍的重要原因。在动物模型和临床研究中已经有多种ACS模型和IAP测量方法[7,10]。目前,所有这些研究主要旨在清楚阐述IAH和ACS状态下机体的病理生理改变。造成ACS的方法很多,可以有林格氏液、等渗盐水、聚乙二醇以及二氧化碳吹入法来增加IAP[9-10]。本研究应用氮气吹入法增加IAP,方法简便、经济、安全。不同研究模型的腹腔压力控制的水平和维持时间不同[8,11]。世界ACS协会(WSACS)于2004年将ACS定义为IAP>20 mmHg,低于此值没有器官功能障碍[12]。20 mmHg符合ACS标准,既能造成机体生理功能紊乱,实验中又能耐受。因此,我们选择20 mmHg的压力标准来检测IAH对肠黏膜的影响。
胃肠道被覆单层上皮细胞,并被一系列TJ紧密的联系在一起。单层上皮细胞和细胞间的TJ共同作用,从而选择性的转运溶质,同时防止肠腔内有害物质侵入。肠道的这种能够预防有害物质入侵的功能称为肠道屏障功能。上皮细胞的这种屏障功能是受到细胞顶部细胞间TJ调节的。TJ由跨膜蛋白(occludin and claudins)组成,并由胞质斑蛋白、zonula occludens-1与细胞骨架连接[12]。本研究发现,在腹腔内压力达20 mmHg情况下,小肠黏膜细胞结构显著改变,TJ明显扩张。但是,TJ破坏和ACS之间的关系并不清楚。
ACS对肠黏膜屏障功能的损害有2种可能,①肠黏膜缺血:大量研究表明随着腹腔压力的增加,内脏灌注减少,肠道黏膜血供减少。Hurner等[13]观察到,IAP达20 mmHg时,尽管心脏输出没有明显变化,但肠系膜动脉和黏膜血流显著减少。Diebel等[9]在猪的IAH模型中也观察到,随着腹腔压力升高,在心脏输出和血压在正常范围时,小肠黏膜和系膜血流就已显著减少。肠道缺血是肠道屏障功能损害的重要机制[14]。②TJ形成物理屏障从而阻止有毒抗原和预防细菌易位。黏膜TJ的破坏显著地降低肠道黏膜的屏障功能。结果,细菌通过疏松的TJ,形成脓毒症。这也是ACS经常伴发脓毒症甚至多器官功能障碍的原因。其他可能的机制还包括:细胞因子和炎症介质(TNF-α、IL-1)的作用。炎症介质诱导肠道上皮细胞间的TJ损伤。从而导致肠道通透性增加。有证据表明ACS与IL-1β和TNF-α水平过高相关[15,17-19]。有关这方面的研究我们已经另文发表。
[1]Cullen DJ,Coyle JP,Teplick R,et al.Cardiovascular,pulmonary,and renal effects of massively increased intra-abdominal pressure in critically ill patients[J].Crit Care Med,1989,17(2):118-121.
[2]Sugrue M,Jones F,Deane SA,et al.Intra-abdominal hypertension is an independent cause of postoperative renal impairment[J].Arch Surg,1999,134(10):1082-1085.
[3]Tons C,Schachtrupp A,Rau M,et al.Abdominal compartment syndrome:avoidance and treatment[in German][J].Chirurg,2000,71(8):918-926.
[4]Platell CF,Hall J,Clarke G,et al.Intra-abdominal pressure and renal function after surgery to the abdominal aorta[J].Aust NZ J Surg,1990,60(3):213-216.
[5]Diebel LN,Dulchavsky SA,Brown WJ.Splanchnic ischaemia and bacterial translocation in the abdominal compartment syndrome[J].J Trauma,1997,43(5):852-855.
[6]Fanning AS,Mitic LL,Anderson JM.Transmembrane proteins in the tight junction barrier[J].J Am Soc Nephrol,1999,10(6):1337-1345.
[7]Adam JM,Prashant KN,Kory JE,et al.Recovery of mucosal barrier function in ischemic porcine ileum and colon is stimulated by a novel agonist of the ClC-2 chloride channel,lubiprostone[J].Am J Physiol Gastrointest Liver Physiol,2007,292(2):G647-G656.
[8]Malbrain ML,Chiumello D,Pelosi P,et al.Incidence and prognosis of intra-abdominal ypertension in a mixed population of critically ill patients:a multiple-center epidemiological study[J].Crit Care Med,2005,33(2):315-322.
[9]Diebel L,Dulchavsky S,Brown WJ,et al.Splanchnic ischemia and bacterial translocation in the abdominal compartment syndrome[J].J Trauma,1997,43(5):852-856.
[10]Schachtrupp A,Graf J,Tons C,et al.Intravasculer volume depletion in a hour porcine model of intra abdominal hypertension[J].J Trauma,2003,55(4):734-740.
[11]Doty J,Oda J,Ivatury R.The effects of hemodynamic shock and increased intra-abdominal pressure on bacterial translocation[J].J Trauma,2002,52(1):13-17.
[12]Turner JR.Molecular basis of epithelial barrier regulation:from basic mechanisms to clinical application[J].Am J Pathol,2006,169(6):1901-1909.
[13]Turner JR,Rill BK,Carlson SL,et al.Physiological regulation of epithelial tight junctions is associated with myosin light-chain phosphorylation[J].Am J Physiol Cell Physiol,1997,273(4Pt1):C1378-C1385.
[14]Hunter JD,Damani Z.Intra-abdominal hypertension and the abdominal compartment syndrome[J].Anaesthesia,2004,59(9):899-907.
[15]Oda J,Ivatury RR,Biocher CR,et al.Amplified Cytokine Response and Lung Injury by Sequential Hemorrhagic Shock and Abdominal Compartment Syndrome in a Laboratory Model of Ischemia-Reperfusion[J].J Trauma,2002,52(4):625-632.
[16]Rezende-Neto JB,Moore EE,Melode Andrate MV,et al.Systemic Inflammatory Response Secondary to Abdominal Compartment Syndrome:Stage for Multiple Organ Failure[J].J Trauma,2002,53:1121-1128.
[17]吴伟,朱维民,李宁,等.腹内高压对大鼠肠黏膜免疫功能的影响[J].医学研究生学报,2007,20(8):806-808.
[18]傅廷亮,高永,涂铭,等.L-精氨酸对肠缺血再灌注鼠肺血液ET-1,NO及MDA的影响[J].医学研究生学报,2000,13(3):173-175.
[19]赵允召,龚冠文,李宁,等.腹腔高压氧自由基对肠黏膜细胞凋亡的影响以及对肠道细菌易位的作用[J].医学研究生学报,2009,22(10):1020-1024.
