局部肾素-血管紧张素系统在2型糖尿病中的作用
2011-04-09邵加庆
邵加庆
糖尿病患者的数量正在快速增长,2010年中国2型糖尿病和代谢综合征患病率研究结果在《新英格兰医学杂志》上公布[1],中国成人糖尿病患病率为9.7%,糖尿病患病总数已达9240万。糖尿病前期患病率达15.5%,前期患病人数已达1.48亿。糖尿病及其并发症严重影响了患者的生活质量,加重了社会负担。
糖尿病的传统治疗主要围绕着促进胰岛素分泌和减轻外周胰岛素抵抗,而2型糖尿病患者早期主要表现为高胰岛素血症、胰岛素抵抗,随着胰岛过度代偿引发的损伤不断加重,最终出现胰岛β细胞分泌功能进行性衰竭,使糖尿病进一步恶化。因此,早期阻断糖尿病胰岛素抵抗的发生和延缓胰岛β细胞功能衰竭是2型糖尿病预防和治疗的关键,很多研究者也一直寻找这样的治疗手段,一些新药被发现,如葡萄糖依赖性促胰岛素释放肽和胰高血糖素样多肽-1类似物等,在磺脲类药物继发失效的情况下能够促进胰岛素分泌,但并不能阻止β细胞功能的进行性衰竭。
近年国外一些大规模人群临床研究发现,血管紧张素受体拮抗剂(angiotensin receptor binder,ARB)治疗显著降低了人群中新诊断糖尿病的发生率,例如LIFE研究(Losartan Intervention for Endpoint Reduction in Hypertension,氯沙坦vs β受体阻断剂,新发糖尿病发生率降低25%)[2]、VALUE研究(Valsartan Antihypertensive Long-term Use Evaluation,缬沙坦vs氨氯地平,新发糖尿病发生率降低23%)[3]和CHARM试验(Candesartan in Heart Failure—Assessment of Mortality and Morbidity,坎地沙坦vs安慰剂,新发糖尿病发生率降低22%)[4]。围绕阻断肾素-血管紧张素系统(reninangiotensin system,RAS)治疗预防糖尿病的机制,国内外学者做了一些探索,2006年Chu等[5]首次在动物模型上证实了阻断RAS能显著减轻高血糖,2008年Yamashita等[6]采用评估胰岛素敏感性的金标准胰岛素钳夹技术,发现ARB治疗改善了患者的胰岛素敏感性,但阻断RAS改善糖尿病的确切机制目前仍不清楚。
近年的研究发现除经典途径外,肾上腺、肝、胰岛、心脏、脑及脂肪组织均可合成RAS的所有组分,存在局部独立的RAS,在局部的生理及病理生理过程中起重要的作用[7]。因此目前认为RAS阻断对糖尿病的预防作用不仅与全身的RAS阻断相关,组织特异性RAS尤其是胰岛局部、脂肪组织局部合成的RAS,在抗糖尿病保护作用中起重要作用。
1 胰岛局部RAS在糖尿病中的作用
糖尿病的治疗是针对全身的全面治疗,而近来胰岛局部微环境已开始得到重视,胰岛微环境包括胰岛内部毛细血管网的结构和功能、胰岛纤维化、胰岛氧化应激程度、胰岛局部存在的旁分泌系统等。胰岛内毛细血管网密度是胰腺外分泌部的5倍,对胰岛β细胞的供血和胰岛素第一相分泌具有重要作用。胰岛微环境对胰岛细胞增殖、凋亡、分泌功能和胰岛β细胞敏感性具有较大的影响。
Leung[8]发现血管紧张素Ⅰ(angiotensinⅠ,ATⅠ)和血管紧张素Ⅱ(angiotensinⅡ,ATⅡ)受体、血管紧张素转化酶、血管紧张素原在小鼠胰岛中表达,RT-PCR、Western blot和二重荧光染色也证实了ATⅠ、ATⅡ受体特定地在胰岛β细胞表达,让我们首次认识到在胰岛局部还存在有独立的RAS系统。循环中血管紧张素的半衰期很短,而胰岛内部血管紧张素的血药浓度远远高于其全身循环浓度,胰岛局部RAS在胰岛微环境的调控中可能起重要作用。
除经典缩血管作用外,过量产生的ATⅡ能刺激和抑制细胞增殖,诱导凋亡,生成活性氧簇(reactive oxygen species,ROS),以及促炎症和纤维形成[9]。高血糖状态下,RAS是氧化应激的重要来源,从而导致胰岛中氧化应激加剧。而胰岛与其他组织相比,其内在抗氧化能力却又是最低的,因此增强的氧化应激导致胰岛β细胞出现显著的超微结构紊乱,包括胰岛素分泌颗粒的严重缺乏,内质网、高尔基体的广泛增殖和线粒体的极度肿胀。线粒体是ROS的主要来源之一,同时又是被ROS影响的主要细胞成分,线粒体内膜对即使是生理范围内的ROS也特别敏感,ROS和多不饱和脂肪酸能生成大量毒性很强的脂质过氧化产物,从而破坏线粒体膜结构完整性,出现不可逆的肿胀和破裂,启动凋亡程序,最终导致胰岛β细胞功能衰竭[10]。另有研究发现ATⅡ灌注能通过减少胰岛血流,影响胰岛内毛细血管内皮细胞的功能,而削弱第一相胰岛素分泌[11]。因此RAS一方面作为氧化应激产物的来源之一,在胰岛损伤的发生中起到一定的作用,另一方面通过β细胞上的ATⅠ受体直接发挥作用,调节影响胰岛素分泌的蛋白如葡萄糖激酶解偶联蛋白2等,并通过减少胰岛内部毛细血管内皮细胞的数量和功能,导致胰岛素分泌功能缺陷。胰岛局部RAS致胰岛β细胞功能紊乱机制见图1。
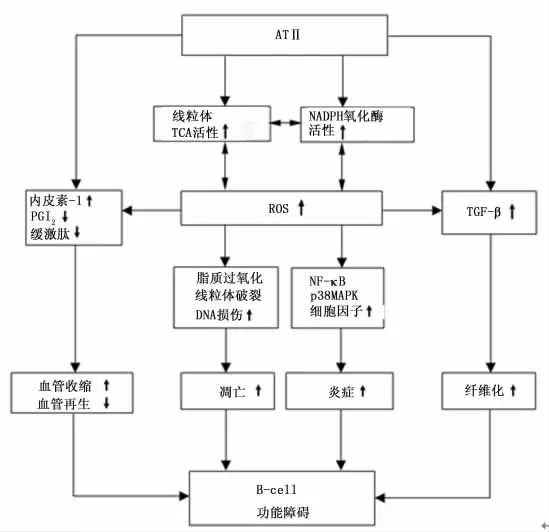
图1 胰岛局部RAS致胰岛β细胞功能紊乱机制
我们在研究中观察到阻断RAS治疗能够显著降低胰岛内8-羟基脱氧鸟嘌呤、4-羟壬烯醛和还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶P22和gp91亚基的表达水平,减轻胰岛内氧化应激的水平[12-13],从而减轻β细胞的超微结构紊乱[14],并增加胰岛局部供血[15-16],改善了葡萄糖耐量。同时采用成功创建的离体胰岛灌流系统,证实了RAS阻断显著改善了胰岛的第一相胰岛素分泌功能[17-18]。
2 脂肪组织局部RAS在糖尿病中的作用
脂肪组织也存在局部独立的RAS,是除肝以外RAS成分的最主要来源[19]。人类前脂肪细胞可生成血管紧张素基因(angioteingene,AGT)、血管紧张素转化酶,并分泌ATⅡ,同时,肾素、肾素结合蛋白和ATⅠ基因也高度表达。有研究发现高脂饮食喂养的大鼠脂肪组织中AGT mRNA表达和分泌增加,血浆ATⅡ浓度升高[20]。脂肪组织中RAS的激活对脂肪细胞生长、分化具有重要的作用。
脂肪组织中花生四烯酸代谢产物前列环素(prostacyclin,PGI2)是脂肪生成和分化过程中关键的刺激因子,ATⅡ可通过旁分泌方式诱导PGI2生成和释放,而PGI2又可促使前体细胞分化形成脂肪细胞。ATⅡ和PGI2可促进新生脂肪细胞形成,并可通过促进脂肪酸合成致脂肪细胞肥厚。同时,ATⅡ可通过刺激新生血管生长发育而间接诱导脂肪细胞肥厚。肥胖可引起脂肪组织RAS的过度激活,而过度激活的RAS可诱导脂肪细胞的分化和肥厚,从而形成恶性循环,加剧胰岛素抵抗,促使代谢综合征发生,并增加心血管和肾病变的危险性[21-22]。Tomono等[23]发现RAS的阻断能够促进全身的前脂肪细胞向成熟脂肪细胞分化,减少脂肪在肝和肌肉的异位沉积,从而改善胰岛素敏感性。Masuo等[24]观察到阻断RAS,可明显降低代谢综合征患者血浆胰岛素和瘦素水平。Clasen等[25]发现替米沙坦和厄贝沙坦可通过阻断RAS促进脂肪组织中脂联素的表达而改善胰岛素抵抗。
综上所述,体内一些内分泌组织存在局部独立的RAS,在局部微环境的调控中起重要的作用。糖尿病状态下过度激活的局部RAS,加剧了组织的炎性反应和氧化应激,并对局部的微血管、纤维化程度及细胞分化具有一定的调控作用,进加重全身胰岛素抵抗和胰岛功能衰竭,在糖尿病的发病机制中起一定的作用。因此针对RAS阻断治疗可有效地减轻组织的氧化应激损伤,改善局部微循环,增加胰岛素敏感性,保护了胰岛分泌功能,延缓了糖尿病的发生和发展。
[1]Yang WY,Lu JM,Weng JP,et al.Prevalence of Diabetes among Men and Women in China[J].N Engl J Med,2010,362(12):1090-1101.
[2]Lindholm LH,Ibsen H,Borch-Johnsen K,et al.Risk of New-Onset Diabetes in the Losartan Intervention for Endpoint Reduction in Hypertension Study[J].J Hypertens,2002,20(9):1879-1886.
[3]Kjeldsen SE,Julius S,Brunner H,et al.Characteristics of 15,314 Hypertensive Patients at High Coronary Risk.The Value Trial.The Valsartan Antihypertensive Long-Term Use Evaluation[J].Blood Press,2001,10(2):83-91.
[4]Yusuf S,Ostergren JB,Gerstein HC,et al.Effects of Candesartan on the Development of a New Diagnosis of Diabetes Mellitus in Patients with Heart Failure[J].Circulation,2005,112(1):48-53.
[5]Chu KY,Lau T,Carlsson PO,et al.Angiotensin II type 1 receptor blockade improves β-Cell function and glucose tolerance in a mouse model of type 2 diabetes[J].Diabetes,2006,55(2):367-374.
[6]Yamashita H,Yoda H,Maruki T,et al.Telmisartan,an angiotensin II type-1 receptor blocker,improved insulin resistance in a schizophrenic patient treated with olanzapine:A case report[J].Prog Neuropsychopharmacol Biol Psychiatry,2008,32(1):308-310.
[7]Lau T,Carlsson PO,Leung PS.Evidence for a Local Angiotensin-Generating System and Dose-Dependent Inhibition of Glucose-Stimulated Insulin Release by Angiotensin Ii in Isolated Pancreatic Islets[J].Diabetologia,2004,47(2):240-248.
[8]Leung PS.The physiology of a local renin-angiotensin system in the pancreas[J].J Physiol,2007,580(1):31-37.
[9]Kampf C,Lau T,Olsson R,et al.Angiotensin II Type 1 Receptor Inhibition Markedly Improves the Blood Perfusion,Oxygen Tension and First Phase of Glucose-Stimulated Insulin Secretion in Revascularised Syngeneic Mouse Islet Grafts[J].Diabetologia,2005,48(6):1159-1167.
[10]Santos DL,Palmeira CM,Seica R,et al.Diabetes and Mitochondrial Oxidative Stress:A Study Using Heart Mitochondria from the Diabetic Goto-Kakizaki Rat[J].Mol Cell Biochem,2003,246(2):163-170.
[11]Leung PS,Carlsson PO.Pancreatic Islet Renin Angiotensin System:Its Novel Roles in Islet Function and in Diabetes Mellitus[J].Pancreas,2005,30(4):293-298.
[12]邵加庆,岩下乃夕,杜宏,等.坎地沙坦对db/db糖尿病小鼠胰岛功能和结构的保护[J].中华内分泌代谢杂志,2007,23(2):110-116.
[13]邵加庆,顾萍,杜宏,等.替米沙坦对db/db小鼠胰岛内NADPH氧化酶表达水平的影响[J].医学研究生学报,2010,23(7):680-683.
[14]Shao J,Iwashita N,Ikeda F,et al.Beneficial effects of candesartan,an angiotensin II type 1 receptor blocker,on β-cell function and morphology in db/db mice[J].Biochem Biophys Res Commun,2006,344(4):1224-1233.
[15]邵加庆,顾萍,杜宏,等.替米沙坦对db/db小鼠胰岛内微血管结构的影响[J].中华老年心脑血管病杂志,2010,12(8):726-728.
[16]顾萍,邵加庆,杜宏,等.替米沙坦对db/db小鼠胰岛分泌功能影响的研究[J].中国糖尿病杂志,2011,19(1):64-67.
[17]邵加庆,顾萍,杜宏,等.建立离体胰岛灌流系统用于评估胰岛素第一相分泌功能[J].中华医学杂志,2010,90(2):119-121.
[18]邵加庆,顾萍,卢斌,等.替米沙坦对体外胰岛的第一相胰岛素分泌功能的影响[J].医学研究生学报,2010,23(9):900-903.
[19]Pinterova L,Krizanova O,Zorad S.Rat epididymal fat tissue express all components of the renin-angiotensin system[J].Gen Physiol Biophys,2000,19(3):329-334.
[20]Boustany CM,Bharadwaj K,Daugherty A,et al.Activation of the systemic and adipose renin-angiotensin system in rats with diet-induced obesity and hypertension[J].Am J Physiol Regul Integr Comp Physiol,2004,287(4):R943-R949.
[21]Ailhaud G,Fukamizu A,Massiera F,et al.Angiotensinogen,angiotensin II and adipose tissue development[J].Int J Obes Relat Metab Disord,2000,24(Suppl 4):S33-S35.
[22]Gu P,Jiang W,Du H,et al.Protein tyrosine phosphatase 1B gene polymorphisms and essential hypertension:a case-control study in Chinese population[J].J Endocrinol Invest,2010,33(1):483-488.
[23]Tomono Y,Iwai M,Inaba S,et al.Blockade of At1 Receptor Improves Adipocyte Differentiation in Atherosclerotic and Diabetic Models[J].Am J Hypertens,2008,21(2):206-212.
[24]Masuo K,Mikami H,Ogihara T,et al.Weight reduction and pharmacologic treatment in obese hypertensives[J].Am J Hypertens,2001,14(6 Pt1):530-538.
[25]Clasen R,Schupp M,Foryst-Ludwig A,et al.PPARgamma-activating angiotensin type-1 receptor blockers induce adiponectin[J].Hypertension,2005,46(1):137-143.
