地塞米松对大鼠脑出血后周围脑组织MMP-9表达的影响
2011-03-15王善军王道奎王玉亭闫瑞云
王善军,王道奎,王玉亭,闫瑞云
基质金属蛋白酶(matrixmetalloproteinases,MMPs)是一组降解细胞外基质(ECM)分子的锌、钙依赖性的中性蛋白酶类,在神经系统中MMP-9最为重要,Gursoy-Ozdemir等[1]发现血浆蛋白的渗漏与脑水肿形成同时发生,而在没有MMP-9的老鼠中没有发现蛋白质渗漏,由此推测大鼠ICH脑水肿的形成可能与MMP-9的形成及ECM的降解有关。DEX作为临床上常用的控制脑水肿的辅助用药,其疗效已为大多数医生所接受,然而其对物质代谢、神经细胞凋亡等诸多方面的负面影响又不容忽视,本实验通过从DEX与MMP-9表达的影响方面入手,研究DEX对控制脑水肿的可能的作用通道,从而为副作用小、效果更好的DEX替代药物的研制提供理论依据。
1 材料与方法
1.1 材料 清洁级雄性Wistar大鼠,由潍坊医学院动物房代购于山东鲁抗医药股份有限公司(许可证号:scxk鲁20080002),体重 310~380 g,随机分为A、B、C 3组;大鼠脑立体定向仪(ZH-蓝星B型)、100μl微量注射器、手术器械包、MMP-9-抗(北京中杉)、PV 9003试剂盒(北京中杉)、DAB试剂盒等。
1.2 方法 (1)分组:63只雄性Wistar大鼠,随机分为A组(DEX干预组)21只;B组(模型组)21只;C组(对照组)21只,分别按照时间点6 h、12 h、24 h、3 d、5 d、7 d、14 d分为7个亚组,每组 3只。(2)建立大鼠脑出血模型:参照Xue等[1]方法,以前囟前0.2mm,中线右旁开3mm,垂直进针5.5mm,为大鼠右侧基底节区;断尾取血 50μl,以微量注射器缓慢注入脑内定位的位置。(3)取材、包埋、切片分别于各时间点大鼠经水合氯醛麻醉后,以颈总动脉灌注固定,4%多聚甲醛固定 24~48 h后制成蜡块,切片后 60℃烤箱 1~2h后备用。
1.3 MMP-9检测 按照说明书对MMP-9采用PV 9003试剂盒进行检测,DAB显色,阳性细胞呈棕黄色,每张切片在高倍镜(×400)下选取 3个不同视野,记录每个视野阳性细胞数,取平均值作为阳性细胞计数。
1.4 统计学方法 采用SPSS17.0软件进行统计分析。数据均以±s表示。采用单因素方差分析(One-way ANOVA)做统计学检验,P<0.05视为有统计学意义。
2 结果
MMP-9主要分布于神经元及胶质细胞的细胞膜及胞浆中,胞膜及胞浆被染成棕褐色。对照组:血肿周围脑组织仅见少量MMP-9阳性细胞;模型组:6h可见少量的散在的阳性细胞表达,24 h阳性细胞开始明显增多,第 3天达到高峰,到第14天时仍有少量表达;DEX干预组:6 h可见较少阳性细胞表达,同样在24h开始迅速增多,第 3天达到高峰,后逐渐下降, 14 d时仍可见少量的MMP-9阳性细胞。DEX干预组、模型组、对照组之间两两比较差别均有统计学意义(P<0.05)。DEX干预组12 h、24h、3 d、5 d、7 d时间点MMP-9阳性细胞计数与模型组相比差异有统计学意义(P<0.05),6 h、14 d时DEX干预组与模型组相比差别无统计学意义(P>0.05),见表 1;3组各时间点具体阳性细胞数见表 2。

表1 各组在各时间点之间两两比较的P值
表2 各组各时间点MMP-9阳性细胞数(±s)
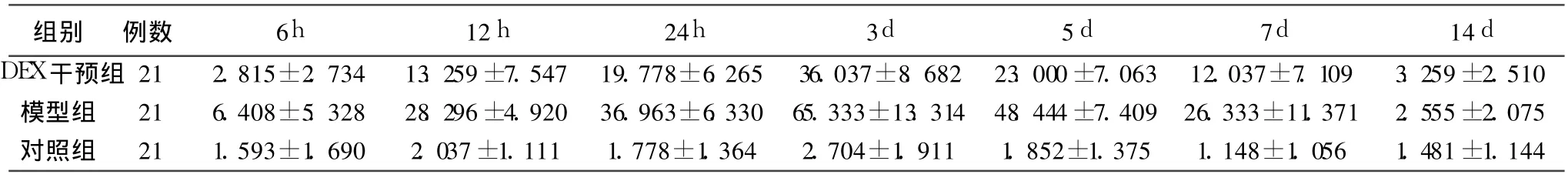
表2 各组各时间点MMP-9阳性细胞数(±s)
组别 例数 6h 12h 24h 3d 5d 7d 14d DEX干预组 21 2.815±2.734 13.259±7.547 19.778±6.265 36.037±8.682 23.000±7.063 12.037±7.109 3.259±2.510模型组 21 6.408±5.328 28.296±4.920 36.963±6.330 65.333±13.314 48.444±7.409 26.333±11.371 2.555±2.075对照组 21 1.593±1.690 2.037±1.111 1.778±1.364 2.704±1.911 1.852±1.375 1.148±1.056 1.481±1.144
3 讨论
脑出血(intracerebral hemorrhage,ICH)是临床常见病,作为预后最差的卒中类型[2-3]在我国发病比例远高于欧美,约占全部脑卒中的 30%[4],其发病率、致残率和病死率均较高。脑水肿是ICH后最重要并发症之一,其产生和发展是导致ICH患者病情恶化或死亡的主要原因之一,临床上能否有效控制脑水肿成为治疗脑出血成功与否的重要指标,对脑出血患者的病程及疗效产生深远的影响。故深入研究脑出血后水肿的形成机制并结合相应机制通道给予积极、有效的治疗,降低其致残率、病死率成为目前临床治疗脑出血需要迫切解决的问题。近年来在脑出血后脑水肿形成机制方面的研究取得了一定的成果。研究发现,脑出血后水肿是细胞毒性水肿和血管源性水肿的共同结果,其作用机制包括,液体静力压和血凝块回缩、凝血酶原的产生和激活、血红蛋白的毒性作用、补体激活、炎性反应损伤和血脑屏障开放等。其中血脑屏障(b loodbrain barrier,BBB)破坏对继发脑水肿形成的作用,受到越来越多的重视。
血脑屏障(BBB)主要由脑毛细血管内皮细胞、血管基底膜以及胶质细胞足突构成。细胞外基质(extracellar matrix, ECM)分子如Ⅳ型胶原、层粘蛋白和纤维连接蛋白等构成的基膜是维持BBB完整的重要结构基础,直接决定着BBB的通透性,如果其遭受破坏,将使血管通透性增加,导致血管源性脑水肿。
地塞米松作为重要的控制脑水肿的辅助用药,药理作用广泛,具有抗炎、抗免疫、抗毒素、抗休克作用,广泛应用于临床,控制脑水肿的作用被大多数研究人员所认同,已有学者[5]认为其作用机制是通过减少炎症因子的生成,从而减轻血脑屏障的破坏来减轻脑水肿的 ,具体的作用通道及机理各研究却不统一,Hyongbum Kim等[6]认为地塞米松是通过调节血管生成素 1和血管内皮生长因子来实现的,而 GU YT等[7]认为是通过减少AQP-4的表达实现的,近年来MMP-9在血脑屏障破坏及继发性脑水肿方面的研究日益受到重视。
基质金属蛋白酶(MMPs)是一组降解细胞外基质(ECM)分子的锌、钙依赖性的中性蛋白酶类,在神经系统中MMP-9最为重要,Rosenberg等[8]在细菌胶原酶诱导的大鼠ICH模型上发现,模型大鼠24 h脑组织含水量和MMP-9含量增加,并伴有富含Ⅳ型胶原的脑血管床基膜的破坏,MMPs抑制剂(tissue inhibitor ofmetalloproteinase,TIMPs)能显著降低细菌胶原酶注射部位周围脑组织的含水量。Gursoy-Ozdemir等[9]发现血浆蛋白的渗漏与脑水肿形成同时发生,而在没有MMP-9的老鼠中没有发现蛋白质渗漏,由此推测大鼠 ICH脑水肿的形成可能与MMP-9的形成及ECM的降解、BBB基底膜的破坏有关。目前国内外研究多集中在 MMP-9与血脑屏障破坏及脑水肿的关系上,药物干预对MMP-9在脑出血时周围脑组织中表达的影响的研究较少。
本实验DEX干预组与模型组之间在12h、24h、3 d、5 d、7 d时间点MMP-9阳性表达的差别有统计学意义(P<0.05),说明DEX对MMP-9的表达有影响,能够减少MMP-9的表达,这与DEX减轻脑水肿的作用过程相一致,因此我们认为DEX减轻脑水肿与MMP-9作用通道有关。14 d时3组之间差别均无统计学意义(P>0.05),说明DEX对MMP-9表达的影响主要集中在7 d以内。因此我们认为,从MMP-9作用通道来看, DEX用于控制水肿为目的时,应该控制在发病后 7 d内,发病7 d以后,特别是 14 d以后应用已无临床意义。
综上所述,我们推测 DEX减轻脑水肿是通过减轻血管源性脑水肿和细胞中毒性脑水肿两个方面实现的,可能的作用机理为:(1)特异性抑制生物活性物质(如MMP-9等)的生成,从而减少细胞外基质的溶解、破坏,从而降低血脑屏障的通透性;(2)非特异性抗炎作用,通过阻断炎症级联,减少炎症因子的生成及活化,减轻细胞的炎症反应,从而减轻脑出血后继发性损伤;(3)增加细胞间连接的紧张度,从而减轻细胞间隙内水分的聚集;(4)稳定细胞膜的离子通道,增强钠-钾泵等在维持细胞内外离子分布中的作用;具体的作用机制及其他主要的作用靶点有待于进一步地研究。
[1] Gursoy-Ozdem ir Y,Qiu J,Matsuoka N,et al.Cortical spreading de-pression activates and upregulates MMP-9[J].Clin Invest,2004,113 (10):1447-1455.
[2] Silva Y,Leira R,Tejada J,et al.Molecular signatures of vascular injury are associated with early growth of intracerebral hemorrhage [J].Stroke,2005,36(1):86-91.
[3] Mayer SA.Ultra-early hemostatic therapy for intracerebral hemorrhage[J].Stroke,2003,34(1):224-229.
[4] Brown DL,Morgenstern LB.Stopping the bleeding in intracerebral hemorrhage[J].N Engl JMed,2005,352(8):828-830.
[5] Sugimura Y,Murase T,Takefuji S,et al.Protective effect of dexamethasone on osmotic-induced demyelinationin rats[J].Exp Neurol, 2005,192(1):178–183.
[6] Kim H,Lee JM,Park JS,et al.Dexamethasone coordinately regulates angiopoietin-1 and VEGF:A mechanism of glucocorticoid-induced stabilization of blood-brain barrier[J].Biochem Biophys Res Commun,2008,372(1):243–248.
[7] Gu YT,Zhang H,Xue YX.Dexamethasone treatment modulates aquaporin-4 expression after intracerebral hemorrhage in rats[J]. Neurosci Lett,2007,413(2):126-131.
[8] Rosenberg GA,Navratil M.Metalloproteinase inhibition blocks edema in intracerebral hemorrhage in the rat[J].Neurology,1997,48 (4):921-926.
