斜矢状位高分辨三维黑血磁共振成像在粥样硬化颈动脉支架术前评估的应用价值
2011-02-27王庆军,王勇,蔡剑鸣等
目前症状性颈动脉粥样硬化斑块主要有两种非药物治疗方法:支架置入术(carotid stenting, CS)和内膜剥脱术(carotid endarterectomy, CEA)。由于创伤性小,而且与CEA相比疗效相似,CS逐渐被更多的颈动脉粥样硬化患者所接受[1]。然而术前对颈动脉管腔狭窄程度及斑块形态的准确评估是CS取得成功的关键因素[2]。本研究旨在通过与斜矢状位高分辨二维黑血磁共振成像(oblique-sagittal high-resolution two-dimensional black-blood magnetic resonance imaging, 2D-BB-MRI)及数字减影血管造影(digital subtraction angiography, DSA)图像对照分析,评价斜矢状位高分辨三维黑血磁共振成像(obliquesagittal high-resolution three-dimensional black-blood magnetic resonance imaging, 3D-BB-MRI)在CS术前评估颈总动脉远端、分叉处及颈内动脉近端管腔最大狭窄程度、斑块厚度、斑块累及范围等方面的应用价值。
1 资料与方法
1.1 研究对象 18例颈动脉粥样硬化患者,经超声证实至少一侧颈动脉管腔狭窄>70%,并在相应供血区有缺血性脑血管病症状(脑梗死、短暂性脑缺血发作)而预行CS手术。在术前1周之内对所有患者的预手术侧颈动脉(包括颈总动脉远端、分叉处及颈内动脉近端)进行2D-BB-MRI、3D-BB-MRI及DSA检查。排除条件如下:以前曾接受过颈动脉支架置入或CEA手术、中-重度肾功能不全、幽闭恐惧症、对MRI造影剂过敏以及其他有 MRI检查禁忌证的患者。在纳入本研究之前,所有患者或其监护人均阅读相关知情同意书并签字。
1.2 检查方法
1.2.1 斜矢状位 2D-BB-MRI和 3D-BB-MRI ①设备:3.0-T的磁共振仪(EXCITE HD, GE Healthcare, M ilwaukee)及4通道颈动脉专用相控阵表面线圈。②2D-BB-MRI:首先行颈动脉三维时间飞跃法(three-dimensional time-of-flight, 3D-TOF)MRI扫描,以在覆盖预手术侧颈总动脉远端、分叉处及颈内动脉近端同时,获得颈动脉分叉的准确位置并初步判断管腔最大狭窄部位。以3D-TOF原始图像所显示的颈动脉分叉为定位图像,要求2D-BB-MRI扫描层面垂直于斑块最厚管壁并尽量通过颈总动脉远端、颈内及颈外动脉近端的管腔中心。每侧颈动脉各进行 1层2D-BB-MRI扫描(图1~3)。2D-BB-MRI的扫描参数见表1。③3D-BB-MRI:以3D-TOF原始图像所显示的颈动脉分叉为定位图像,沿颈动脉管腔长轴覆盖颈总动脉远端、分叉处及颈内动脉近端(图4~6)。扫描完成后,由1名有经验的放射科医师对原始的斜矢状位 3D-BB-MRI图像进行容积重建(volume rendering, VR),要求重建层面垂直于斑块最厚管壁并尽量通过颈总动脉远端、颈内及颈外动脉近端的管腔中心。每侧颈动脉各重建出1层3D-BB-MRI图像。3D-BB-MRI的扫描参数见表1。
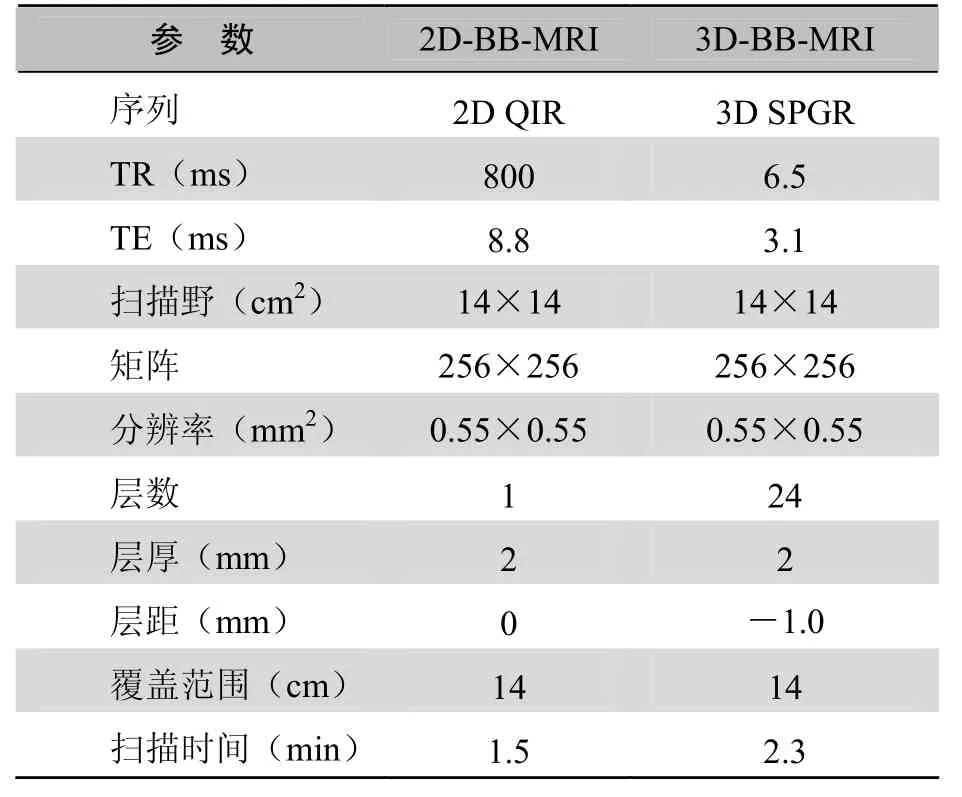
表1 3.0-T高分辨颈动脉MRI成像参数
1.2.2 数字减影血管造影(DSA) ①设备:GE公司INNOVA4100 C形臂数字平板血管造影系统。②方法:采用股动脉穿刺逆行血管造影法,常规消毒铺巾,暴露双侧腹股沟部,局部用2%利多卡因浸润麻醉,穿刺成功后置入导管鞘,拔除导丝,静脉注射肝素25mg,标准的诊断导管经鞘进入股动脉一直到达主动脉弓。首先行主动脉弓造影以了解颈总动脉位置,再选择性地把诊断导管送入预手术侧颈总动脉。从多角度(正位、斜位、侧位)显示颈动脉(重点投照颈总动脉远端、分叉处及颈内动脉近端)。注射对比剂(欧乃派克,300mgI/m l)速度为4~5m l/s,总量9~12m l。数字平板像素矩阵为 1024×1024,图像采集分辨率为0.20×0.20mm2。
1.3 图像编号 对每例患者的DSA、2D-BB-MRI及3D-BB-MRI重建图像按照随机排序的方法进行重新编号(图像显示信息只有编号),并记录图像编号与患者原始信息对应关系,并将编号处理后的图像传入具有融合、分格匹配功能的大屏幕、高分辨工作站(ADW 4.3)。
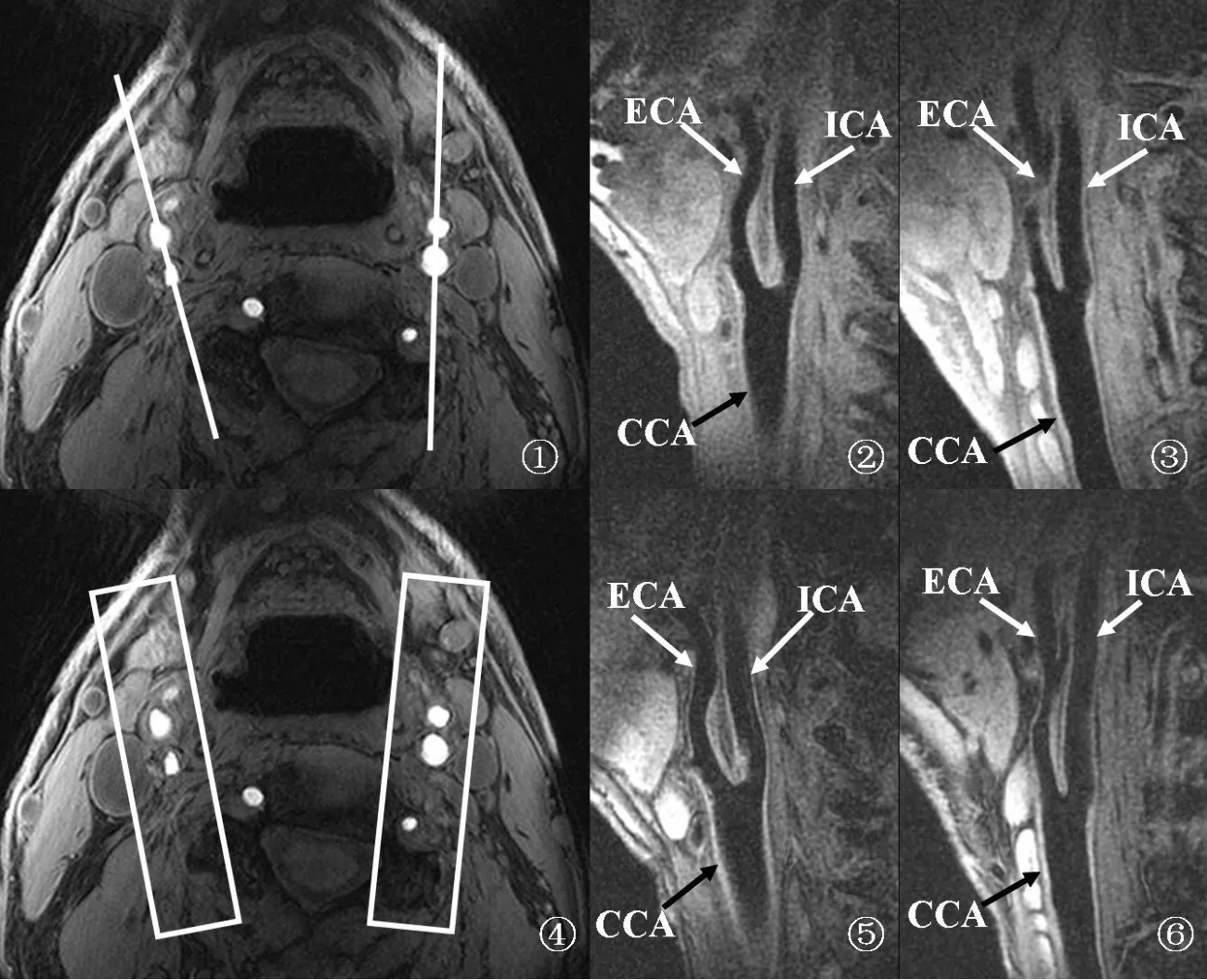
图1 ~3 双侧颈动脉2D-BB-MRI扫描定位及图像。图4~6 双侧颈动脉3D-BB-MRI扫描定位及重建图像。CCA. 颈总动脉;ECA. 颈外动脉;ICA. 颈内动脉
1.4 图像评价
1.4.1 DSA与MRI图像质量评价 首先在后处理工作站(ADW 4.3),由 2名有经验的放射科医师对所有DSA与MRI图像质量进行共同评价。主要评价内容包括血管显影强度、运动或流动伪影、管腔与管壁交界面清晰程度,并参考相关文献[2]采用 0~2分的等级评价标准:0=图像质量差,无法做出诊断;1=图像质量一般,但可以做出诊断;2=图像质量非常好,诊断明确。评为1、2分的图像可以进行进一步分析,评为0分的DSA或MRI图像将从研究中剔除。
1.4.2 观测指标评价 观测指标包括:管腔最大狭窄程度(maximum stenosis, Max-stenosis)、斑块横向最大厚度(maximum transverse plaque thickness, Max-PT)、斑块纵向最大范围(maximum longitudinal plaque extension, Max-LPE)、颈动脉管腔最大狭窄程度的计算,按照北美症状性动脉内膜切除试验(NASCET)法进行计算[3]。Max-stenosis=(B-A)/B×100%,其中B为邻近相对正常的管腔直径(颈内动脉取远侧、颈总动脉及分叉处取近侧),A为最狭窄处剩余管腔直径。Max-TPT为垂直于颈动脉长轴方向上斑块的最大厚度。Max-LPE为沿颈动脉长轴方向上斑块累及的最大范围。
1.4.3 DSA和MRI中观测指标的测量及记录 在同一台后处理工作站(ADW 4.3),2名放射科医师在不知道病理及患者原始信息的情况下,共同对 DSA、 2D-BB-MRI及3D-BB-MRI重建图像观测指标进行测量。每侧颈动脉DSA有正位、斜位、侧位3个图像,首先从中选出最能反映颈动脉管腔狭窄程度的一层图像进行评价,测量并计算 Max-stenosis。在测量Max-TPT时首先由这2位医师共同确定最厚斑块的位置,然后在垂直于管壁长轴方向上测量 Max-TPT值。在测量Max-LPE时,如果是上下连续斑块,则取斑块上下端的直线距离作为本层图像中斑块范围,如果是上下不连续斑块,则分别取各自斑块上下端的直线距离后再相加作为本层图像中的Max-LPE值。
2 结果
2.1 DSA与MRI图像质量 18例患者所有DSA与MRI图像质量评分均≥2。因此,共有 18个颈动脉图像进入观测指标的评价研究。
2.2 观测指标 在评估颈动脉管腔最大狭窄程度方面,DSA的测量结果为80.63%±4.67%,2D-BB-MRI为 77.75%±5.61%,两者之间差异无统计学意义(P=0.121)(表2);3D-BB-MRI为79.80%±4.06%,与 DSA测量结果之间差异也无统计学意义(P=0.849)(表2)。经相关分析,在评估颈动脉管腔最大狭窄程度方面,2D-BB-MRI与DSA的相关系数为r=0.516(P=0.001),3D-BB-MRI与DSA的相关系数为r=0.945(P=0.001),均有较好的相关性(表2)。但是从平均差异来看,3D-BB-MRI所显示的管腔最大狭窄程度更接近于DSA的检查结果(图7~9),而2D-BB-MRI低估了管腔狭窄程度(表2)。在评估斑块横向最大厚度方面,2D-BB-MRI和3D-BB-MRI之间差异无统计学意义(3.99±1.53mm vs 4.27±1.55mm, P=0.450)(表3)。而在评估斑块纵向最大范围方面,3D-BB-MRI所显示的斑块范围明显大于 2D-BB-MRI所显示的范围(16.74±5.54mm vs 14.01±3.89mm,P=0.001)(表3)。
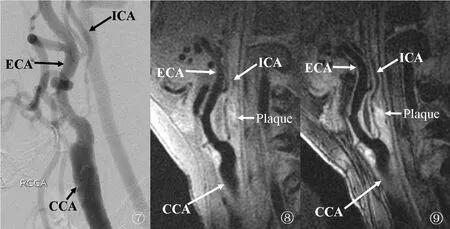
图7 DSA图像示右侧颈动脉分叉处管腔轻度狭窄、颈内动脉起始段管腔显著狭窄。图8 2DBB-MRI图像示右侧颈动脉分叉处、颈内动脉起始段斑块形成伴颈内动脉起始段管腔显著狭窄。图9 3D-BB-MRI重建图像示右侧颈动脉分叉处、颈内动脉起始段斑块形成,斑块范围及颈内动脉起始段管腔狭窄情况较 2D-BB-MRI图像显示更为清晰。CCA. 颈总动脉;ECA. 颈外动脉;ICA. 颈内动脉

表2 与DSA对照分析2D-BB-MRI和3D-BB-MRI在评估管腔最大狭窄程度方面的差异

表3 2D-BB-MRI和3D-BB-MRI在评估斑块横向最大厚度 (Max-TPT) 和斑块纵向最大范围 (Max-LPE) 方面的差异
3 讨论
本研究以DSA及斜矢状位2D-BB-MRI图像为对照,分析了斜矢状位3D-BB-MRI检查在评价颈动脉(颈总动脉远端、分叉处及颈内动脉近端)最大狭窄程度(Max-stenosis)、斑块横向最大厚度(Max-TPT)和斑块纵向最大范围(Max-LPE)等方面的应用价值。结果显示,斜矢状位3D-BB-MRI可以较准确地显示颈动脉Max-stenosis(与 DSA结果很接近),并且在显示Max-LPE方面较斜矢状位2D-BB-MRI图像更全面。
长期以来DSA一直作为CS术前主要检查方法。DSA在CS术前对颈动脉的评价中,不仅可以在较大范围内显示动脉管腔狭窄的部位、程度,而且可以显示颅内动脉(如椎-基底动脉、大脑中动脉等)有无狭窄情况,从而为CS手术提供较全面的颅内、外动脉狭窄信息。然而,CS手术的成功与否和长期疗效不仅取决于术前动脉管腔狭窄程度,还与斑块本身的稳定性以及斑块切除程度关系密切。Ener等[4]研究发现CS术后再狭窄与斑块累及范围密切相关。因此,寻找一种无创的检查方法,准确反映颈动脉管腔最大狭窄部位和最大狭窄程度,并能够客观显示斑块大小、范围已经成为当前CS术前评估的重要部分。
在各种影像学检查方法中,DSA是评价动脉管腔狭窄情况的“金标准”[5]。本研究通过与DSA图像对照分析发现2D-BB-MRI和3D-BB-MRI在显示管腔最大狭窄程度方面与 DSA无明显差异,而且2D-BB-MRI和3D-BB-MRI与DSA均有较好的相关性。但是,3D-BB-MRI所显示的管腔最大狭窄程度更接近于DSA的检查结果,而2D-BB-MRI低估了管腔狭窄程度。其原因可能是2D-BB-MRI对于部分走形过于迂曲的远侧颈内动脉显示不够充分,导致按照NASCET法进行计算管腔狭窄程度时得到了偏低的数值。而3D-BB-MRI在重建过程中最大限度地包括了颈总动脉远端、分叉处以及颈内动脉近端的狭窄管腔,因此可以更加真实地反映管腔狭窄情况。
只有在术前对颈动脉斑块厚度和范围做出准确评估,才能在CS术前选择最佳尺寸的支架,以在不损伤正常管壁的前提下最大限度地扩张狭窄血管。已有病理对照研究结果显示,使用多序列高分辨颈动脉MRI检查技术,尤其是横轴位黑血MRI增强扫描可以准确显示粥样硬化血管壁结构改变和斑块内成分(如纤维帽、脂质核等)[6]。但是在目前的日常工作中,平均每层横轴位黑血MRI增强图像耗时30s,按每次检查扫描 12~16层计算,则扫描时间为 6~8m in[7],如果再加上 2D-TOF、3D-TOF及横轴位黑血 MRI平扫等检查序列,整个扫描时间为 30~40min。如此长的检查时间往往会给患者带来较大的痛苦,并增加运动伪影的产生。而本研究中使用的3D-BB-MRI检查方法,单侧颈动脉扫描时间约为2.3m in。更为重要的是,横轴位黑血 MRI增强图像按每层面2mm及0mm间隔(12~16层)计算,覆盖范围仅为24~32mm,往往会将一些较大范围的斑块遗漏。在本研究中,我们使用3D-BB-MRI沿颈动脉长轴进行扫描,在利用高分辨成像清晰显示颈动脉粥样硬化斑块内部成分(纤维帽、脂质核等)同时,还得到了更大的颈动脉扫描覆盖范围(14cm)。
虽然DSA所显示的颈动脉范围更大,但是由于DSA对于斑块累及范围只能间接通过管腔狭窄长度进行判断,因此往往会低估斑块范围[8]。本研究发现,在评估斑块横向最大厚度方面,2D-BB-MRI和3D-BB-MRI之间无明显差异,而在评估斑块纵向最大范围方面,3D-BB-MRI所显示的斑块范围明显大于2D-BB-MRI所显示的范围。斑块最大累及范围是CS术前评价的重要指标。已有研究表明[9],术后内膜进一步增厚(粥样硬化)是CS术后管腔内再狭窄的主要原因,而尽量覆盖动脉硬化段内膜将会减少CS术后再狭窄的发生。因此3D-BB-MRI可以在判断斑块累及范围方面为CS提供非常好的术前评估。
本研究还存在几方面的不足之处:①样本量较小,由于研究期内CS手术患者有限,因此本研究样本量较小。②未使用三维DSA(3D-DSA)检查方法,3D-DSA可以更加准确、全面地评价颈动脉管腔狭窄情况[10]。考虑到本研究的主要目的除分析 DSA和2D-BB-MRI、3D-BB-MRI在显示管腔狭窄方面的差异外,还要观察斑块本身情况,而3D-DSA图像空间分辨率会有所下降,因此本组病例并未使用3D-DSA。③为了尽量避免主观偏差,本研究中对于DSA图像采用了3个固定的角度(正位、斜位、侧位)进行评价,这可能会在一定程度上受投照角度局限性的影响。
综上所述,3D-BB-MRI可以较准确、客观地评价颈动脉(颈总动脉远端、分叉处及颈内动脉近端)管腔最大狭窄程度、斑块最大厚度、斑块最大范围。3D-BB-MRI可为CS手术提供非常好的术前准备。
[1] Brott TG , Hobson RW , Howard G , et al. Stenting versus endarterectomy for treatment of carotid-artery stenosis. N Engl J Med, 2010, 363(1): 11-23.
[2] Yoshida K, Endo H, Sadamasa N, et al. Evaluation of carotid artery atherosclerotic plaque distribution by using long-axis high-resolution black-blood magnetic resonance imaging. J Neurosurg,2008, 109(6): 1042-1048.
[3] North American Symptomatic Carotid Endarterectomy Trial. Methods, patient characteristics, and progress. Stroke, 1991, 22(6): 711-720.
[4] Ener RA, Fiss D, Georgakis A, et al. Carotid artery in-stent restenosis after carotid artery stenting. J Invasive Cardiol, 2008, 20(6): 286-291.
[5] Patel SG, Collie DA, Wardlaw JM, et al. Outcome, observer reliability, and patient preferences if CTA, MRA, or Doppler ultrasound were used, individually or together, instead of digital subtraction angiography before carotid endarterectomy. J Neurol Neurosurg Psychiatry, 2002, 73(1): 21-28.
[6] Saam T, Schoenberg SO, Hatsukam i TS, et al. Highresolution magnetic resonance imaging of carotid atherosclerotic plaque. Rofo, 2008, 180(2): 100-111.
[7] 李树合, 周定标, 袁晓玲, 等. 颈动脉粥样硬化不稳定斑块异质性的病理研究及高分辨MRI影像特点分析. 中华神经外科杂志, 2006, 22(8): 485-488.
[8] Honish C, Sadanand V, Fladeland D, et al. The reliability of ultrasound measurements of carotid stenosis compared to MRA and DSA. Can J Neurol Sci, 2005, 32(4): 465-471.
[9] Harrer JU, Morschel R, Mull M, et al. High rate of restenosis after carotid artery stenting in patients w ith high-grade internal carotid artery stenosis. Medium-term follow-up. J Neurol, 2008, 255(9): 1309-1314.
[10] Iwai R, Tsumura K, Kuwayama N, et al. Three-dimensional DSA imaging and 3-dimensional measurement of cross section for internal carotid artery stenosis. No To Shinkei, 2003, 55(8): 661-667.
