盐酸双苯氟嗪单层芯渗透泵控释片的研制
2011-01-09曹德英河北医科大学药学院石家庄市050017
李 立,白 靖,曹德英(河北医科大学药学院,石家庄市 050017)
盐酸双苯氟嗪(Dipfluzine hydrochloride,DH)是由第Ⅲ类钙拮抗剂桂利嗪和中枢多巴胺受体阻断剂氟哌啶合成而来,是河北医科大学自主研发合成的新一代哌嗪类钙离子拮抗剂。化学名称为 4[4-(二苯甲基)-1-哌嗪基]-1-(4-氟苯基)-1-丁酮。DH为浅黄色或白色细小针状结晶或粉末,几乎无臭,溶于水,溶于沸乙醇、丙酮,熔点:135.5~136.0℃。
以往的研究[1]表明,双苯氟嗪能选择性地扩张椎基底动脉、基底动脉和冠状动脉,不但对脑水肿有保护作用,对局灶性脑缺血和全脑缺血再灌注损伤也均具有保护作用,其扩张脑血管能力强于以往的脑血管用药,是治疗缺血性脑血管疾病独具开发潜力和应用前景的新型药物。但其毒代动力学研究[2]表明,大剂量可产生肺充血等急性毒性。为了降低药物不良反应发生率,避免药物峰-谷现象,提高患者用药的顺应性,设计将DH制成日服2次的渗透泵控释制剂。由于目前DH尚无上市制剂,故参照其同系物氟桂利嗪规格每片5 mg,成人1次口服量为5~10 mg,每日15~30 mg,分3次服用的临床用药特点,将其制成每片15 mg的渗透泵控释片。渗透泵制剂能够不受外界渗透压、pH值的影响在一定时间内以恒定的速率释放药物。因此将DH制成渗透泵控释制剂,具有一定的实际意义,更加符合临床用药安全的需求。本研究将DH制成12 h控释的单层芯渗透泵片,并考察了其中药物的释放机制及各因素对药物体外释放度的影响,结果表明DH单层芯渗透泵控释片工艺稳定,符合控释片要求。
1 仪器与试药
DU640型紫外分光光度计(北京普析通用仪器有限责任公司);TDP型单冲式压片机(北京国药龙立科技有限公司);BY300A型小型包衣机(上海黄海药检仪器厂);ZRS-8G智能溶出仪(天津大学无线电厂)。
DH(原料药及对照品,批号:20090113,纯度:99.6%)、DH单层芯渗透泵控释片(规格:每片15 mg)均系自制;乳糖(德国美剂乐集团);甘露醇(石家庄市兴华医药化工厂);水为蒸馏水。
2 方法与结果
2.1 DH单层芯渗透泵控释片的制备
2.1.1 片芯的处方及制备。①处方组成:DH、乳糖、甘露醇、酒石酸、丁二酸。②制备:称取处方量的DH、渗透活性物质(乳糖、甘露醇)、助溶剂(酒石酸、丁二酸)过80目筛,以等量递加法混合均匀,用3%羟丙基甲基纤维素(HPMC)的20%乙醇溶液制软材,过18目筛制粒,50℃干燥12 h,干颗粒以18目筛整粒,加入硬脂酸镁混合均匀后用8 mm深凹冲压得片芯。
2.1.2 包衣液处方及操作。①处方组成:醋酸纤维素(CA)、聚乙二醇(PEG)6000、丙酮。②操作。取致孔剂PEG6000与CA按处方比例溶于丙酮中,50 mL恒温过夜,将“2.1.1”项下制得的片芯置于包衣锅中,包衣增重为3%,包衣后50℃干燥12 h,即得。③包衣工艺:采用小型包衣锅(直径20 cm),包衣锅内温度为35~40℃,包衣锅转速为35 r·min-1,雾化压力为0.2 kg·cm-2,包衣锅倾斜角为45°,喷雾速度为2 mL·min-1。
2.2 体外释放度的测定
2.2.1 辅料干扰试验。称取处方量各辅料置于100 mL容量瓶中,加入一定量水,超声溶解后定容,用0.45 μm微孔滤膜过滤,取续滤液进行适当稀释即得;同法制备DH溶液(与辅料稀释相同倍数)。于200~400 nm波长范围内对2种溶液进行扫描。结果,DH最大吸收波长为227、248 nm,由于辅料在227 nm波长处有吸收,而在248 nm波长处几乎无吸收,故将248 nm定为DH的紫外测定波长。扫描光谱见图1。

图1 紫外扫描光谱A.DH;B.辅料Fig 1 UV scanning spectrum A.dipfluzine hydrochloride;B.excipients
2.2.2 标准曲线的制备及方法回收率和精密度考察[3]。精密称取干燥至恒重的DH 20 mg置于100 mL容量瓶中,加入适量水,超声使溶解,稀释至刻度,摇匀。分别吸取1、2、3、4、5、6、7 mL置于50 mL容量瓶中以水稀释至刻度,摇匀,作为系列标准溶液。以水为空白对照,在248 nm波长处分别测定吸光度(A),以A对浓度(c)进行线性回归,得回归方程为A=26.74c-0.002 3(r=0.999 6,n=3),表明DH检测浓度线性范围为4~28 μg·mL-1。制备高、中、低3个浓度的DH溶液,同比例加入相应的辅料。按回收率和精密度试验相关方法进行操作,计算得平均回收率为98.93%(RSD=0.37%,n=6);日内RSD=0.36%,日间RSD=0.48%(n=5)。
2.2.3 释放度测定方法。依照《中国药典》2010版二部附录ⅩC释放度测定法第二法装置[4],以500 mL水为释放介质,转速50 r·min-1,释放介质温度为(37.5±0.5)℃,分别于1、2、4、6、8、10、12 h取液5 mL(同时补充等体积同温释放介质),0.45 μm微孔滤膜过滤,取续滤液作为供试溶液,在248 nm波长处测定吸光度,计算不同时间点累积释药百分率。
2.2.4 药物释放曲线拟合-相似因子法[5]。缓控释制剂释放曲线的比较,可以反映同一制剂处方设计、制备、包衣工艺以及释放条件等因素对制剂释药行为的影响差异。本研究采用美国食品与药物管理局推荐使用的相似因子(f2)法,计算公式如下:

式中,Rt和Tt分别是2种处方制剂在相同释放条件下或同一处方制剂在不同释放条件下于t时间的释放度;n是取样点的总数;wt是根据实际需要选择的权重系数(本试验wt=1)。f2的计算结果不大于100。当2条曲线完全吻合时f2值为100;当2条曲线差异增大时,f2值减小。本试验规定其值在60~100之间时可以认为2种处方制剂在同一释药条件下或同一制剂在不同释药条件中释药行为无差别。
2.3 影响释药因素的考察及处方确定
在进行影响因素考察前首先进行了大量的单因素试验,其中包括片芯中助溶剂种类和用量的选择、包衣膜中致孔剂的种类和用量、包衣增重。考察的助溶剂种类包括:柠檬酸、富马酸、酒石酸、丁二酸,其中柠檬酸在压片过程中易导致黏冲,富马酸在药物吸收波长处有干扰吸收,故选择酒石酸和丁二酸作为助溶剂并考察其对释药的影响;致孔剂的种类包括PEG400、PEG1000、PEG6000,由于PEG6000分子量较大,与CA混合有一定的增塑剂的作用,降低了CA膜的脆性,故选择PEG6000作为致孔剂并考察其用量对释药的影响;单因素试验中考察了不同包衣增重对药物释放的影响,发现其对药物释放有显著影响,故将其作为影响因素进行考察。
综上,影响药物释放的主要因素包括:片芯中助溶剂的种类、致孔剂用量、包衣增重,以下分别考察各因素对药物释放的影响。
2.3.1 片芯中助溶剂的种类。由于DH在酸性条件下溶解度较大,并且处方前研究发现其受氯离子的同离子效应影响,在氯离子存在的条件下溶解度降低,故本试验采用酒石酸和丁二酸(酒石酸-丁二酸=65∶130)作为药物的助溶剂填加于药物的片芯中,固定助溶剂的用量(185 mg)为片芯重量(300 mg)的61.7%,考察2种小分子有机酸对药物释放的影响,结果见图2。

图2 助溶剂种类对药物释放的影响Fig 2 The influence of different adjuvants on drug release profile
由图2可以看出,单独使用丁二酸时药物释放速度平稳,将释放曲线进行零级拟合发现其零级特征明显,但释药不完全,12 h的累积释药百分率仅为60%;另发现药物释放情况与丁二酸在片芯中的用量比例无关。单独使用酒石酸时药物在12 h的累积释药百分率可达90%以上,将释药曲线进行零级释药模型拟合发现其零级释药特征不如酒石酸和丁二酸的混合物明显。二者联用后药物释放曲线较为理想,故选用二者混合物作为DH的助溶剂添加于片芯中。
采用相似因子法,对3条释药曲线进行两两拟合,f2值均小于60,说明助溶剂的种类对药物释放有显著影响。
2.3.2 致孔剂用量。本试验采用PEG6000为致孔剂,水溶性的PEG6000遇体内消化液即溶解,使得包衣膜上出现微孔以达到释放药物的目的。固定片芯处方以及包衣液处方,使PEG6000的量分别占CA质量的5%、10%、15%,考察PEG6000的用量对药物释放的影响,结果见图3。

图3 PEG 6000用量对药物释放的影响Fig 3 The influence of PEG 6000 amount on drug release
图3结果表明,随着致孔剂用量的增加,药物释放速度加快,当包衣膜中致孔剂用量为5%时,药物释放缓慢,且不完全;当致孔剂用量为15%时,药物释放过快,10 h已释放100%;当包衣膜中致孔剂的用量为10%时,将释药曲线进行释药模型拟合,发现药物释放接近零级释放。
3条释药曲线进行两两拟合后f2均小于60,说明PEG6000的含量对药物释放有显著影响。
2.3.3 包衣增重对药物释放的影响。包衣膜的厚度以片芯增重的百分比来衡量,固定片芯处方以及包衣液处方保持不变,使包衣增重分别为2%、3%、4%,考察包衣增重对药物释放的影响,结果见图4。

图4 包衣增重对药物释放的影响Fig 4 The influence of membrane weight on drug release
图4结果表明,当包衣增重增大时,药物释放速度减慢,说明可以通过调节包衣膜厚度调节药物释放速率,最终确定包衣增重为3%。
通过3条释药曲线两两比较可知,3条释药曲线差异较大,f2值均小于60,表明包衣增重对药物释放有显著影响。
2.3.4 处方的确定及验证。综合上述试验及前期试验结果确定片芯的处方:DH 15 mg,乳糖50 mg,甘露醇50 mg,酒石酸65 mg,丁二酸130 mg。包衣液处方:CA 3 g,PEG6000 0.3 g,丙酮100 mL。
对上述处方进行最佳处方验证,按优化后的处方所制片剂在1~12 h内释药速率基本恒定,对释药曲线进行零级释药模型拟合,其r=0.996 3,呈现良好的零级释放特征。
2.3.5 不同释放介质对药物释放的影响。渗透泵片主要是依赖包衣膜内外的渗透压差实现药物释放的,不受外界环境的影响,本试验考察了渗透泵片在3种不同释放介质(pH1.2盐酸溶液、pH6.8磷酸盐缓冲液及水)中的释放行为。结果表明药物在3种介质中的释放行为基本一致,3条曲线f2值均大于60,表明药物的释放不受外界环境的影响,详见图5。
2.4 药物释放机制的考察
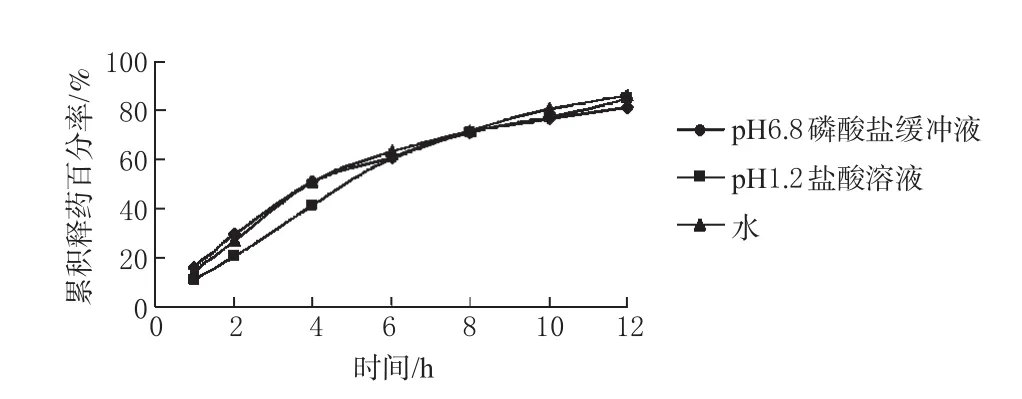
图5 不同释放介质对药物释放的影响Fig 5 The influence of different medium on drug release
制备单层芯渗透泵控释片时在其包衣液中加入水溶性致孔剂的目的是使制剂在胃肠道内遇水溶解形成微孔,使药物通过微孔得以释放。通过下面的试验验证药物是否通过此途径释放。
分别制备2种渗透泵片,一种为包衣膜中含处方量致孔剂PEG6000,测定药物的累积释药百分率及片芯内部的渗透压值;另一种不含致孔剂,测定其累积释药百分率。分别考察2种片剂的释药情况。结果,含致孔剂的片剂在2、4、6、8、10、12 h时的渗透压值分别为 1.496、1.411、1.297、1.277、1.207、0.925 Osm,释药曲线见图6。
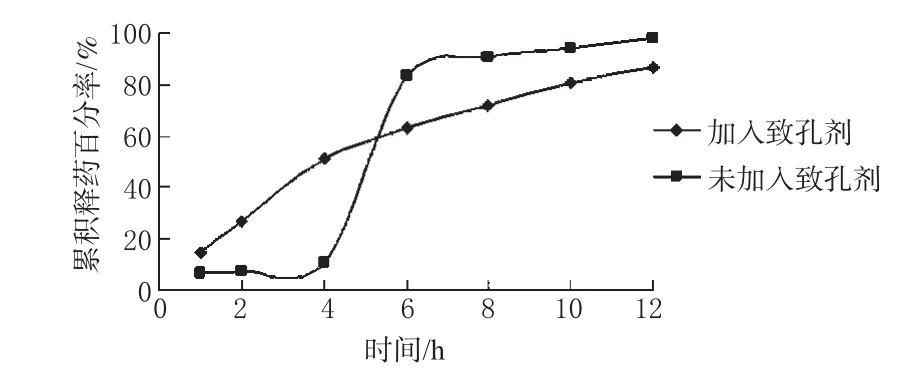
图6 致孔剂的加入对药物释放的影响Fig 6 The influence of porosity-making agent on drug release
由图6可知,包衣膜中不含致孔剂的控释片在4 h内没有释放,在4 h后由于片芯内部渗透压过大使得包衣膜破裂,药物很快释放出来;而包衣膜中含有致孔剂的渗透泵片药物释放速度恒定,且在药物释放过程中,片芯内部的渗透压值变化不大,能保持渗透压差,从而实现药物的释放呈现零级释药特征。通过以上对比说明本渗透泵片中药物的释放是通过致孔剂遇水后溶解在包衣膜上形成小孔,使药物通过微孔得以释放。
依照最佳处方制备DH单层芯渗透泵控释片3批,进行释放度测定,对所得释放曲线进行零级、一级和Higuchi方程模型拟合,结果药物释放行为最符合零级方程(r=0.995 2),详见表1(表中Y为累积释药百分率,t为时间)。

表1 体外释放模型拟合结果Tab 1 Fitting of drug release model in vitro
3 讨论
(1)制备微孔渗透泵片时首先要考虑的是药物的溶解度问题,所以在药物的处方前研究阶段,首先测定了DH在不同介质中的溶解度,发现其虽在酸性条件下溶解度增加,但在盐酸溶液中的溶解度比在水中相对低,说明同离子效应使得其溶解度降低了。故考虑在片芯中加入小分子有机酸,以提高其溶解度并避免氯离子抑制效应。本试验采用了酒石酸-丁二,、酸共同作为助溶剂。由于渗透泵片中药物的释放是依赖渗透压差实现的,所以片芯中还应加入一定量的渗透活性物质,本试验采用乳糖-甘露醇作为渗透活性物质。
(2)CA常用作渗透泵片的包衣材料,因其具有半透膜性质,只能允许水通过,而药物分子不能通过,包衣材料中加入水溶性致孔剂,遇水溶解形成微孔,可使药物分子通过这些微孔得以释放。
(3)渗透泵控释片中药物的释放是依赖包衣膜内外的渗透压差决定的,所以能够在一定时间内以恒速释放药物,本试验制备的渗透泵控释片释药速度恒定,在pH6.8磷酸盐缓冲液、pH1.2盐酸溶液、水3种不同溶出介质中药物释放行为无明显差别。
[1] 白 剑,王永利.双苯氟嗪对沙土鼠急性脑缺血性脑水肿的影响[J].中华医学杂志,2002,82(16):1 130.
[2] 齐亚娟,贾庆忠,王永利,等.双苯氟嗪小鼠急性毒性及体内致突变毒性评价[J].河北医科大学学报,2004,25(5):257.
[3] 陈汝红,郭 毅,刘铁钢,等.紫外分光光度法测定双苯氟嗪片的含量、含量均匀度及溶出度[J].中国新药杂志,2008,17(15):1 139.
[4] 国家药典委员会编.中华人民共和国药典(二部)[S].2010年版.北京:中国医药科技出版社,2010:附录ⅩC.
[5] 韩翠艳,徐 楠,盛长江.乌拉地尔渗透泵片的制备[J].中国药房,2008,19(22):1 171.
