奶牛不同发育时期乳腺组织LAT1和4F2hc的表达
2011-01-08冯丽丽林叶李庆章
冯丽丽,林叶,李庆章
(东北农业大学乳品科学教育部重点实验室,哈尔滨 150030)
奶牛不同发育时期乳腺组织LAT1和4F2hc的表达
冯丽丽,林叶,李庆章
(东北农业大学乳品科学教育部重点实验室,哈尔滨 150030)
为研究氨基酸转运载体LAT1的表达与奶牛乳腺发育的关系,应用免疫荧光技术和免疫印迹方法,检测奶牛乳腺组织中LAT1及其辅助蛋白4F2hc表达的情况。结果表明,LAT1和4F2hc共表达于乳腺导管或腺泡的基底侧和顶膜侧;且泌乳期LAT1蛋白表达显著高于其他发育时期,4F2hc蛋白表达量在围产前期达到峰值,泌乳期4F2hc蛋白的表达量恢复至妊娠中期水平。结论:LAT1及4F2hc均特异性表达于不同发育时期奶牛乳腺组织中,提示LAT1参与了奶牛乳腺的发育和泌乳的调控。
奶牛;乳腺;LAT1;4F2hc
0 引言
哺乳动物细胞摄取的氨基酸需经多种氨基酸转运载体介导[1],LAT1是L型氨基酸转运载体家族成员之一[2,3],它是Na+非依赖型转运载体,主要负责转运疏水中性氨基酸。LAT1转运功能的表达需要II型跨膜重链蛋白4F2hc的参与,它们在细胞膜上形成1个异二聚体[4]。在脑、肠、胎盘、睾丸和肿瘤细胞系等组织和细胞中都检测到LAT1的表达[5-9]。奶牛乳腺是乳汁合成和分泌的器官,但是关于乳腺发育不同阶段LAT1表达变化的研究却鲜有报道。
本研究以奶牛为实验对象,运用免疫印迹和免疫荧光的方法,研究奶牛不同发育阶段乳腺中LAT1及4F2hc的表达情况,旨在揭示LAT1蛋白表达与奶牛乳腺发育与泌乳之间的关系,为探讨乳腺发育提供基础资料,为提高乳蛋白量奠定实验基础。
1 实验
1.1 动物及取材
本研究选用36头检测无乳腺炎及其他疾病的荷斯坦奶牛作为实验动物。
根据实验需要采样时间分为:青春期(12月、14月);妊娠期(2月、4月、6月);围产前期(分娩前7日);泌乳期(7日、50日、140日、280日);干乳期(3日、30日),共4组12个时间点,每个采样时间点选取3头奶牛做平行实验,每次试验至少重复3次。饲养到预定取样时间点,乳房中部消毒,按常规手术切取少量乳腺组织块,获取组织样本。乳腺组织30 min内液氮速冻,保存于-80℃低温冰箱备用。
1.2 试剂
兔抗LAT1多克隆抗体,鼠抗CD98单克隆抗体,鼠抗β-actin抗体,HRP标记的山羊抗兔IgG,HRP标记的鸡抗鼠IgG,FITC-标记鸡抗兔IgG和TRITC-标记羊抗鼠IgG,BCA蛋白浓度测定试剂盒,ECL超敏化学发光液,其他试剂为国产分析纯试剂。
1.3 方法
1.3.1 蛋白提取及免疫印迹分析
将乳腺组织加入裂解液(浓度为50 mmol/L的Tris(pH值为7.4),浓度为150 mmol/L的NaCl,浓度为1 mmol/L的EDTA,体积分数为1%的TritonX-100,质量分数为1%的去氧胆酸钠,质量分数为0.1%的SDS,质量分数为0.5%的NP40,浓度为1 mmol/L的PMSF)中,冰上机械匀浆。匀浆液10 000 g,4℃,离心5 min,取上清,即为总蛋白。BCA蛋白浓度测定试剂盒测定蛋白浓度,依说明书操作。
蛋白样品调至等浓度与2×上样缓冲液1︰1混合,95℃,煮沸5 min,上样,40 μg/孔。8%SDS聚丙烯酰胺凝胶电泳(SDS-PAGE)进行分离,采用半干转移电泳法将蛋白转到硝酸纤维素膜(NC,Bio-Rad)上。将NC膜用质量浓度为50 g/L脱脂乳的TBST(浓度为50 mmol/L的Tris(pH值为8.0),质量分数为0.9%的NaCl,体积分数为0.05%的Tween20)缓冲液室温封闭1 h,一抗4℃孵育过夜。其中兔抗LAT1多克隆抗体1︰500稀释、鼠抗CD98单克隆抗体1︰500稀释、β-actin抗体1︰500稀释。TBST缓冲液洗膜3次,每次10 min,HRP-山羊抗兔IgG(1︰5 000),HRP-鸡抗鼠IgG(1︰5 000)的二抗室温孵育1.5 h,洗膜后用ECL超敏发光液示踪。
1.3.2 数据分析
应用SPSS13.0统计软件进行方差分析,所有试验重复3次。定量数据以平均数(M)±标准差(SE)表示。3组间均数比较采用单因素方差分析,两两组间多重比较采用Duncan检验。P<0.05为统计学差异有显著性。
1.3.3 免疫荧光组织化学
乳腺组织样本离体后迅速制备冰冻切片,切片厚度为8 μm。冰冻切片置于4℃预冷的丙酮中固定10 min,PBS缓冲液(pH值为7.2)漂洗3次,质量分数为10%的正常羊血清室温封闭1h,加入工作浓度的兔抗LAT1抗体(1︰50)和鼠抗CD98抗体(1︰50),4℃共孵育过夜,PBS缓冲液漂洗后,滴加FITC标记的鸡抗兔IgG(1︰100)和TRITC标记羊抗鼠IgG(1︰100)室温避光共孵育1 h,PBS缓冲液再次漂洗,DAPI(质量分数为10 mg/L)避光复染10 min,漂洗后,封片。实验中用PBS代替一抗作为阴性对照。采用激光共聚焦显微镜对染色结果进行观察。
2 结果
2.1 不同发育阶段的相对表达量变化
图1为奶牛乳腺不同发育时期LAT1和4F2hc蛋白的免疫印迹分析结果。图1中,从左至右依次为:青春期12月和14月;妊娠期2月、4月、6月;围产前期;泌乳期7日、50日、140日、280日;干乳期3日和30日;β-actin为内参蛋白。
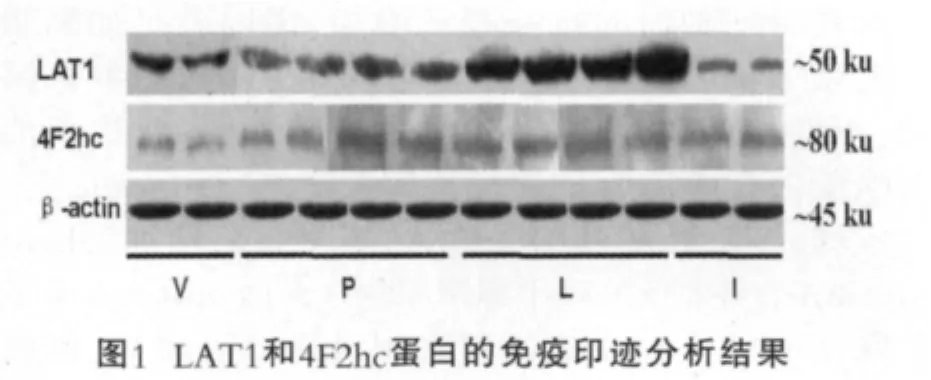
图2为奶牛乳腺不同发育时期LAT1和4F2hc蛋白的相对表达量。图2中,横坐标从左至右依次为:青春期12月和14月;妊娠期2月、4月、6月;围产前期;泌乳期7日、50日、140日、280日;干乳期3日和30日。图中无相同字母者表示乳腺不同发育时期差异显著(P<0.05),有相同字母者为差异不显著(P>0.05)。
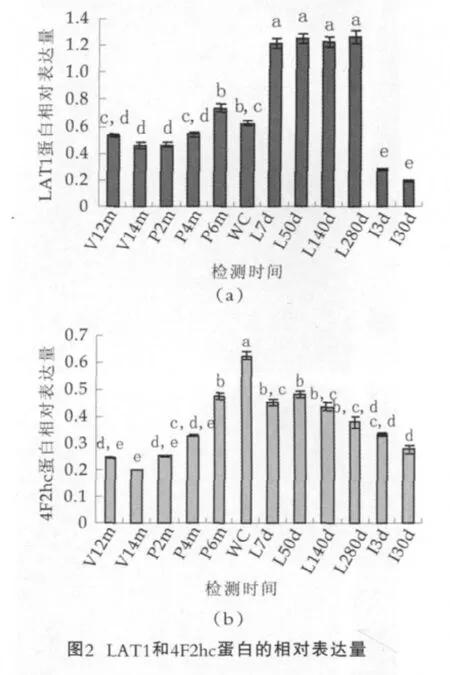
LAT1和4F2hc抗体在发育不同阶段均分别识别了相对分子质量大约50 ku和80 ku的蛋白条带(图1),表明LAT1和4F2hc蛋白在奶牛乳腺发育不同时期均有表达。采用光密度扫描方法得到奶牛乳腺不同发育时期LAT1和4F2hc表达的光密度值,并对其进行方差分析,结果如图2所示。青春期、妊娠期和泌乳期LAT1的表达丰度整体呈递增趋势,干乳期急速下降,与其它发育阶段相比泌乳期LAT1表达丰度最高,且显著(P<0.05)高于青春期、妊娠期、退化期,退化期显著低于其它时期(P<0.05),青春期和妊娠期整体水平差异不显著(P>0.05)。4F2hc蛋白的表达水平从青春期到妊娠期逐渐增加,围产前期表达量达到峰值(P<0.05),进入泌乳期4F2hc蛋白的表达量恢复至妊娠中期水平(P>0.05),干乳初期与泌乳期4F2hc表达量无显著变化(P>0.05)。
2.2 不同发育阶段的表达部位变化
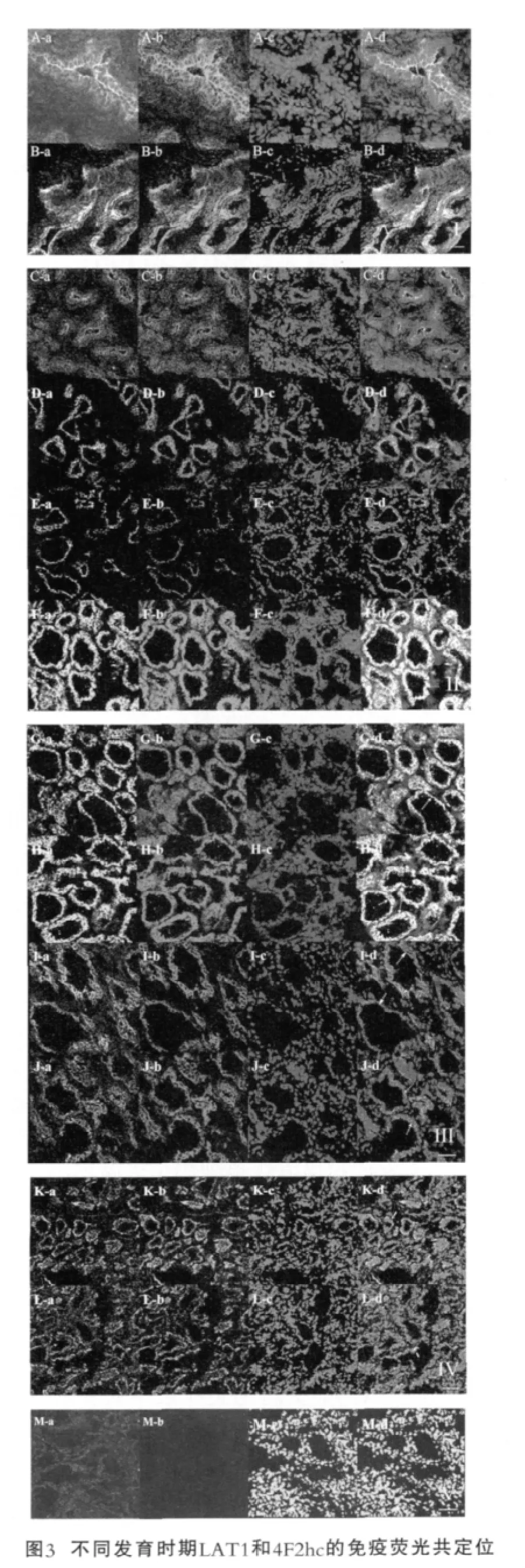
图3为奶牛乳腺不同发育时期LAT1和4F2hc的免疫荧光共定位。图3中,每张切片随机选择包含有完整导管或腺泡结构的视野进行观察,LAT1为绿色荧光(a),4F2hc为红色荧光(b),细胞核为DAPI复染蓝色荧光(c),两者重叠为黄色或红绿相间荧光(d)。A和B分别为青春期12月、14月;C~F分别为妊娠期2月、4月、6月,围产前(7日);G~J分别为泌乳7日、50日、140日、280日;K和L分别为干乳期3日和30日。M为PBS代替一抗作为阴性对照的免疫荧光结果,比例尺为75 μm。
图3(I)~图3(V)分别为青春期、妊娠期、泌乳期、干乳期、阴性对照的免疫荧光观察结果。LAT1和4F2hc的免疫荧光染色主要沿着乳腺腺泡上皮细胞膜和导管的上皮细胞膜,且相对均一地分布在基底外侧膜和顶膜上。
青春期腺泡上皮细胞很少,导管系统发达,LAT1和4F2hc的荧光染色主要沿着单层的小叶内导管(图3A,B中箭头);妊娠期小叶内腺泡增多,腺泡芽逐渐发育成腺泡腔,LAT1和4F2hc的特异性荧光染色主要分布在导管上皮细胞和腺泡上皮细胞顶膜上,展示一个集中的线状分布(图3C~F中箭头);围产前期顶膜和基底侧均出现强烈的荧光染色(图3F);进入泌乳期,乳腺腺泡布满乳腺内,LAT1和4F2hc的荧光染色围绕整个腺泡,在基底侧和顶膜均有分布(图3G~J中箭头);干乳期乳腺腺泡逐渐退化,由于细胞凋亡的影响,乳腺腺泡上皮细胞排列杂乱无序且逐步减少,LAT1和4F2hc主要在基底侧或围绕退化的腺泡上皮细胞表达(图3K和L中箭头)。
3 讨论
LAT1是L型氨基酸转运系统的成员之一,它是一个Na+非依赖性氨基酸转运体,主要负责转运疏水大分子中性氨基酸,包括支链和芳香族氨基酸,如亮氨酸、异亮氨酸、缬氨酸、苯丙氨酸、色氨酸、组氨酸、蛋氨酸等[4,9]。牛的LAT1(SLC7A5)由SLC7A5基因编码,其基因定位于牛的18号染色体,是具有12次跨膜域的膜蛋白,由505个氨基酸残基组成,相对分子质量大约为54 980 u。为阐明氨基酸转运体LAT1表达在奶牛乳腺发育中的意义,本实验通过免疫荧光和免疫印迹(Westen blotting)的方法,研究了奶牛不同发育阶段乳腺组织中性氨基酸转运蛋白LAT1及其辅助蛋白4F2hc的表达情况。结果显示,LAT1在奶牛乳腺发育的不同时期均有表达,但不同发育阶段表达变化并不一致,揭示了LAT1蛋白参与了成年奶牛乳腺发育和泌乳的调控。本研究所得LAT1蛋白条带分子量大小与预期略有差异,差异的产生可能与不同mRNA转录后调控或转录后修饰的不同、LAT1蛋白的糖蛋白特性、使用不同的细胞裂解液和SDS-PAGE上样缓冲液有关。
乳腺从血液中摄取的氨基酸大部分用于合成乳蛋白,而不参与乳腺结构蛋白的构建[10]。泌乳期被摄取进入乳腺细胞内的氨基酸量增加,用以满足如酪蛋白等乳蛋白的合成[11-12]。本研究结果显示,奶牛在泌乳期,中性氨基酸转运体LAT1表达显著增加,这可能与细胞蛋白合成需要量的程度相关[13-14]。Finucane等[15]研究发现,牛泌乳期乳腺SLC7A5基因表达增加,Shennan和Gabriela等[16,17]在对小鼠乳腺中LAT1 mRNA定量时发现,LAT1 mRNA表达量在泌乳期显著增高,妊娠期与青春期表达量无显著差异。Rudolph等[18]在大鼠乳腺的研究中也发现,LAT1表达在泌乳期比妊娠期高,这些mRNA水平的定量结果与本研究对LAT1蛋白水平的定量结果基本一致。此外,Gabriela等[17]研究还显示,与青春期鼠相比,阳离子氨基酸转运体CAT1 mRNA丰度也在泌乳期间增加,与LAT1 mRNA表达趋势平行。这可能部分解释为,乳腺组织中大分子中性氨基酸与阳离子转运体之间有某种相互作用,如LAT1的底物亮氨酸能刺激赖氨酸的流出等[19]。
泌乳期乳腺细胞在激素的刺激下增殖、分化,腺管腺泡发育,用于合成乳蛋白,LAT1作为可诱导型细胞膜蛋白,它能被激素、细胞因子等具有生物活性的分子诱导。激素含量大大增加的泌乳期,乳蛋白合成量增加,LAT1表达量也显著上调,而非泌乳期相应的各种激素含量降低,乳蛋白量合成减少,LAT1表达也随之下降。由于增加血液中胰岛素的含量可降低血液中支链氨基酸的含量,提高乳蛋白的产量,Karensa等[20]通过用胰岛素处理体外培养乳腺细胞,发现SLC7A5基因表达量也增加,说明乳蛋白合成量与SLC7A5基因表达量之间存在某种联系。Bequette等[10]研究也表明,乳腺摄入的氨基酸除直接用于合成乳蛋白外,有一部分氨基酸参与合成其他功能物质、非必需氨基酸和支链氨基酸。在泌乳高峰期支链氨基酸(BCAAs)的氧化作用增加,一些与BCAA分解代谢有关的酶类被诱导以适应乳腺泌乳[21]。已有研究证明,亮氨酸、缬氨酸、异亮氨酸等支链氨基酸在乳腺内可被分解为有机酸、合成非必需氨基酸的碳架以及二氧化碳,更多BCAA的穿梭运动,尤其亮氨酸,增加原处新脂肪酸的合成,蛋氨酸参与磷脂、肉毒碱、肌肉素和多胺及半胱氨酸的合成[22]。这些研究说明,支链氨基酸(尤其是亮氨酸和异亮氨酸)不仅是合成机体蛋白质的原料,而且对蛋白质的合成有促进作用。这些氨基酸转运进入泌乳乳腺,能支配不同乳成分合成底物的进入速率。作为它们进入乳腺的转运媒介——L型氨基酸转运蛋白1(LAT1)在奶产量高需求和乳蛋白积极合成的泌乳期表达丰度显著增加说明LAT1在其中扮演重要角色。
鉴于LAT1介导的氨基酸转运对于蛋白质的合成和细胞的生长、增殖的重要性,有必要对LAT1蛋白活性调节因子进行深入研究。目前,已有实验通过定点突变、放射性氨基酸标记、细胞转染等技术来确定LAT1蛋白在氨基酸转运过程中的作用及结构,从而从根本上了解LAT1蛋白转运氨基酸的机理。至于奶牛乳腺发育过程中LAT1的功能调节尚待进一步研究,LAT1是否是第一性的氨基酸转运体也有待进一步确定。
[1]HEDIGER M A,ROMERO M F,PENG J B,etal.The ABCs of Solute Carriers:Physicological,Pathological and Therapeutic Implications of Human Membrane Transport Protein Induction[J].Pflugers. Arch,2004,447:465-468.
[2]VERREY F.System L:Heteromeric Exchang ers of Large,Neutral Amino Acids Involved in Directional Transport[J].Pflugers Arch,2003,445:529-533.
[3]BODOY S,MARTIN L,ZORZANO A,et al.Identification of LAT4,a Novel Amino Aacid Transporter with System L Activity[J].J Biol Chem,2005,280:12002-12011.
[4]KANAI Y,SEGAWA H,MIYAMOTO K,et al.Expression Cloning and Characterization of a Transporter for Large Neutral Amino Acids Activated by the Heavy Change of 4F2 Antigen(CD98)[J].J Biol Chem,1998,273:23629-23632.
[5]RAMAMOORTHY S,LEIBACH F H,MAHESH V B,et al.Modulation of the Activity of Amino Acid Transport System L Byphorbol Esters and Calmodulin Antagonists in a Human Placental Choriocarcinoma Cell Line[J].Biochim Biophys Acta,1992,1136:181-188.
[6]YANAGIDA O,KANAI Y,CHAIROUNGDUA A et al.Human L-type Amino Acid Transporter 1(LAT1):Characterization of Function and Expression in Tumor Cell Lines[J].Biochim Biophys Acta,2001,1514:291-302.
[7]CHIKARA O,YOHKO N,TAKU H,et al.Significance of System L Amino Acid Transporter 1(LAT-1)and 4F2 Heavy Chain(4F2hc) Expression in Human Developing[J].Intestines.Acta Histochem.Cytochem,2009,42(3):73-81.
[8]ROSSIER G,MEIER C,BAUCH C,et al.LAT2,a New Basolateral 4F2hc/CD98-associated Amino Acid Transporter of Kidney and Intestine[J].J Biol Chem,1999,274:34948-34954.
[9]KYUNG K O,JIN PARK,JEONG S J,et al.Differential Expression of System L Amino Acid Transporters during Wound Healing Process in the Skin of Young and Old Rats[J].Biol Pharm Bull,2008,31(3) 395-399.
[10]BEQUETTE B J,BACKWELL F R C,CROMPTON L A.Current Concepts of Amino Acid and Protein Metabolism in the Mammary Gland of the Lactating Ruminant[J].Journal of Dairy Science,1998,(81):2540-2559.
[11]VINA J R,PUERTES I R,MONTORO J B,et al.Effect of Starvation and Refeeding on Amino Acid Uptake by Mammary Gland of the Lactating Rat[J].Role of Ketonebodies.Biochem J,1983:216:343-347.
[12]GUAN X,PETTIGREW J E,KU P K,et al.Dietary Protein Concent Ration Affects Plasma Arteriovenous Difference of Amino Acids across the Porcine Mammary Gland[J].J Anim Sci,2004,82:2953-2963.
[13]CHRISTENSEN H N.Role of Amino Acid Transport and Counter Transport Innutrition and Metabolism[J].Physiol.Rev,1990,70:43-77.
[14]SEGAWA H,FUKASAWA Y,MIYAMOTO K,et al.Identification and Functional Characterization of a Na+-independent Neutral Amino Acid Transporter with Broad Substrate Selectivity[J].J Biol Chem,1999,274:19745-19751.
[15]FINUCANE K A,MCFADDEN T B,BOND J P,et al.On Set of Lactation in the Bovine Mammary Gland:Gene Expression Profiling Indicates a Strong Inhibition of Gene Expression in Cell Proliferation [J].Funct Integr Genomics,2008,8(3):251-264.
[16]SHENNANDB,CALVERTDT, TRAVERS M T,et al.A Study of L-leucine,L-phenylalanine and L-alanine Transport in the Perfuse Drat Mammary Gland:Possible Involvement of LAT1 and LAT2[J].Biochim Biophys Acta,2002,1564:133-139.
[17]GABRIELA A,ADRIANA L,GUILLERMO O,et al.Changes in Messenger RNA Abundance of Amino Acid Transporters in Rat Mammary Gland during Pregnancy,Lactation,and Weaning[J].Met abolism Clinical and Experimental,2009,58:594-601.
[18]RUDOLPH M C,MANAMAN J L,PHAN T,et al.Metabolic Regulation in the Lactating Mammary Gland:Alipid Synthesizing Machine[J].Physiol Genomics,2007,28:323-336.
[19]SHENNAN D B,MC NEILLIE S A,JAMIESON E A,et al.Lysine Transport in Lactating Rat Mammary Tissue:Evidence for an Interaction between Cationic and Neutral Amino Acids[J].Acta Physiol Scand,1994,151:461-466.
[20]KARENSA K M,CHRISTOPHE L,KEITH L M,et al.Nichol as Insulin Regulates Milk Protein Synthesis at Multiplel Evels in the Bovine Mammary Gland[J].Funct Integr Genomics,2009,9:197-217.
[21]DESANTIGO S,TORRES N,SURYAWAN A,et al.Regulation of Branched-Chain Amino Acid Metabolism in the Lactating rat[J].J Nutr,1998,128:1165-1171.
[22]BEQUETTE B J,HANIGAN M D,LAPIERRE H.Mammary Uptake and Metabolism of Amino Acids by Lactating Ruminants[J]. Amino Acids in Animal Nutrition,2003,(2nded.):347-365.
Expression of LAT1 and 4F2hc at different developmental stages in dairy cow mammary gland
FENG Li-li,LIN Ye,LI Qing-zhang
(The Key Laboratory of Dairy Science of Ministry of Education,Northeast Agricultural University,Harbin 150030,China)
To explore the relationship between expression of amino acid transporter LAT1 and development of dairy cow mammary gland,expression of LAT1 and auxiliary protein 4F2hc were detected using immune fluorescent technology and Western blotting method.Results showed that LAT1 and 4F2hc were co-expression in the basement membrane and the top side of mammary ductal or gland bubble epithelial cells;and LAT1 protein expression significantly increased at lactation than other development periods,then 4F2hc protein expression level was up to peak at perinatal,and lactation recovered to the middle of pregnant.Conclusion:LAT1 and 4F2hc were specific expression in different development stages of dairy cow mammary gland,indicated LAT1 played role in the development of mammary gland and regulation of lactation.
dairy cow;mammary gland;LAT1;4F2hc
TS252.1
A
1001-2230(2011)04-0004-04
2010-11-10
国家重点基础研究发展计划(973计划)(2011CB100804);东北农业大学创新团队项目(CXT005-1-1)。
冯丽丽(1984-),女,硕士研究生,研究方向为乳腺发育与泌乳功能调控。
李庆章
