基于厚壳贻贝Mytilin-1的抗菌肽设计、固相合成及抗菌谱分析
2010-10-16刘梅武梅周世权高鹏鲁涛王日昕石戈廖智
刘梅,武梅,周世权,高鹏,鲁涛,王日昕,石戈,廖智
1 浙江海洋学院海洋科学学院 海洋生物资源及分子工程实验室,舟山 316000 2 舟山医院-中科院北京基因组研究所免疫基因组学联合实验室,舟山 316004
基于厚壳贻贝Mytilin-1的抗菌肽设计、固相合成及抗菌谱分析
刘梅1,武梅1,周世权2,高鹏1,鲁涛1,王日昕1,石戈1,廖智1
1 浙江海洋学院海洋科学学院 海洋生物资源及分子工程实验室,舟山 316000 2 舟山医院-中科院北京基因组研究所免疫基因组学联合实验室,舟山 316004
贻贝抗菌肽Mytilin是贻贝免疫系统的重要组成部分,对其结构与功能的研究表明,其序列中连接两段β-折叠的发夹区域是其抗菌功能的关键所在。为验证该区域是否具有抗菌活性,通过对厚壳贻贝Mytilus coruscus抗菌肽Mytilin进行空间结构模拟,选取其中 β-发夹部分肽段,采用了固相化学合成的方法合成了两条 10肽,分别命名为 Mytilin Derived Peptide-1(MDP-1)和 Mytilin Derived Peptide-2(MDP-2)。高效液相色谱以及质谱检测结果表明,合成是成功的。抗菌谱研究表明,MDP-1和MDP-2 对革兰氏阳性菌、阴性菌以及真菌均具有明显的抑制作用,同时,合成的MDP由于序列短且有两对二硫键,因此对于温度及人血浆均表现出很强的稳定性。上述研究结果为深入了解厚壳贻贝抗菌肽Mytilin的抗菌机制以及在此基础上开发具有应用价值的新型抗菌肽奠定了基础。
Mytilin,MDP,固相化学合成,抗菌谱
Abstract:As a key role in mussel defense system, Mytilin is an important antibacterial peptide isolated from the mussel serum.The structural and functional researches on Mytilin showed that the fragment connecting two β-sheets in a stable β-hairpin structure was probably required for antimicrobial activity.To elucidate the structural features and the antimicrobial activity of this fragment,we re-designed and synthesized two peptides corresponding to the main mimic structures of Mytilin-1 fromMytilus coruscus, we named these two peptides Mytilin Derived Peptide-1 and Mytilin Derived Peptide-2, respectively.Using a liquid growth inhibition assay, we evaluated their activity towards Gram-positive, Gram-negative bacteria and fungus.The results showed that both peptidescan inhibit the growth of Gram-positive, Gram-negative bacteria and fungus.Besides, these two peptides showed high stability in heat water and human serum.These works laid the foundation for further research on the molecular mechanism of Mytilin and for further exploitation of antibacterial peptides with lower molecular mass and more stable structure.
Keywords:Mytilin, Mytilin derived peptide(MDP), solid-phase synthesis, antimicrobial activity
贻贝抗菌肽是海洋生物抗菌肽研究中的一个重要内容,其特殊的结构与高效的抗菌功能使其具有重要的理论研究价值,同时也具有开发成为新型生物抗生素的潜力[1]。Mytilin是贻贝抗菌肽家族中的一类重要成员,目前已从不同种的贻贝中分离纯化到 5种 Mytilin分子,分别为 MytilinA、B、C、D和 G1[2-3],是目前贻贝抗菌肽研究中发现成员最多的家族。鉴于其在贻贝血清中的高丰度以及在体外抗菌实验中表现出的高效抗菌功能,Mytilin被认为是贻贝防御机制中最重要的一类抗菌肽分子[4]。
抗菌肽的抗菌功能与其空间结构具有密切关系,因此,针对抗菌肽的结构研究一直受到人们的关注,也是深入了解抗菌肽结构与功能的关系及其抗菌机制的关键所在。Roch等最近对来自地中海贻贝Mytilus galloprovincialis的Mytilin B进行了核磁共振研究[5],结果表明,Mytilin B的结构属于典型的二硫键稳定的 α/β 结构(Cysteine-stabilized-α/β),分子中包含有一段α-螺旋和两段β-折叠片,由4对二硫键稳定整个结构。该结构类型既不属于抗菌肽常见的α-螺旋结构,也不属于单纯β-折叠型抗菌肽结构,是一类比较特殊的空间结构,且该结构类似于Yang等早期解析的贻贝防御素MGD-1的空间结构[6]。而通过对 MGD-1的结构与功能的研究,Romestand等认为由两段 β-折叠片及连接这两段 β-折叠片的环(Loop)上的带正电荷的氨基酸残基是贻贝抗菌肽发挥抗菌活性的关键部位[7]。
厚壳贻贝Mytilus coruscus是我国具有重要经济价值的养殖贻贝之一,在前期的研究中,本研究室已从厚壳贻贝血清中分离纯化到一种Mytilin,命名为 Mytilin-1(GenBank Accession No.FJ973154),该抗菌肽分子量为3885.3 Da,含34个氨基酸残基,其中包括8个半胱氨酸并形成4对二硫键。体外抗菌实验中,Mytilin-1对滕黄叠球菌Sarcina luteus及大肠杆菌Escherichia coli均具有明显的抑制作用[8]。为进一步了解厚壳贻贝Mytilin-1的结构与功能的关系,鉴于厚壳贻贝Mytilin-1与地中海贻贝的Mytilin B具有较高的序列相似性(64%),本实验以地中海贻贝Mytilin B(PDB编号:2EEM)为模板,对厚壳贻贝Mytilin-1进行了空间结构模拟。根据结构模拟结果发现,厚壳贻贝Mytilin-1同样具有两段β-折叠片及连接这两段β-折叠片的环(Loop),且环上分布有碱性氨基酸残基(Arg),为验证该区域是否为Mytilin-1的活性位点,根据该部位的氨基酸序列和结构特点,人工设计并合成了两条新的多肽,分别命名为Mytilin Derived Peptide-1(MDP-1)和Mytilin Derived Peptide-2(MDP-2),并对其抗菌谱做了分析。上述研究为深入了解厚壳贻贝抗菌肽 Mytilin的结构与功能的关系,以及在此基础上进行新型抗菌肽分子的设计和改造奠定了基础。
1 材料与方法
1.1 材料
9-芴甲氧羰基(Fmoc)氨基酸、侧链保护基 Cys(Acm)、Cys(Trt)、二氯甲烷(DCM)、二异丙基乙胺(DIEA)、1-羟基-苯并-三氮唑(HOBt)、1-氧-3-双二甲胺羰基苯骈三氮唑四氟化硼盐(TBTU)、N,N-二甲基甲酰胺(DMF)为上海吉尔公司的产品。N-甲基吗啉(NMM)、哌啶(Piperidine)、Fmoc-Rink-AM-Resin 树脂、三氟乙酸(TFA)、苯并三唑四甲基脲四氟硼酸盐(TBTU)、1-羰基苯并四唑(HOBt)均为Sigma公司产品。乙腈购自美国TEDIA公司。其他试剂均为国产色谱纯试剂。实验用去离子水由 Millipore synergy纯水系统(美国Millipore公司)制取。
1.2 方法
1.2.1 厚壳贻贝Mytilin-1的结构模拟及多肽设计
利用结构模拟软件 ESyPred3D[9],以地中海贻贝Mytilus galloprovincialis的Mytilin B(PDB编号:2EEM)为模板,对厚壳贻贝 Mytilin-1进行空间结构模拟,获得厚壳贻贝Mytilin-1主链的空间结构。根据 Mytilin-1的空间结构,选择 20号丙氨酸(Ala20)到 29号半胱氨酸(Cys29)之间的 10肽片段,将Ala20及Ser22分别替换成Cys,获得一条新的多肽,命名为MDP-1,该多肽的N端设计为乙酰化,C端设计为酰胺化以去除末端电荷,其序列为Ac-Cys-Val-Cys-Phe-Gly-Arg-Arg-Cys-Ile-Cys-NH2;同时,另外设计了一条反向序列,命名为MDP-2,其序列为 Ac-Cys-Ile-Cys-Arg-Arg-Gly-Phe-Cys-Val-Cys-NH2(图1)。
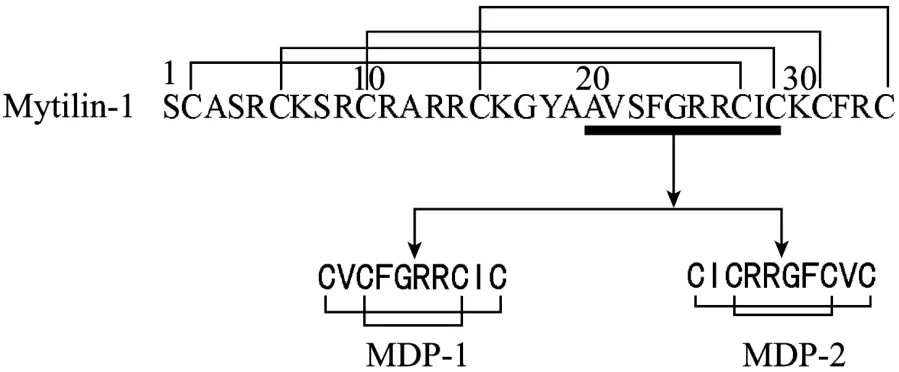
图1 厚壳贻贝Mytilin-1的序列及衍生多肽(MDP-1和MDP-2)的设计Fig.1 Amino acid sequences of Mytilin-1 fromMytilus coruscusand derived peptides based on selected fragments.
1.2.2 MDP-1及MDP-2的固相合成、复性及纯化
应用固相合成法(Solid-phase peptide synthesis,SPPS),利用 Fmoc-Cys(Trt)-OH(Cys1 和Cys4)和 Fmoc-Cys(Acm)-OH(Cys2和 Cys3)的不同性质,分别利用三苯甲基(Trt)和乙酰氨甲基(Acm)保护作为一对要形成二硫键的Cys合成出所需线性多肽,结合分步去保护和复性以便二硫键的正确配对(Cys1-Cys4,Cys2-Cys3)。
多肽合成参照文献[9]的方法在Tetras多肽合成仪(美国 ThuraMed公司)上进行,基本流程为:Fmoc-Rink-AM-Resin树脂以DCM进行充分溶胀;取第1个Fmoc-氨基酸于DCM中溶解,再加入DIEA混合后加入反应容器中,吹N2反应2 h,将反应液过滤除去加入甲醇,封闭反应1 h后分别用DCM、异丙醇及DMF洗涤树脂;之后用20%哌啶脱Fmoc,经 DMF充分洗涤后,加第 2个氨基酸与 HOBt及DIEA混合后进行偶联,反应1 h后,用茚三酮检测,树脂无色透明为反应完全,然后以DMF充分洗涤;重复上述步骤直到最后一个氨基酸反应完全。利用K试剂(K Reagent,含82.5%的TFA,5%的苯酚,5%的苯甲硫醚,以及2.5%的巯基乙醇的水溶液)对合成后的多肽进行侧链去保护以及从树脂上切割。
获得的合成粗品首先在90%TFA中反应2 h,以去除Cys1和Cys4的保护基团Trt,之后利用双氧水进行氧化复性,以确保Cys1和Cys4之间形成二硫键;第一对二硫键形成后的粗品经高效液相色谱纯化并经质谱检测以确定第一对二硫键正确形成,之后分别以碘/甲醇/DMF混合溶液及抗坏血酸进行Cys2和Cys3的保护基团Acm的去除以及复性,以形成第二对二硫键。复性完全后的多肽样品用反相高效液相色谱纯化2次。第一次纯化:Sunfire C18 柱(10 mm×250 mm,Waters),洗脱梯度:0~40 min,5%~30%乙腈(含0.1%TFA);第二次纯化:Vydac C18 柱(4.6 mm×250 mm),洗脱梯度:0~40 min,5%~20%乙腈(含 0.1% TFA)。
用Waters ZQ2000质谱仪分析目的峰的精确分子量,质谱检测条件为毛细管电压:3.50 kV;锥孔电压:35 V;干燥气流速:500 L/h;离子源温度:120℃;辅助气温度:380℃;离子检测方式:选择性离子检测(SIM);离子极性:正离子(Positive);离子化方式:气动辅助电喷雾离子化(ESI)。
1.2.3 抗菌谱分析
根据文献方法[3],采用培养基倍比稀释法测定MDP-1和MDP-2抗菌活性。细菌用Poor-Broth液体培养基培养至对数生长期,然后用相应培养基稀释至A630为0.001;在预先经灭菌处理的96孔板中每个孔加入90 µL菌液。多肽以灭菌处理后的纯水溶解,最高浓度为1 mmol/L,然后倍比稀释,最低浓度为5 µmol/L,以纯水作为阴性对照,将各浓度多肽溶液加入96孔板中,10 µL/孔,并以经灭菌处理的锡箔纸覆盖 96孔板,以防止培养过程中的杂菌污染。
将 96孔板在振荡器上轻柔振荡使样品和菌液充分混合,置于摇床(转速为 200 r/min)37℃培养16~24 h。采用酶标仪测定每个孔的OD值以衡量多肽对于细菌生长的抑制作用,每种细菌平行做 3次重复。多肽的最低抑制浓度(Minimal inhibitory concentrations,MIC)用[a]–[b]表示,其中[a]代表细菌继续生长的最大浓度,而[b]代表细菌完全被杀灭的最低浓度。抗真菌试验与上述基本相同,只是真菌在Sabourand 液体培养基中30℃培养48 h后检测。
1.2.4 MDP-1和MDP-2的稳定性分析
将MDP-1和MDP-2分别于30℃、60℃和90℃水浴中加热30 min(样品浓度为100 µmol/L),热处理后的样品以0.22 µm针头过滤器过滤;以藤黄叠球菌S.luteus为指示菌检测经热处理后的抗菌肽的抑菌活性,以不经热处理的样品为对照,对照组抑菌活性设为 100%;抑菌活性采取常规的营养琼脂培养基涂平板法,将抗菌肽经不同条件处理后的抑菌圈直径除以对照组抑菌圈直径,计算抑菌效果。
健康成年人血浆由舟山医院-中科院北京基因组研究所提供。将 MDP-1和 MDP-2溶于血浆(浓度为 100 µmol/L),37℃分别孵育 30 min、2 h、4 h、8 h和24 h。处理后的样品经0.22 µm针头过滤器过滤后进行抑菌活性测试,指示菌为藤黄叠球菌 S.luteus,抑菌活性测试方法同上。
2 结果
2.1 厚壳贻贝Mytilin-1的结构模拟
图2为厚壳贻贝Mytilin-1 的模拟空间结构,由图2可见,Mytilin-1采取了典型的二硫键稳定的α/β结构,二硫键连接方式为CysI-CysV、CysII-CysVI、CysIII-CysVII和 CysIV-CysVIII;N 端肽段Cys2-Arg13形成 α-螺旋,而肽段 Gly17-Ser22和Cys27-Phe32形成两段 β-折叠,肽段 Phe23-Arg26形成连接两段 β-折叠的环状结构(Loop),碱性氨基酸Arg25和Arg26突出于环表面。
2.2 MDP-1及MDP-2的固相合成及鉴定
合成后的 MDP粗品经冷冻干燥后呈白色粉末状,经两步反相高效液相色谱纯化后,得到单一洗脱峰(图3A),其纯度>95%;质谱检测结果(图3B)表明,合成后的多肽纯品的单同位素分子量([M+H]+)分别为1197.34 Da(MDP-1)和1197.46 Da(MDP-2),这与 MDP 的理论分子量(含两对二硫键,1197.51 Da)是一致的,提示合成是成功的,同时也表明两对二硫键已经正确配对。
对合成过程中Fmoc基团的检测表明合成过程中氨基酸的偶联率>99%;合成粗品经复性后的得率为 65%,经两次分离纯化后,最终产品得率为25%。
2.3 MDP的抗菌谱分析
通过倍比稀释法测定了MDP-1和MDP-2的抗菌活性(表1)。分别测得了MDP-1和MDP-2对于6种革兰氏阴性菌、4种革兰氏阳性菌以及 2种真菌的MIC。在所选定的微生物中,MDP-2在20 µmol/L内均有较好的杀灭作用,尤其对于哈维氏弧菌Vibrio harveyi、溶藻弧菌Vibrio alginolyticus、枯草芽孢杆菌Bacillus subtilis、金黄色葡萄球菌Staphylococcus aureus以及藤黄叠球菌Sarcina luteus等。而MDP-1的杀菌作用较弱,除了对大肠杆菌Escherichia coli和枯草芽孢杆菌Bacillus subtilis有较好的抑制作用外,对其他微生物的MIC都在20 µmol/L以上。此外,从表1可以看出MDP-1和MDP-2对于革兰氏阴性菌、阳性菌以及真菌未表现出明显的选择性,说明两者都是广谱抗菌活性。
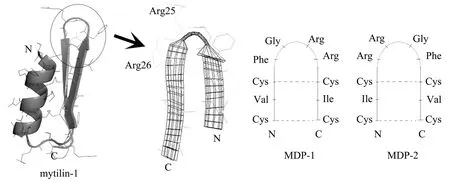
图2 Mytilin-1的模拟空间结构、活性区域及MDP的设计Fig.2 Mimic space structure of Mytilin-1(using 2EEM as template)fromMytilus coruscusand the designation of Mytilin-derived-peptides based on the key region(represented by a circle)of antimicrobial activity.The structure predicted and viewed software were ESyPred3D and Swiss-PdbViewer4.0, respectively.The N- and C-terminal of peptides were labeled by N and C, respectively.The disulfides were labeled by dashed line.
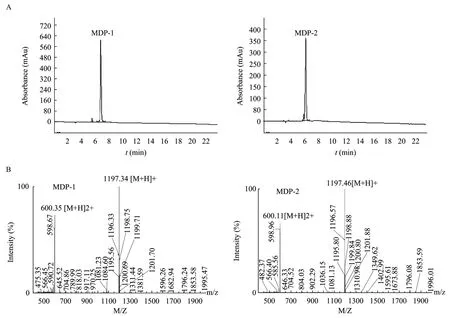
图3 MDP-1及MDP-2合成后的反相高效液相色潽纯化图(A)和质谱鉴定结果(B)Fig.3 HPLC isolation(A)and MS analysis(B)of synthesized MDP-1and MDP-2.
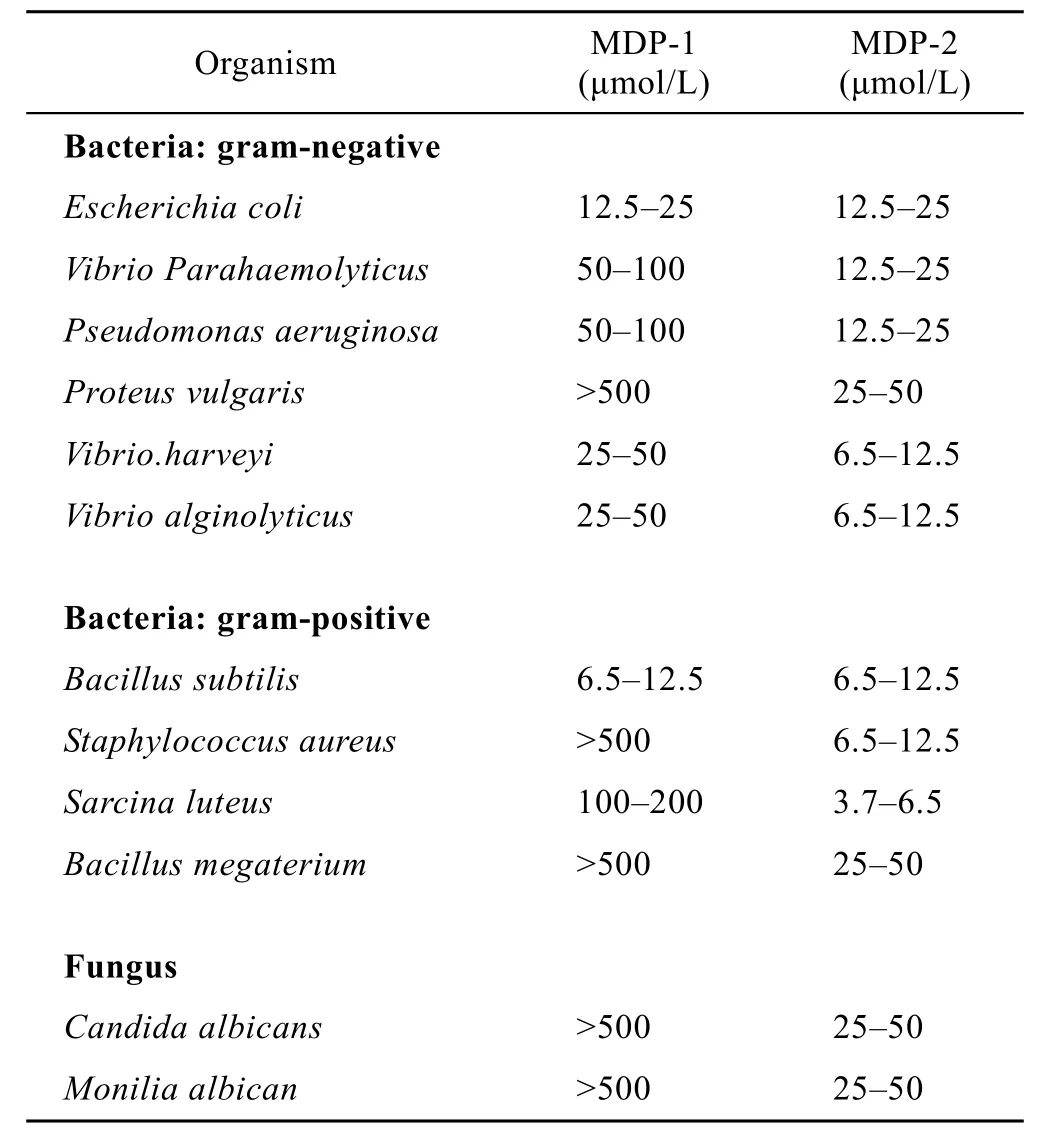
表1 MDP-1和MDP-2对于各种细菌和真菌的最低抑菌浓度(MIC)Table 1 Activity spectrum of MDP-1 and MDP-2
同时,以藤黄叠球菌为指示菌,对厚壳贻贝天然Mytilin-1与人工合成的MDP的抑菌活性进行了比较。结果表明,MDP-2对于藤黄叠球菌的MIC相比Mytilin-1下降了约10倍,而MDP-1对于藤黄叠球菌的MIC相比Mytilin-1下降了约200倍,说明合成的抗菌肽较天然抗菌肽相比,其抑菌活性有所下降。
2.4 MDP的稳定性分析
MDP-1和MDP-2热稳定性较好,其中MDP-1在30℃、60℃和90℃水浴中加热30 min后其抑菌活性未见明显下降,而 MDP-2经 30℃、60℃和90℃水浴加热30 min后,其抑菌活性也分别下降不到5%。
MDP在人血浆中也表现出很强的稳定性,在人血浆中经37℃ 孵育30 min、2 h、4 h、8 h和24 h之后,MDP-1和MDP-2的抑菌活性与未处理样品相比未见明显下降。空白人血浆在本次试验中未观察到抑菌活性。
3 讨论
生物抗菌肽具有高效的杀菌作用以及对细菌不容易产生耐受性等优势,因而在新型生物抗生素的开发中具有重要的研究价值。但相对于传统的有机小分子抗生素,生物抗菌肽因其属于蛋白质,其分子量较大,结构不够稳定且容易被降解,因而限制了其应用。如何保留生物抗菌肽的抗菌功能,同时又尽量减小其分子体积并增强其结构稳定性是目前生物抗菌肽开发中的重要内容,目前这方面已有许多成功的例子[11-12]。
贻贝抗菌肽是海洋生物抗菌肽研究中的一个热点,目前已从贻贝血淋巴中提取到4类抗菌肽分子,分别为 Mytilin、myticin、MGD和 mytimicin[1]。其中,Mytilin以及MGD抗菌肽的空间结构已被解析,对其结构与抗菌功能关系的研究表明,Mytilin和MGD抗菌肽分子结构中,连接两段 β-折叠的 β-发夹结构是其抗菌活性关键区域[5-6]。该类型结构域在其他抗菌肽分子也有所发现并也已被证明是其发挥抗菌作用的关键区域,而根据类似的 β-发夹结构设计并合成的,具有抗菌活性的人工抗菌肽也大量报道,例如Chiou等根据抗菌肽Cecropins的结构特点合成了一个新的具有 β-发夹结构的 17肽,命名为CF17,体外实验表明,CF17具有明显的抗菌及抗病毒活性[11];Tamamura等[12]以及 Shankaramm 等[13]根据抗菌肽protegrin的结构特点设计合成了一种衍生多肽,为18肽,同样具有β-发夹结构以及体外的抗菌及抗病毒活性。目前,具有这一结构特点的抗菌肽已经在临床上获得应用,例如,基于抗菌肽protegrin-1设计合成具有 β-发夹结构的新抗菌肽iseganan已被应用于临床三期[14]。
贻贝抗菌肽Mytilin也具有典型的β-发夹结构,而天然Mytilin分子具有4对二硫键,不论是进行重组表达还是进行固相化学合成,均面临很大的困难。为进一步验证Mytilin抗菌肽的结构与功能的关系,同时为抗菌肽的人工设计与合成提供新的思路,本实验对此前从厚壳贻贝血清中提取到的抗菌肽Mytilin-1进行了空间结构模拟,根据其空间结构特点,对形成连接两段β-折叠的β-发夹结构所包含的肽段进行了重新设计,在原有2个Cys的基础上引入 2个新的 Cys,通过分步氧化方法促使二硫键的正确配对(C1-C4,C2-C3),同时并将肽末端分别乙酰化和酰胺化,在此基础上合成了两条新的序列相反的10肽:MDP-1和MDP-2(图2)。因MDP序列较短,且只有两对二硫键,因此其合成产率较高,最终产品得率为25%。体外抗菌实验表明,MDP-1和MDP-2均具有广谱抗菌活性,对革兰氏阳性菌、革兰氏阴性菌以及真菌均具有杀灭活性,尤其是MDP-2对于部分海洋弧菌类以及人类常见致病菌均有明显的抑制作用。此外,由于序列较短且有两对二硫键的存在,MDP-1和MDP-2均表现出很强的结构稳定性,90℃水浴中加热30 min后其抑菌活性下降不到 5%;同时其在人血浆中也表现很好的稳定性,在血浆中经37℃孵育24 h后其抗菌活性未见明显下降。令人感兴趣的是,MDP-2的活性要明显强于MDP-1,在所测试的大多数菌种中,MDP-2的抗菌活性要比MDP-1高10~20倍,而两者仅仅只是序列相反,两者间抗菌活性的差异尚有待进一步研究。目前,MDP-1和 MDP-2 的空间结构仍在解析中。上述研究结果为深入了解具有 β-发夹结构的抗菌肽的抗菌机制以及在此基础上开发新型生物抗生素奠定了基础。
REFERENCES
[1]Mitta G, Vandenbulcke F, Roch P.Original involvement of antimicrobial peptides in mussel innate immunity.FEBS Lett, 2000, 486(3): 185−190.
[2]Charlet M, Chernysh S, Philippe H,et al.Innate immunity.Isolation of several cysteine-rich antimicrobial peptides from the blood of a mollusk,Mytilus edulis.JBiol Chem, 1996, 271(36): 21808−21813.
[3]Mitta G, Vandenbulcke F, Hubert F,et al.Involvement of mytilins in mussel antimicrobial defense.J Biol Chem,2000, 275(17): 12954−12962.
[4]Mitta G, Vandenbulcke F, Noël T,et al.Differential distribution and defense involvement of antimicrobial peptides in mussel.J Cell Sci, 2000, 113(15): 2759−2769.
[5]Roch P, Yang Y, Toubiana M,et al.NMR structure of mussel Mytilin, and antiviral-antibacterial activities of derived synthetic peptides.Dev Comp Immunol, 2008,32(3): 227−238.
[6]Yang YS, Mitta G, Chavanieu A,et al.Solution structure and activity of the synthetic four-disulfide bond Mediterranean mussel defensin(MGD-1).Biochemistry,2000, 39(47): 14436−14447.
[7]Romestand B, Molina F, Richard V,et al.Key role of the loop connecting the two beta strands of mussel defensin in its antimicrobial activity.Eur J Biochem, 2003, 270(13):2805−2813.
[8]Wang RX, Liu M, Liao Z,et al.Purification and identification of Mytilins fromMytilus coruscus.J Fish China, 2010, 334(1): 153−159.王日昕,刘梅,廖智, 等.厚壳贻贝抗菌肽Mytilin的初步鉴定.水产学报, 2010, 334(1): 153−159.
[9]Lambert C, Leonard N, De Bolle X,et al.ESyPred3D:prediction of proteins 3D structures.Bioinformatics, 2002,18(9): 1250−1256.
[10]Aumelas A, Mangoni M, Roumestand C,et al.Synthesis and solution structure of the antimicrobial peptide protegrin-1.Eur J Biochem, 1996, 237(3): 575−583.
[11]Chiou PP, Lin CM, Perez L,et al.Effect of cecropin B and a synthetic analogue on propagation of fish virusesin vitro.Mar Biotechnol, 2002, 4(3): 294−302.
[12]Tamamura H, Murakami T, Horiuchi S,et al.Synthesis of protegrin-related peptides and their antibacterial and anti-human immunodeficiency virus activity.Chem Pharm Bull, 1995, 43(5): 853−858.
[13]Shankaramma SC, Athanassiou Z, Zerbe O,et al.Macrocyclic hairpin mimetics of the cationic antimicrobial peptide protegrin I: a new family of broad-spectrum antibiotics.Chembiochem, 2002, 3(11): 1126−1133.
[14]Giles FJ, Rodriguez R, Weisdorf D,et al.A phase III,randomized, double-blind, placebo-controlled, study of iseganan for the reduction of stomatitis in patients receiving stomatotoxic chemotherapy.Leuk Res, 2004,28(6): 559−565.
Designation, solid-phase synthesis and antimicrobial activity of Mytilin derived peptides based on Mytilin-1 from Mytilus coruscus
Mei Liu1, Mei Wu1, Shiquan Zhou2, Peng Gao1, Tao Lu1, Rixin Wang1, Ge Shi1, and Zhi Liao1
1 Laboratory of Marine Living and Molecular Engineering, College of Marine Science, Zhejiang Ocean University, Zhoushan 316000, China 2 Joint Laboratory of Immunogenomics, Zhoushan Hospital-BIG/CAS, Zhoushan Hospital, Zhoushan 316004, China
Received:October 26, 2009;Accepted:March 18, 2010
Supported by:National Key Technology R&D Program of China(No.2007BAD43B08), General Agricultural Programs of Science and Technology Commission Foundation of Zhejiang Province(Nos.2008C22026, 2009C32016), the Seeding Grants Programs of Science and Technology Commission Foundation of Zhejiang Province(No.2008R40G2110003), the Projection of Zhoushan Technical Bureau(No.Y20082080).
Corresponding author:Zhi Liao.Tel/Fax: +86-580-2550826; E-mail: liaozhi@zjou.edu.cn国家科技支撑计划(No.2007BAD43B08),浙江省科技厅面上科研农业项目(Nos.2008C22026, 2009C32016),浙江省科技厅新苗人才计划项目(No.2008R40G2110003),浙江省舟山市科技局计划项目(No.Y20082080)资助。
