蔗糖转运蛋白基因VvSUC12和VvSUC27在葡萄胚性和非胚性愈伤组织中的差异表达
2010-10-16陈思曾磊陈尚武孙杨吾张文徐海英马会勤
陈思,曾磊,陈尚武,孙杨吾,张文,徐海英,马会勤
1 中国农业大学农学与生物技术学院,北京 100193 2 中国农业大学食品科学与营养工程学院,北京 100083 3 北京市农林科学院林业果树研究所,北京 100093
蔗糖转运蛋白基因VvSUC12和VvSUC27在葡萄胚性和非胚性愈伤组织中的差异表达
陈思1*,曾磊2*,陈尚武2,孙杨吾1,张文1,徐海英3,马会勤1
1 中国农业大学农学与生物技术学院,北京 100193 2 中国农业大学食品科学与营养工程学院,北京 100083 3 北京市农林科学院林业果树研究所,北京 100093
本研究通过对霞多丽葡萄花前约10 d的花丝进行组培诱导,获得胚性和非胚性两种愈伤组织,分别进行继代、组织结构观察和体细胞胚的诱导验证。为研究两种愈伤组织对培养基中主要碳源蔗糖的利用特点,根据GenBank中的定位于细胞质膜的葡萄蔗糖转运蛋白基因VvSUC12和VvSUC27的序列,设计了这两种蔗糖转运蛋白的PCR引物。以RNAplant试剂法,提取胚性愈伤组织和非胚性愈伤组织的 RNA,进行半定量 RT-PCR。研究表明,31个循环半定量RT-PCR结果中VvSUC12在胚性愈伤和非胚性愈伤中均有表达,且在非胚性愈伤组织中的表达水平稍高于胚性愈伤组织,表达差异未达到显著水平,VvSUC27的表达水平明显低于VvSUC12,且只在胚性愈伤组织中表达。提高至 35个循环的半定量 RT-PCR结果显示VvSUC27基因在非胚性愈伤组织中微弱表达,而在胚性愈伤组织中的表达强度较 31个循环有所增加,且高于非胚性愈伤。
Vitis viniferaL.,愈伤组织,蔗糖转运蛋白,半定量RT-PCR
Abstract:We induced embryogenic calli(EC)and non-embryogenic calli(NEC)from flower filaments of Vitis vinifera L.cv.Chardonnay about 10 days before full bloom.The callus were sub-cultured, observed and verified by somatic embryo induction.PCR primers forVvSUC12andVvSCU27were designed according to the corresponding sequences in GenBank.After RNA extraction with RNAplant for EC and NEC cell lines, we synthesized the 1ststrand DNA for semi quantitative RT-PCR, and normalized the density of the bands against house-keeping geneActin.The results of 31 cycles semi-quantitative RT-PCR showed thatVvSUC12was highly expressed in both EC and NEC, with higher expression intensity in NEC than in EC, but not reached the significantlevel; while the expression ofVvSUC27was only detected in EC, and the expression level was significantly lower than that ofVvSUC12.We increased the semi-quantitative RT-PCR cycle number to 35 and found thatVvSUC27gene was weakly expressed in NEC, in EC the intensity of the band was increased comparing with 31 cycles, and the expression level was higher than that of NEC.The paper discussed the differential expression of the two sucrose transporters and their relationship with the sucrose in the tissue culture medium.
Keywords:Vitis viniferaL., calli, sucrose transporter, semi-quantitative RT-PCR
葡萄Vitis viniferaL.属多年生木质藤本果树,具有遗传背景复杂、生命周期长等特点,传统育种方法在品种改良上受到很大限制[1]。通过基因工程的方法对葡萄品种进行改良,大部分都需要利用花丝诱导培养获得的胚性愈伤组织(Embryogenic Callus,EC)和体细胞胚。此外,葡萄胚性愈伤组织还是悬浮细胞系建立、原生质体培养、诱变育种、种质资源保存的重要基础和前提条件[2]。目前,胚性愈伤组织的获得与增殖仍是葡萄生物工程相关研究的瓶颈之一,主要表现在:以同类外植体材料在相同的培养基上,诱导获得的大部分愈伤组织为非胚性愈伤组织(Non-embryogenic callus,NEC),在诱导和继代过程中,NEC除生长量明显大于EC外,其不能被诱导转化为EC,作为植株再生材料。上述现象在其他作物中同样存在[3]。
糖是能量物质,也是信号分子。在大部分植物中,碳水化合物是以蔗糖及其衍生物的形式从植物的源器官到库器官进行长距离运输的[4]。在植物组织培养过程中,无论是 EC的诱导、继代,还是体细胞胚产生和发育,人们常常调整培养基的成分,以期获得最优化的效果。其中,除了激素的差别,糖的种类和浓度是主要的调节手段之一。有大量研究表明,糖显著地影响着愈伤组织的形成和发育,Swedlund和 Locy发现培养基中不同的碳源,对玉米 EC的诱导、继代,以及幼苗的再生表现不同的结果,其中山梨醇只能支持 EC的生长,而不支持NEC的生长[5]。通过对甘蔗EC在不同碳源上的生长量比较,蔗糖被认为是最好的培养基糖源[6-7]。不仅不同类型的愈伤组织对培养基中不同种类的糖的利用不同,不同类型的愈伤组织中糖含量也可能存在不同,以白三叶草Medicago arboreaL.为材料,无论外植体为胚轴还是叶柄,EC中的糖含量都高于NEC[8]。
愈伤组织对糖的吸收和贮存,都涉及糖分子的转运。当糖在植物不同细胞间和细胞内的不同区隔(Compartment)间跨膜转移时,通过糖转运蛋白的转运模式是最重要的转运途径之一。膜系统中的糖转运蛋白主要包括:蔗糖转运蛋白和己糖转运蛋白两大类,它们对于糖的运输至关重要,不仅调控着糖类物质在植物体内的分配以及在库端的积累,其功能的行使还直接影响植物的生长发育及产量和品质。
在高等植物中,自 1992年Riesmeier等[9]从菠菜中克隆得到第一个蔗糖转运蛋白以来,许多蔗糖转运蛋白相继从不同植物以及不同器官克隆得到[4]。Davies等[10]于1999年从葡萄果实中克隆得到了3个预测为葡萄蔗糖转运蛋白的基因(VvSUC11、VvSUC12、VvSUC27),其中两个(VvSUC11、VvSUC12)在酵母中得到了功能验证[11]。VvSUC11和VvSUC12在葡萄果实中具有相似的表达模式,随成熟过程中表达量增高,二者的主要功能被认为是负责蔗糖从质外体(Apoplast)向薄壁细胞(Parenchyma cell)装载;而Vvsuc27的表达与前两者有显著不同,在果实成熟过程中表达量降低[11]。
由同样外植体起源形成的葡萄EC和NEC细胞,具有不同的生理、生化和基因表达特征。Marsoni等[4]从蛋白质组学的角度对葡萄EC和NEC细胞进行了比较,发现一些蛋白质在 EC中的表达显著高于NEC。Zhang等[12]发现,胁迫反应相关蛋白和代谢相关蛋白的表达量在EC和NEC细胞中存在明显差异。目前对葡萄EC和NEC中糖转运蛋白的差异表达还没有报道。蔗糖是目前组培培养基中最主要的碳源,利用现代生物技术手段,研究蔗糖转运蛋白在葡萄EC和NEC中的差异表达,对理解细胞类型分化和糖载体表达与糖分需求的调控机理,以及对葡萄组织培养外植体脱分化和愈伤组织类型形成的诱导取向调控具有积极的意义。
1 材料与方法
1.1 胚性与非胚性愈伤组织材料
供试植物材料为欧亚种酿酒葡萄品种霞多丽V.viniferaL.cv.Chardonnay,5年生植株。于清晨采摘已进入小孢子分化期未开放的花序,4℃保存1 d后表面灭菌,解剖分离花丝作为外植体培养材料。葡萄花丝愈伤组织的诱导按照Perl等[13]的方法,培养基为:MS + 2.0 mg/L 2,4-D + 0.20 mg/L 6-BA + 5 mg/L AgNO3(附加3%的蔗糖和0.25%的Gelrite),试剂均来自 Sigma公司。花丝接种到培养基上后,置于(25±1)℃黑暗条件下培养,诱导愈伤组织的发生。接种后约60 d,在体视显微镜下根据愈伤组织的外观,对EC和NEC细胞系进行分离和继代培养,继代2次(30 d×2)后,取第3次继代培养15 d后的材料进行以下处理:1/3用液氮冷冻后用于RNA的提取;1/3 FAA固定后进行石蜡切片和番红固绿对染[14],进行光学显微组织学观察与验证;1/3置于体细胞胚诱导培养基上[13],即:NN培养基,附加3%蔗糖,18 g/L麦芽糖,1 g/L酪蛋白水解物,4.6 g/L的甘油,0.25%的 Gelrite,根据体细胞胚的产生,对材料的胚性进行发育验证。
1.2 RNA的提取、纯化、反转录合成cDNA
RNA的提取、纯化、反转录及cDNA的合成参照代茹等[15]的方法。采用 RNAplant试剂(索莱宝生物公司)提取霞多丽葡萄EC和NEC的总RNA,以不含RNase的DNase进行纯化处理,以紫外分光光度计(型号 UV-1000)测定纯度及定量(OD260/280、OD260/230),−80℃保存。采用cDNA一链合成试剂盒(Promega公司,美国),对纯化后的RNA进行反转录合成cDNA一链模板库,−20℃保存备用。
1.3 半定量RT-PCR检测与基因表达分析
根据 GenBank上的Actin(GenBank Accession No.AF369524)和VvSUC12(GenBank Accession No.AF021809)、VvSUC27(GenBank Accession No.AF021810)两个葡萄基因序列,设计半定量RT-PCR引物,引物序列如表 1。引物由上海英骏生物公司合成。
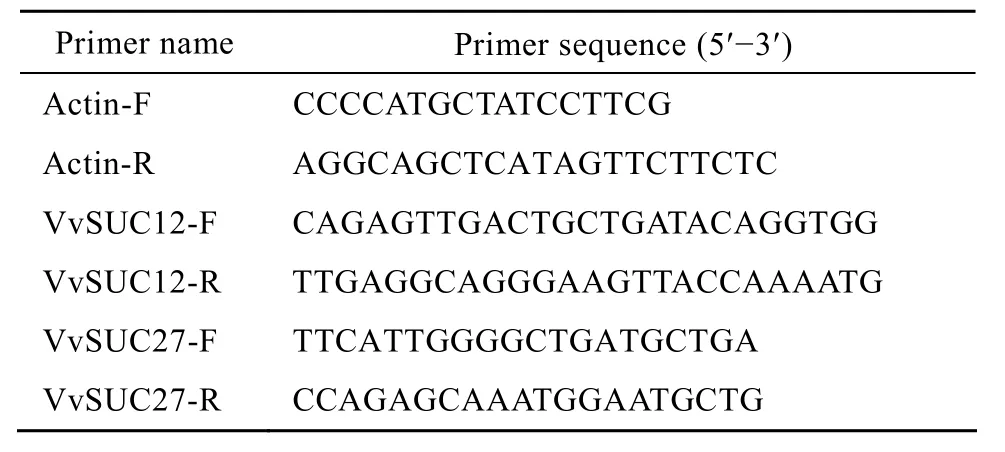
表1 半定量RT-PCR中使用的引物Table 1 Primers used in semi-quantitative RT-PCR
以PCR扩增出的条带清晰可见为原则对模板浓度进行调整,将反转录得到的胚性cDNA第一链稀释20倍,非胚性cDNA一链稀释5倍作为半定量PCR模板。在半定量PCR之前,先以稀释20倍的胚性材料 cDNA第一链为模板,根据所设计的VvSUC12、VvSUC27基因引物的各项参数对引物的退火温度进行温度梯度 PCR,先将循环数提高至37个,其他条件不变,摸索引物与模板结合的最适温度。
取 1 µL cDNA第一链做模板,进行RT-PCR。反应体系:2 μL 10×PCR 缓冲液,2 μL dNTPs(2.5 mmol/L),2 μL primer-F(2.5 μmol/L),2 μL primer-B(2.5 μmol/L),1 μL 模板,0.2 μL rTaq酶,补 ddH2O 至 20 µL。
PCR反应程序为:94℃热变性5 min;94℃变性45 s,退火温度 45 s,72℃延伸 50 s,37 个循环;72℃延伸 8 min;4℃保存。退火温度在 48℃~55℃设置梯度,PCR产物进行1%琼脂糖凝胶电泳检测,以确定最合适的退火温度。优化退火温度后,按上述程序将循环数减为31个进行半定量RT-PCR,每个反应设置3次重复,PCR产物进行1%琼脂糖凝胶电泳检测,使用培清JS-680c全自动凝胶成像分析仪(上海培清科技有限公司)照相,并用设备自带软件对电泳结果进行定量分析,一般测定电泳条带的IOD值(Intergrated optical density),目的基因相对表达量为其电泳条带的IOD值与内标基因的电泳条带的IOD值的比值,然后对定量结果进行显著性差异分析。
1.4 高效液相色谱法测定不同愈伤组织中糖的种类和含量
每次分别取2 g EC和NEC,在研钵中加5 mL80%乙醇充分研磨,于75℃下振荡浸提10 min,4000×g常温离心 15 min,收集上清液,然后各用10 mL 80%乙醇重复提取2次,取上清液,合并,定容至25 mL,摇匀后取4 mL于75℃烘箱中蒸去乙醇,残渣用1 mL重蒸水溶解,用0.45 μm微孔滤膜过滤后测定可溶性糖,重复提取3次。
使用 Waters 600型高效液相色谱仪,色谱柱为Ca型 Shim-pack SCR-101C(300 mm×7.9 mm i.d.)测糖专用柱。流动相为脱气重蒸水,流速0.8 mL/min,柱温 80℃。R410示差折光检测器,灵敏度 32。进样量 10 μL。色谱纯果糖、葡萄糖、蔗糖内标购自Sigma公司。根据峰面积和各种糖的标准曲线计算所测样品的含糖量。
2 结果与分析
2.1 葡萄愈伤组织的诱导与验证
在花丝的诱导过程中会产生较大量的NEC和一定量的 EC,至花丝接种后 60 d,进行EC和NEC的分离和第一次继代时,EC和NEC的比例大约为1:5,并在年度间有一定的变化。在30 d一次的继代培养过程中,NEC生物量的增长速度大约为EC的2~3倍。外观上,EC的外观结构均匀、致密,呈新鲜的黄色(图1A);而NEC呈半透明状、结构疏松、颜色较浅,为浅黄或白色(图1D)。本试验将EC和NEC经固定、切片及番红固绿对染后,在显微镜下进行了观察。固绿主要对薄且纤维素含量高的细胞壁和胞质进行染色,而番红主要对木质化的细胞壁和细胞核染色。观察结果表明,EC细胞排列紧密、均一,细胞核大,细胞质浓厚,由于浓厚的绿色着色细胞质,细胞核被番红着色,轮廓可见(图1B)。NEC经番红固绿对染后观察,细胞核不可见,绝大多数细胞的细胞壁没有番红的着色,少数番红着色的细胞分散于其他固绿着色的细胞中(图1E)。在体细胞胚分化诱导培养基上EC和NEC培养后有不同特征,诱导培养2周后,EC整体分化生成球形和心形体细胞胚(图1C),而非胚性愈伤组织在体细胞胚诱导培养基上,不被诱导分化,仍维持原状,部分区域出现褐化(图1F)。
2.2 蔗糖转运蛋白VvSUC12、VvSUC27基因在胚性和非胚性愈伤组织中的差异表达
进行优化后的VvSUC12、VvSUC27基因引物的最适退火温度分别为54.5℃、52.5℃(图2)。采用优化的退火温度,以适当调整浓度后的cDNA第一链为模板,以31个循环完成VvSUC12、VvSUC27和Actin特异引物对的半定量RT-PCR,每个反应设置3次重复,代表性的电泳结果如图3A所示,3次重复试验数据的归一化结果如图3B所示。从中可以看出,内标基因Actin在EC和NEC材料中得到的扩增产物的亮度基本一致;VvSUC27在EC中有微弱的表达,而在NEC中未扩增出VvSUC27的条带,VvSUC12的表达在 EC和 NEC中都显著高于VvSUC27,其中在 NEC中的表达量高于 EC,但统计分析两者的表达差异并未达到显著水平。由于31个循环的半定量PCR结果未发现VvSUC27基因在NEC中的表达,故将循环数提高至35个循环进一步验证,电泳结果显示了 NEC样品的微弱条带,而在 EC中的条带的强度较 31个循环时有所增加(如图4)。
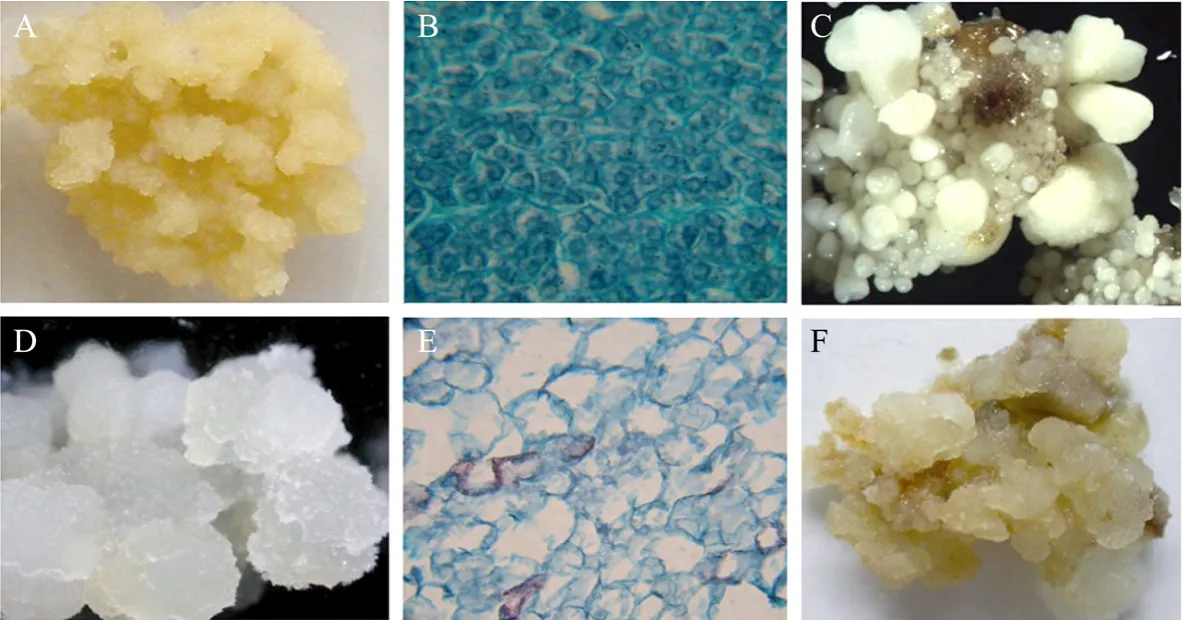
图1 霞多丽葡萄不同愈伤组织的诱导与形态、解剖验证Fig.1 The observation and verification of embryogenic and non-embryogenic callus of Chardonnay.(A)Embryogenic calli(EC).(B)EC stained with Safranin and Fast Green.(C)Somatic embryos were induced from EC on differentiation medium.(D)Non-embryogenic calli(NEC).(E)NEC stained with Safranin and Fast Green.(F)No somatic embryo was induced from NEC on differentiation medium.

图2 VvSUC12和VvSUC27 PCR条件的优化Fig.2 The optimization of PCR condition forVvSUC12andVvSUC27.(A)VvSUC12.M: DNA marker; 1–6: the annealing temperature ofVvSUC12was 50°C, 50.5°C, 51.7°C, 52.8°C, 54°C and 54.5°C respectively.(B)VvSUC27.M: DNA marker; 1–6: the annealing temperature ofVvSUC27was 48°C, 49°C, 51°C, 51.5°C, 52°C and 52.5°C respectively.
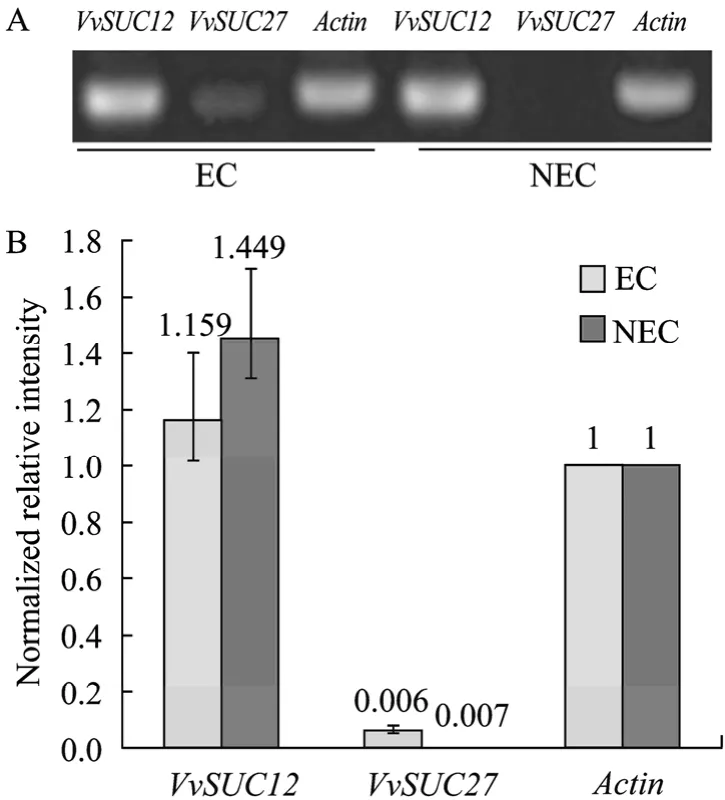
图3 霞多丽胚性和非胚性愈伤组织蔗糖转运蛋白基因VvSUC12和VvSUC27表达水平的半定量RT-PCRFig.3 The expression ofVvSUC12andVvSUC27in Chardonnay EC and NEC compared with semi-quantitative RT-PCR.(A)The semi-quantitative RT-PCR ofVvSUC12andVvSUC27in Chardonnay EC and NEC.(B)The normalized expression level ofVvSUC12andVvSUC27with house keeping geneActin.The cDNAs concentration of EC and NEC was adjusted to similar concentrations before applied for semi qRT-PCR temples.
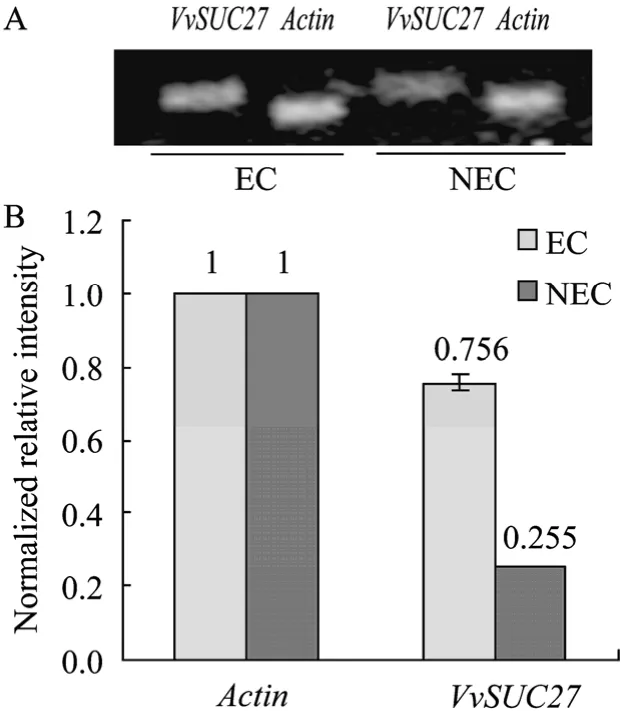
图4 VvSUC27表达水平的35个循环半定量RT-PCR检测结果Fig.4 The expression ofVvSUC27in EC and NEC compared with 35 cycles semi-quantitative RT-PCR.(A)The semi-quantitative RT-PCR ofVvSUC27in Chardonnay EC and NEC.(B)The normalized expression level ofVvSUC27with house keeping geneActin.The cDNA concentration of EC and NEC was adjusted to similar concentrations before applied for semi qRT-PCR temples.
2.3 胚性和非胚性愈伤组织中蔗糖、葡萄糖和果糖的含量
以色谱纯蔗糖、葡萄糖和果糖为内参,通过液相色谱法测定了葡萄胚性愈伤组织和非胚性愈伤组织中的3种主要糖的含量。结果表明:EC和NEC中果糖含量差别不大,而蔗糖和葡萄糖的含量 EC显著高于 NEC(P<0.05)(表 2)。EC中蔗糖的含量是NEC的1倍,这和EC与NEC中蔗糖转运蛋白表达水平的结果一致。在EC和NEC中VvSUC12的表达量相近,而VvSUC27的表达量在 EC中显著高于NEC。与VvSUC12相比,VvSUC27具有对糖更高的转运能力[20]。而对 EC中更高的葡萄糖含量,还需要通过进一步的实验研究这是由于EC和NEC中单糖转运蛋白表达的差异,还是由于转入细胞的蔗糖存在不同酶解和利用特征等原因。
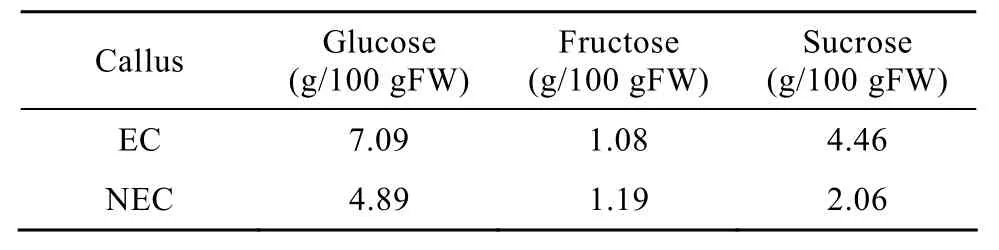
表 2 胚性和非胚性愈伤组织中葡萄糖、果糖、蔗糖的含量Table 2 Contents of glucose, fructose and sucrose in EC and NEC
3 讨论
EC和NEC是从同一组织脱分化后形成的不同多能性的葡萄干细胞系,其VvSUC12和VvSUC27差异表达的决定因素,目前尚不清楚。这两个基因表达的,可能是细胞对蔗糖的吸收和代谢差异调节的反映和表现形式,同时可能暗示其他糖转运蛋白也存在一定的差异。根据对蔗糖吸收的动力学,可将植物蔗糖转运蛋白大体分为 2类,一类具高亲和性/低转运能力(High affinity low capacity, HALC),另一类则具低亲和性/高转运能力(Low affinity high capacity,LAHC)[16]。前人的研究结果表明,HALC类蔗糖转运蛋白负责蔗糖的韧皮部装载和回收在长距离转运过程中从维管组织泄漏出的蔗糖,LAHC类蔗糖转运蛋白尽管对蔗糖的亲和力要弱一些,但在蔗糖浓度高时却有助于大量蔗糖的转运。它们主要参与高浓度蔗糖的转运步骤,向库组织大量转运蔗糖,在决定库容大小上起主要作用,还可能参与蔗糖吸收效率的调控[18]。
植物中的蔗糖转运蛋白由一个基因家族所编码,其中拟南芥的蔗糖转运蛋白基因家族包括 9个成员,其中7个编码具有功能的蛋白质[19]。葡萄中根据基因组序列分析预测有4个蔗糖转运蛋白[20],目前已知的分别为VvSUC11、VvSUC12和VvSUC27,都属于定位于细胞质膜的蔗糖-H+同向转运载体(Sucrose-H+symporters),其中VvSUC11和VvSUC12在表达方式和生化特点上都非常相似[10-11,19]。由GenBank库的信息可知,VvSUC12包含14个外显子和13个内含子,位于葡萄基因组的1号染色体上,VvSUC27包含4个外显子和3个内含子,其染色体定位目前还不清楚。这两个基因的克隆都是通过葡萄的 mRNA文库获得的,VvSUC12(GenBank Accession No.AF021809)mRNA序列全长2130 bp,编码 612个氨基酸;VvSUC27(GenBank Accession No.AF021810)的mRNA序列较短,全长1925 bp,编码505个氨基酸,它们都具有12个跨膜结构域,每个跨膜结构域由大约 20个氨基酸组成,跨膜结构域之间由短的亲水氨基酸序列链接,VvSUC12在连接第 6和第 7跨膜域的亲水序列区比VvSUC27多 51个氨基酸[10]。VvSUC12的蔗糖转运Km为1.36 mmol/L,属于HALC类型的蔗糖转运蛋白,在果实中它主要参与将蔗糖从质外体运入果肉细胞[11],而VvSUC27的蔗糖转运Km为 8.0~10.5 mmol/L,属于LAHC型转运蛋白,具有低亲和性/高转运能力,在转基因酵母中它对蔗糖的转运能力受单糖的促进和麦芽糖的抑制[19]。以前仅在葡萄的果实和幼叶中检测到VvSUC12的表达[20],本研究首次发现VvSUC12在葡萄胚性和非胚性愈伤组织中也有表达。VvSUC27与库的活性有关,在未成熟的果实、花、卷须和根系中都有较高的表达,而在衰老叶片中的表达非常低[20]。葡萄的胚性愈伤组织和非胚性愈伤组织作为库有一些独有的特点,它们不像发育后期的果实具有贮存糖分的特点,糖只是被利用而很少被累积,这个特点可能暗示了为什么在本实验中只发现VvSUC12这种高亲和性/低转运能力的蔗糖转运蛋白基因的表达,而低亲和/高转运的VvSUC27的基因表达量很低或没有的原因,同时也为葡萄胚性愈伤组织和非胚性愈伤组织都能够在含3%蔗糖的培养基上正常生长提供了解释。
蔗糖是愈伤组织诱导、继代和体细胞胚分化诱导等各种培养基中最主要的碳源,目前已知的葡萄的3个蔗糖转运蛋白也都预测定位于细胞质膜上,除了提供生长和发育所需的能源,蔗糖和其他单糖还是重要的信号分子[21]。以甜瓜子叶为材料诱导体细胞胚的研究表明,200 mmol/L的蔗糖浓度下体细胞胚的得率最高,而更高和更低的蔗糖浓度都会使体细胞胚的形成受到抑制[22]。需要指出的是,糖的吸收、代谢和信号转导是一个非常复杂的过程,即使是在单一的蔗糖培养基上,由于植物细胞还能够分泌胞外转化酶(Invertase),催化培养基中的蔗糖降解为葡萄糖和果糖,再通过质膜上的单糖转运蛋白进行吸收和相应的信号传导,因此单糖转运蛋白的表达对不同愈伤组织的生长也起着明显的作用,这在前人以其他植物种类胚性愈伤组织和非胚性愈伤组织为材料所做的不同的单糖培养基实验中已经得到了证明[5]。目前葡萄基因组中预测的单糖转运蛋白基因可能多达59个[20],已克隆的单糖转运蛋白有 5个(VvHT1-5),其表达水平在不同的组织器官中也存在差异[23],以佳美葡萄果实的悬浮细胞系为材料,Conde等[24]的研究结果表明,培养基中的葡萄糖浓度能够从蛋白质数量和转运活性两方面对VvHT1进行调节,高葡萄糖含量抑制VvHT1的表达,而未测量到其他葡萄单糖转运蛋白对培养基中葡萄糖含量的响应。目前,本课题组正对葡萄EC和NEC中单糖转运蛋白的表达开展研究,相关的实验结果会更好地解释EC和NEC对不同糖信号的响应,以及对不同碳源的利用,从而为调整碳源种类和浓度提高EC的诱导得率提供参考。
REFERENCES
[1]Vivier MA, Pretorius IS.Genetically tailored grapevines for the wine industry.Trends Biotechnol, 2002, 20(11):472–478.
[2]Sun JS.Plant Cell Engineering Experimental Technique.Beijing: Science Press, 1995: 173–190.孙敬三.植物细胞工程实验技术.北京: 科学出版社,1995: 173–190.
[3]Hoque ME, Ali MS, Karim NH.Embryogenic callus induction and regeneration of elite bangladeshi indica rice cultivars.Plant Tissue Cult Biotech, 2007, 17(1): 65–70.
[4]Lalonde S, Boles E, Hellmann H,et al.The dual function of sugar carriers: transport and sugar sensing.Plant Cell,1999, 11(4): 707–726.
[5]Swedlund B, Lacy RD.Sorbitol as the primary carbon source for the growth of embryogenic callus of maize.Plant Physiol, 1993, 103: 1339–1346.
[6]Nickell LG, Maretzki A.The utilization of sugars and starch as carbon sources by sugarcane cell suspension cultures.Plant Cell Physiol, 1970, 11: 183–185.
[7]Maretzki A, Thom M, Nickell LG.Utilization and metabolism of carbohydrates in cell and callus cultures//Street HE, ed.Tissue Culture and Plant Science.London:Academic Press, 1974: 329–361.
[8]Endress V, Barriuso J, Ruperez P,et al.Differences in cell wall polysaccharide composition between embryogenic and non-embryogenic calli ofMedicago arboreaL.Plant Cell Tiss Organ Cult, 2009, 97: 323–329.
[9]Riesmeier JW, WilImitzer L, Frommer WB.Isolation and characterization of a sucrose carrier cDNA from spinach by functional expression in yeast.EMBO J, 1992, 13:4705–4713.
[10]Davies C, Wolf T, Robinson SP.Three putative sucrose transporters are differentially expressed in grapevine tissues.Plant Sci, 1999, 147: 93–100.
[11]Manning K, Davies C, Bowan HC,et a1.Functional characterization of two ripening-related sucrose transporters from grape berries.Ann Bot, 2001, 87(1): 125–129.
[12]Zhang J, Ma H, Chen S,et al.Stress response proteins’differential expression in embryogenic and non-embryogenic callus ofVitis viniferaL.cv.Cabernet Sauvignon-a proteomic approach.Plant Sci, 2009, 177(2): 103–113.
[13]Perl A, Saad S, Sahar N,et al.Establishment of long term embryogenic cultures of seedlessVitis viniferacultivars-a synergistic effect of auxins and the role of abscisic acid.Plant Sci, 1995, 104: 193–200.
[14]Hu BZ, Chang Y.Experiments in Botany.Beijing: China Agriculture Press, 2005: 24–26.胡宝忠, 常缨.植物学实验.北京: 中国农业出版社,2005: 24–26.
[15]Dai R, Ji M, Shu XM,et al.Comparative study of total RNA extraction methods from the grape callus and a preliminary analysis of the genes′ differential expression between the embryogenic callus and non-embryogenic callus.J Yunnan Univ:Nat Sc Ed, 2009, 31(4): 410–415.代茹, 冀敏, 舒小梅, 等.葡萄愈伤组织RNA提取方法比较及部分基因的表达差异初步分析.云南大学学报:自然科学版, 2009, 31(4): 410–415.
[16]Weber H, Golombek S, Heim S,et al.Integration of carbohydrate and nitrogen metabolism during legum seed development: implications for storage product synthesis.J Plant Physiol, 1997, 152: 641–648.
[17]Weise A, Barker L.A new subfamily of sucrose transporters, SUT4, with low affinity/high capacity is localized in enucleate sieve elements of plants.Plant Cell,2000, 12: 1345–1356.
[18]Sauer N, Ludwig A, Knoblauch A,et al.AtSUC8 and AtSUC9 encode functional sucrose transporters, but the closely related AtSUC6 and AtSUC7 genes encode aberrant proteins in differentArabidopsisecotypes.Plant J, 2004, 40: 120–130.
[19]Zhang YL, Meng QY, Zhu HL,et al.Functional characterization of a LAHC sucrose transporter isolated from grape berries in yeast.Plant Growth Regul, 2008, 54:71–79.
[20]Agasse A, Vignault C, Kappel C,et al.Sugar transport &sugar sensing in grape//Roubelakis-Angelakis, Kalliopi A,ed.Grapevine Molecular Physiology & Biotechnology.2nd ed.Dordrecht: Springer Netherlands Press, 2009:105–139.
[21]Fan RC, Peng CC, Xu YH,et al.Apple sucrose transporter SUT1 and sorbitol transporter SOT6 interact with cytochrome b5 to regulate their affinity for substrate sugars.Plant Physiol, 2009, 150: 1880–1901.
[22]Nakagawa H, Saijyo J, Yamuchi N,et al.Effects of sugars and abscisic acid on somatic embryogenesis from melon(Cucumis meloL.)expanded cotyledon.Sci Hortic, 2001,90: 85–92.
[23]Hayes MA, Davies C, Dry IB.Isolation, functional characterization, and expression analysis of grapevine(Vitis viniferaL.)hexose transporters: differential roles in sink and source tissues.J Exp Bot, 2007, 58(8):1985–1997.
[24]Conde C, Agasse A, David G,et al.Pathways of glucose regulation of monosaccharide transport in grape cells.Plant Physiol, 2006, 141: 1563–1577.
Differentiated expression of VvSUC12 and VvSUC27 in embryogenic and non-embryogenic calli of Vitis vinifera L.
Si Chen1*, Lei Zeng2*, Shangwu Chen2, Yangwu Sun1, Wen Zhang1, Haiying Xu3, and Huiqin Ma1
1 College of Agriculture and Biotechnology, China Agricultural University, Beijing 100193, China 2 College of Food Science and Nutrition Engineering, China Agricultural University, Beijing 100083, China 3 Institute of Forestry and Fruit Tree Sciences, Beijing Academy of Agricultural Sciences, Beijing 100093, China
Received:September 15, 2009;Accepted:February 3, 2010
Supported by:National Natural Science Foundation of China(Nos.30471212, 30500347), National Modern Grape Industry System(No.nycytx-30-04).
Corresponding author:Huiqin Ma.Tel/Fax: +86-10-62731157; E-mail: hqma@cau.edu.cn*These authors contributed equally to this work.国家自然科学基金项目(Nos.30471212, 30500347),国家现代葡萄产业技术体系项目(No.nycytx-30-04)资助。
