日本血吸虫蛋白酶体α2亚基基因的克隆、表达及功能分析
2010-10-16洪炀韩宏晓彭金彪李晔石耀军傅志强刘金明李祥瑞林矫矫
洪炀,韩宏晓,彭金彪,李晔,石耀军,傅志强,刘金明,李祥瑞,林矫矫
1 中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海 200241 2 南京农业大学动物医学院,南京 210095
日本血吸虫蛋白酶体α2亚基基因的克隆、表达及功能分析
洪炀1,2,韩宏晓1,2,彭金彪1,李晔1,石耀军1,傅志强1,刘金明1,李祥瑞2,林矫矫1
1 中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海 200241 2 南京农业大学动物医学院,南京 210095
26S蛋白酶体是一种能够降解大多数内源性蛋白的多亚基复合物,它的蛋白降解作用能够影响细胞周期、转录控制和其他一些重要的细胞进程。本实验利用 PCR技术从日本血吸虫 18 d童虫中首次扩增到蛋白酶体 α2亚基基因(GenBank Accession No.AY813725),序列分析表明该基因的开放阅读框(ORF)含708 bp,编码235个氨基酸,理论分子量25.84 kDa。同源性分析结果显示,该基因为日本血吸虫蛋白酶体α2亚基,命名为SjPSMA2。实时定量PCR分析显示该基因在7 d、13 d、18 d、23 d、32 d和42 d虫体中都有表达,7 d和23 d虫体表达量低于其他几个时期。构建了该基因的原核表达质粒 pET28a(+)-SjPSMA2,在大肠杆菌系统中成功获得了表达,重组蛋白以包涵体形式存在,Western blotting显示表达产物能被日本血吸虫成虫粗抗原免疫血清所识别,并且能检测到天然状态下该蛋白的存在。应用重组蛋白免疫 BALB/c小鼠后,诱导产生了较高的特异性抗体水平及12.33%的减虫率和35.23%的肝脏减卵率。SjPSMA2基因及其表达产物的获得,为探索蛋白酶体在血吸虫生长发育中的作用提供了重要基础。
日本血吸虫;蛋白酶体α2亚基;克隆;表达;免疫保护
Abstract:The 26S proteasome is a proteolytic complex responsible for the degradation of the vast majority of eukaryotic proteins.Regulated proteolysis by the proteasome is thought to influence cell cycle progression, transcriptional control, and other critical cellular processes.A novelSchistosoma japonicumgene(GenBank Accession No.AY813725)proteasome α2 subunit(SjPSMA2)was cloned.Sequence analysis revealed that the ORF ofSjPSMA2gene contains 708 nucleotides encoding 235 aminoacids, and the molecular weight was estimated to be 25.84 kDa.Real-time PCR analysis showed that this gene expressed in 7 d, 13 d,18 d, 23 d, 32 d and 42 d schistosoma.The mRNA level ofSjPSMA2was lower in 7 d and 23 d schistosomulum than that in other stages.TheSjPSMA2cDNA fragment was subcloned into an expression vector pET28a(+)and transformed intoE.coliBL21(DE3)cells.After induction with IPTG, the 30 kDa fusion protein was produced as included bodies.Western-blotting revealed that the fusion protein could be recognized by the rabbit serum anti-Schistosoma japonicumadult worm antigen preparation, and the protein in native could be detected.After immunization of BALB/c mice with the fusion protein, the reduction rates of worm counts and liver egg counts were 12.33% and 35.23%.ELISA results revealed that the vaccinated group showed a significant increase in the level of IgG antibody.This study provided an important basis for investigating the regulation mechanism of the proteasome during the development ofSchistosoma japonnicum.
Keywords:Schistosoma japonicum, proteasome α2 subunit(PSMA2), clone, expression, immunoprotection
血吸虫病(Schistosomiasis)是由血吸虫(Schistosome)感染引起的一种分布广泛、危害严重的人畜共患寄生虫病。全球有76个国家和地区流行血吸虫病,有5~6亿人受到威胁,约2亿人感染血吸虫病[1]。
我国血吸虫病的防治虽然已经取得了巨大成就,但是全面控制血吸虫病传播的前景仍不容乐观。吡喹酮自问世以来,以其高效、低毒、使用方便、价格低廉等优点在血吸虫病临床治疗和防治工作中得到广泛应用,并成为目前治疗血吸虫病的唯一药物,20多年来,未见有新的治疗血吸虫病的药物出现[2]。然而,近年来曼氏血吸虫已经有吡喹酮抗性虫株的报道[3],耐药虫株的出现引起了人们的不安与高度关注。因此,加强抗血吸虫高效疫苗的开发和新药物靶标的筛选显得格外重要。
血吸虫童虫是在宿主体内发育早期阶段的虫体,也是虫体发育的关键阶段,虫体比较脆弱,容易受到外界影响和宿主免疫系统的攻击。血吸虫在终宿主体内从尾蚴发育到成虫,在形态和生理上都发生了很大的变化,这些变化的实现是以蛋白合成、降解途径的正常进行为基础的。假如在童虫阶段对血吸虫的蛋白降解途径进行人为干预,则有可能使血吸虫在宿主体内的蛋白降解途径受阻,继而对血吸虫之后的生长发育产生重要影响,对控制血吸虫病有着重要的意义,同时也可为抗血吸虫疫苗和潜在药物靶标的研究提供基础。
近几年,有个别学者对曼氏血吸虫蛋白酶体进行了研究[4-6],并认为它在曼氏血吸虫的生长发育中具有重要作用。但对日本血吸虫蛋白酶体α2亚基基因的研究国内外尚未有报道,对其在日本血吸虫发育和生存中的作用还是了解甚少。本研究室在前期构建的7 d童虫消减cDNA文库中,获得了一个EST序列,经生物信息学分析命名为日本血吸虫蛋白酶体α2亚基基因(SjPSMA2),本实验利用PCR技术首次克隆到编码日本血吸虫蛋白酶体 α2亚基含ORF的cDNA序列,分析了该基因在日本血吸虫不同发育阶段虫体中的表达情况,应用大肠杆菌系统表达了该基因,测定了表达产物的抗原性并在BALB/c小鼠中进行了动物免疫保护试验。
1 材料和方法
1.1 材料
1.1.1 主要试剂和酶
Trizol、逆转录酶、RNA酶抑制剂购自Invitrogen公司;Ex Taq DNA聚合酶、pMD19-T载体、T4 DNA连接酶、限制性内切酶 BamHⅠ、SalⅠ、SYBR GreenⅠ、EASY Dilution购自TaKaRa生物工程(大连)有限公司;琼脂糖凝胶DNA回收试剂盒、B型质粒小量快速提取试剂盒购自北京博大泰克生物基因技术有限责任公司;Ni-NTA HisBind Resin(Merck-Novagen)购自中科新生命生物科技有限公司;四甲基联苯胺(TMB)购自天根生化科技(北京)有限公司;硝酸纤维素膜(Whatman)购自经科宏达生物技术有限公司;山羊抗兔 IgG-HRP、山羊抗小鼠IgG-HRP购自上海鼎国生物工程公司。
1.1.2 菌种、质粒、实验动物、寄生虫及血清
pET-28a(+)质粒、大肠杆菌DH5α、BL21由本实验室保存;BALB/c小鼠(雄性,20~25 g)、新西兰白兔(雄性,2.5~3 kg)购自中国科学院上海实验动物中心;日本血吸虫中国大陆株尾蚴由中国农科院上海兽医研究所钉螺室提供;日本血吸虫成虫抗原免疫兔血清由本实验室制备。
1.2 方法
1.2.1 虫体的收集
新西兰白兔分别以腹部贴片法感染 20 000、8000、5000、2000条血吸虫尾蚴,在感染后 7 d、13 d、18 d、23 d、32 d和42 d后剖杀,以肝门静脉灌注法收集虫体,液氮冻存备用。
1.2.2 总RNA的提取
取液氮中冻存的7 d、13 d、18 d、23 d、32 d和42 d日本血吸虫各200 mg,按Trizol试剂盒说明书分别进行总RNA的提取。
1.2.3 引物设计和含ORF cDNA片段的扩增
首先从本实验室构建的7 d童虫消减cDNA文库中,获得一个EST序列,以此序列为询问序列,在日本血吸虫EST库中搜索到1个日本血吸虫的相应EST片段(GenBank Acession No.AY813725)。根据该 EST序列设计特异引物,应用 PCR技术进行cDNA片段的扩增。上游引物FP:5′-ATGGATCC AT GAGCGAACGGTA-3′(下划线处为 BamHⅠ酶切位点);下游引物 RP:5′-GCGTCGACTTATGGTATAG CTG-3′(下划线处为SalⅠ酶切位点),由上海英骏生物技术有限公司合成。取1 μL反转录得到的cDNA为模板进行PCR扩增,PCR反应条件为:94℃预变性 10 min;然后 94℃ 30 s,55℃ 30 s,72℃ 1 min,共30个循环;循环结束后72℃延伸10 min。PCR产物用琼脂糖凝胶DNA回收试剂盒进行回收,纯化后亚克隆至pMD19-T载体,转化至大肠杆菌DH5α感受态细胞,挑选单个菌落扩大培养,提取质粒进行双酶切鉴定,阳性质粒命名为pMD19-T-SjPSMA2,并送英骏生物技术有限公司测序。
1.2.4 生物信息学分析
将测序得到的cDNA在NCBI上进行同源性比对(http://www.ncbi.nlm.nih.gov/BLAST);利用DNAStar软件分析确定基因的读码框,并对氨基酸残基数目、组成、蛋白质相对分子质量(Mr)、理论等电点等参数进行分析。利用 ProtScale软件(www.expasy.ch/tools/pscale)进行蛋白质的疏水性分析。利用Clustalw软件对不同物种 PSMA2蛋白进行多重比对。抗原肽位点分析利用 DNAMAN软件,蛋白的跨膜区预测利用 DAS软件(http://www.sbc.su.se/miklos/DAS/),信号肽预测利用SignalP软件(www.cbs.dtu/services/Singnalp)。
1.2.5 荧光实时定量PCR
选择血吸虫持家基因18S rRNA为内参[7]。将提取的 7 d、13 d、18 d、23 d、32 d及 42 d虫体总 RNA,去除基因组 DNA后利用随机引物合成 cDNA第一链。SjPSMA2荧光定量 PCR 引物:FP:5′-CAGTCTG GTGGTGTTCGG-3′,RP:5′-GTCCTAATGCAGTAG CTTTCC-3′,扩增SjPSMA2基因片段长度为133 bp;18S rRNA荧光定量PCR引物FP:5′-GCAAACTGTT TCATCACCG-3′,FP:5′-CAATCCAACGACCTCACT AA-3′,片段扩增长度172 bp。引物由上海英骏生物技术有限公司合成。采用荧光染料法进行实时定量PCR,反应体系包括:2×SYBR Premix Ex TaqTM10 μL,10 μmol/L Forward Primer 0.4 μL,10 μmol/L Reverse Primer 0.4 μL,ddH2O 8.2 μL,模板 cDNA 1.0 μL,共 20 μL。反应参数:95℃ 10 s;95℃ 5 s,55℃ 10 s,72℃ 15 s,40个循环,其中72℃ 15 s结束时间为荧光信号检测点。每个反应均做3孔重复。采用Corbett Research公司Rotor-Gene软件进行计算分析,以 18S rRNA为内参标化反应结果,得出相对于每百万持家基因的目的基因含量。
1.2.6 重组表达质粒的构建
根据SjPSMA2基因的cDNA序列设计引物,在其扩增序列的5′端和3′端分别引入BamHⅠ和SalⅠ酶切位点,通过 PCR扩增得到含完整 ORF的SjPSMA2基因序列,将该序列定向克隆于原核表达载体 pET28a(+)的多克隆位点区,构建重组质粒pET28a(+)-SjPSMA2,并转化表达宿主菌BL21。
1.2.7 pET28a(+)-SjPSMA2在大肠杆菌中的表达
将鉴定好的 pET28a(+)-SjPSMA2/BL21接种于LB培养基,37℃振荡培养,OD600为 0.6时加入终浓度为1 mmol/L IPTG诱导表达,并确定最佳诱导时间和相关的表达条件。在判定其表达状况后,将以包涵体形式存在的重组蛋白溶解于8 mol/L尿素,以Ni-NTA HisBind Resin纯化,随后以含6 mol/L、4 mol/L、2 mol/L、1 mol/L尿素的PBS及PBS逐步透析,完成复性。
1.2.8 Western blotting检测
将纯化的重组蛋白进行SDS-PAGE电泳,转移到硝酸纤维素膜上,用经pET28a(+)/BL21大肠杆菌蛋白吸附的日本血吸虫成虫抗原免疫兔血清和免疫的 BALB/c小鼠血清作一抗,分别用辣根过氧化物酶标记的山羊抗兔和山羊抗小鼠IgG为二抗,TMB作为底物进行显色。
将42 d日本血吸虫虫体蛋白进行SDS-PAGE电泳,转移到硝酸纤维素膜上,用免疫的 BALB/c小鼠血清作一抗,用辣根过氧化物酶标记的山羊抗小鼠IgG为二抗,TMB作为底物进行显色。
1.2.9 ELISA检测免疫小鼠血清抗SjPSMA2重组蛋白特异性IgG抗体水平
将 30只BALB/c小鼠随机分为SjPSMA2+206佐剂组、206佐剂组、PBS组,每组10只,重组蛋白SjPSMA2的注射剂量为每次每鼠20 μg,共免疫3次,每次间隔20 d。各免疫组小鼠分别在免疫前1周和每次免疫后2周采血,使用间接ELISA方法检测抗体水平。
1.2.10 小鼠减虫率和减卵率计算
末次免疫 2周后,每只小鼠用腹部盖玻片法感染尾蚴(30±1)条。攻击尾蚴后 6周解剖小鼠,肝门静脉冲洗法收集成虫记数,同时收集每只小鼠的肝脏。称取肝组织0.5 g,剪碎后加5% NaOH 10 mL,组织匀浆器匀浆,放56℃水浴消化1 h,混匀,吸取20 μL的悬液3份,镜检计数肝组织虫卵。按以下公式计算减虫率、肝脏减卵率(EPG为平均每克肝组织中所负荷虫卵数)。
减虫率=(1−免疫组平均虫荷数/对照组平均虫荷数)×100%;
减卵率=(1−免疫组EPG/对照组EPG)×100%。
2 结果
2.1 SjPSMA2基因的克隆及生物信息学分析
本研究在对本实验室构建的7 d童虫消减cDNA文库克隆生物信息学分析[8]的基础上,挑选出一个EST序列并对其进行了深入研究。设计特异引物,应用RT-PCR技术扩增获得一个含完整开放阅读框的基因片段。利用 NCBI的 Blast软件对该基因编码的氨基酸序列进行同源性搜索,结果显示该基因编码蛋白与PSMA2家族蛋白具有高度同源性,具有十分典型的PSMA2蛋白特征。选择来自曼氏血吸虫、鲑疮痂鱼虱、鲍鱼、裂喉大马哈鱼、褐家鼠、盐湖鲑鱼、鲐、人(GenBank Accession No.分别为CAZ34242.1、ACO11852.1、ABO26645.1、ACO08660.1、AAH60576.1、ACM08632.1、NP_001019612.1、BAD96696.1)9个物种的PSMA2蛋白进行氨基酸序列的多重比对。结果显示,该基因所编码的氨基酸序列与曼氏血吸虫的 PSMA2相似性最高,达到96%(E Value=5e-131),与人PSMA2的相似性为 73%,其余相似性都在 73%~74%之间(图1)。据此,推测该基因编码的蛋白为日本血吸虫 PSMA2蛋白,命名为日本血吸虫 PSMA2(SjPSMA2)。
对该基因编码的氨基酸序列进行生物信息学分析结果表明,SjPSMA2基因的ORF为708 bp,编码235个氨基酸,理论分子量为25843.34 Da,理论等电点为5.62。该氨基酸序列的N端不具有信号肽,也不存在跨膜结构,疏水性区域分布比较均匀,并且具有多个抗原肽位点,有良好的免疫原性。
2.2 SjPSMA2基因的期别表达分析
Real time PCR分析结果表明, SjPSMA2在日本血吸虫的7 d、13 d、18 d、23 d、32 d和42 d虫体中都有表达,其中42 d虫体表达量最高,7 d和23 d童虫表达量较低(图2)。
2.3 SjPSMA2基因在大肠杆菌中的表达及蛋白纯化
重组表达质粒pET28a(+)-SjPSMA2在大肠杆菌BL21中获得表达,并且在诱导后5 h的表达量最高。SDS-PAGE电泳结果显示,重组蛋白分子量约为 30 kDa,与预期结果相符(预测分子量约为25.843 kDa,载体表达蛋白大约4 kDa)。重组蛋白以包涵体形式存在,溶解于含8 mol/L尿素的PBS。经过 Ni-NTA树脂纯化后,获得了较纯的重组蛋白,经过6 mol/L、4 mol/L、2 mol/L、1 mol/L尿素的PBS及PBS逐步透析,完成重组蛋白的复性(图3)。

图1 不同物种PSMA2基因氨基酸序列的同源性分析Fig.1 Homology analysis of the amino sequences of magonashi gene among difference species.
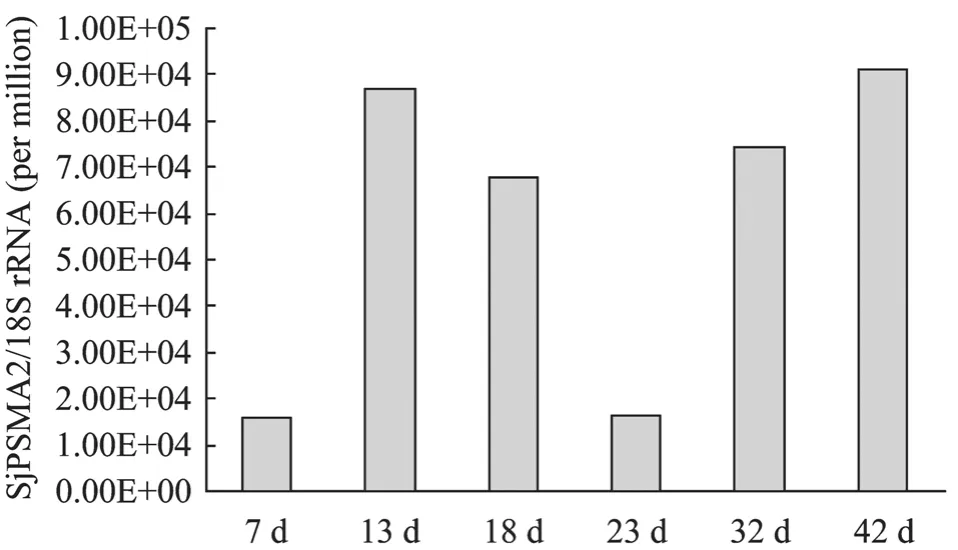
图2 荧光实时定量PCR分析Sj PSMA2基因在日本血吸虫不同阶段虫体的表达情况Fig.2 Stage differential expression of Sj PSMA2 in different stages ofSchistosoma japonicumby real-time PCR.7 d: 7 days schistosomula; 13 d: 13 days schistosomula;18 d: 18 days schistosomula; 23 d: 23 days worms; 32 d: 32 days worms; 42 d: 42 days adult worms.
2.4 表达产物抗原性的鉴定
以重组表达产物进行SDS-PAGE电泳,经电转移至NC膜上,分别用经pET28a(+)/BL21大肠杆菌蛋白吸附的日本血吸虫成虫抗原免疫兔血清和免疫的BALB/c小鼠血清作一抗进行Western blotting分析,结果在30 kDa处有一明显的识别条带(图4A、B),表明重组表达产物蛋白具有良好的抗原性。
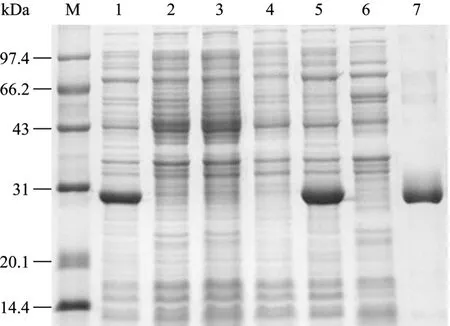
图3 SDS-PAGE分析pET28a(+)-SjPSMA2/BL21的蛋白表达情况Fig.3 SDS-PAGE analysis of the expression of pET28a(+)-SjPSMA2/BL21 inE.coli.M: low-molecular protein marker; 1,2: total extract of a clone after and before induction with 1 mmol/L IPTG; 3, 4: total extract of pET28a(+)after and before induction with 1 mmol/L IPTG; 5, 6: inclusion bodies and supernatant after lysis, respectively; 7: rSjPSMA2 purified through Ni2+-charged column chromatography and after dialysis.
将 42 d日本血吸虫虫体蛋白进行 SDS-PAGE电泳,转移到硝酸纤维素膜上,用免疫的 BALB/c小鼠血清作一抗进行Western blotting分析,结果在26 kDa处有一明显的识别条带(图4C),这与生物信息学分析的结果一致。
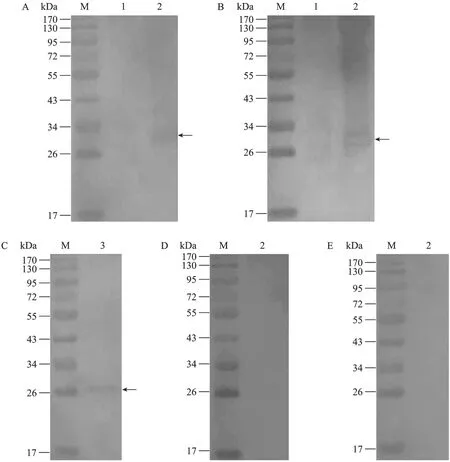
图4 pET28a(+)-SjPSMA2重组蛋白的Western blotting分析Fig.4 Western blotting analysis ofSjPSMA2expression product.M: marker; 1: expressed product of pET28a(+)-SjPSMA2uninduced.2: expressed product of pET28a(+)-SjPSMA2induced with IPTG; 3: 32-day-old adult worm crude extracts.(A)Recombinant protein was probed with the serum from rabbit immunized withSchistosoma japonicumadult worm antigen preparation;(B, C)Recombinant protein was probed with mouse serum against SjPSMA2.(D)Recombinant protein was probed with the serum from mice immunized with PBS.(E)Recombinant protein was probed with the serum from mice immunized with 206 adjuvant.
2.5 BLAB/c小鼠血清抗SjPSMA2特异性IgG抗体的检测
用间接 ELISA方法检测各组小鼠血清中抗SjPSMA2特异性 IgG抗体变化,试验结果表明,SjPSMA2免疫组小鼠在第1次免疫后就检测到较高水平的特异性抗SjPSMA2蛋白的IgG抗体,在第2次免疫后特异性IgG抗体滴度进一步升高,但变化很小,第3次免疫后达到最高。攻击尾蚴后至解剖,特异性抗体基本保持不变。佐剂对照组及空白对照组在整个实验过程中抗SjPSMA2的特异性IgG抗体滴度均未出现明显的变化(图5)。
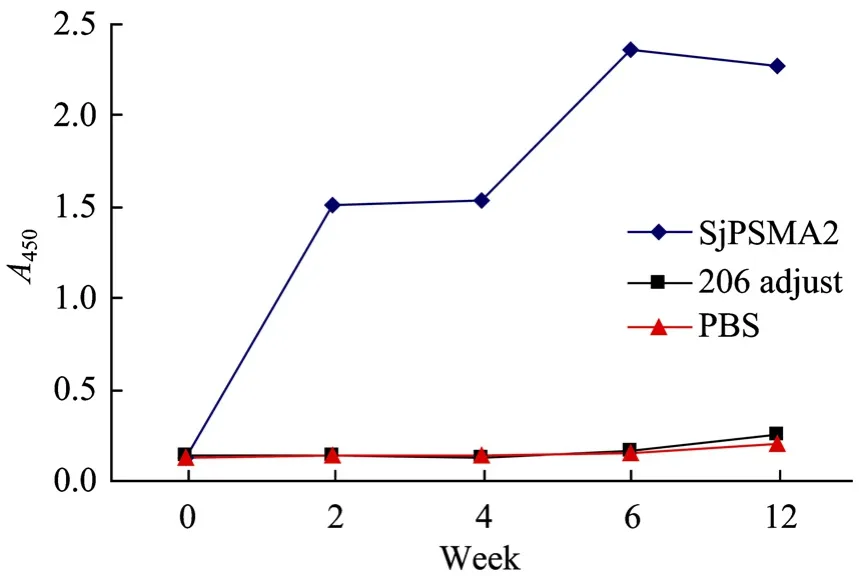
图5 BALB/c小鼠血清抗SjPSMA2抗原特异性IgG抗体水平检测结果Fig.5 Specific IgG level against SjPSMA2 in the sera of BALB/c mice by ELISA.
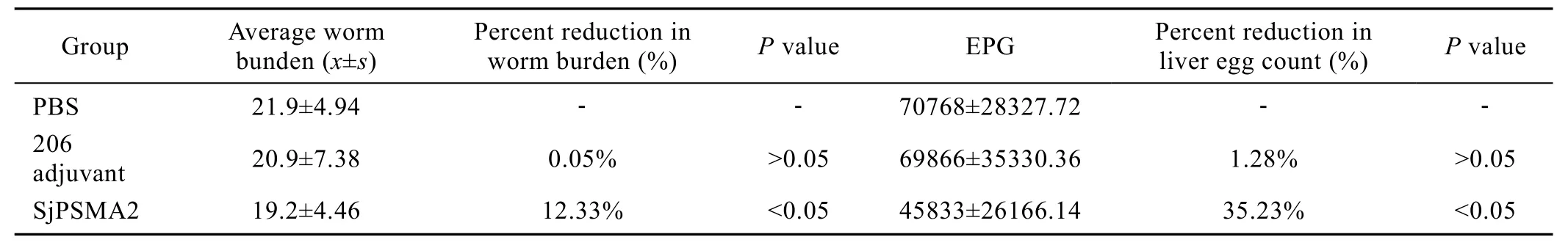
表1 BALB/c小鼠免疫保护试验结果Tab1e 1 Worm and egg counting reduction rate induced by Sj PSMA2 in BALB/c mice
2.6 免疫保护效果
疫苗免疫保护效果见表1。与PBS对照组相比,重组蛋白SjPSMA2在BALB/c小鼠中诱导了12.33%的减虫率,35.23%的肝组织减卵率,差异都显著(P<0.05)。
3 讨论
蛋白酶体(Proteasome)是一种从真菌到动物细胞中广泛存在的[9],具有多催化活性的多亚基大分子复合物,在细胞内降解多种短半衰期蛋白、错误折叠蛋白和核蛋白的细胞器,参与细胞周期、特异性基因转录、抗原处理、分泌、膜蛋白的定位和蛋白质的质量监控等许多重要的过程。蛋白酶体依赖ATP对泛素化的内源性蛋白质进行降解,它是由沉降系数为 19S的调节复合物(PA700)结合在 20S催化核心的两端而成。19S调节复合物主要起识别泛素化蛋白质[10]和调节蛋白酶体生物活性的作用[9];20S催化核心是降解蛋白质的核心部分,它是由4个圆环叠成的圆筒状颗粒,每个圆环包含7个亚基,两外环由7个不同的α亚基组成,而两内环则由7个不同的β亚基组成[11-12]。
本实验所克隆的SjPSMA2是蛋白酶体诸多亚基中的成员之一。泛素-蛋白酶体途径是细胞内除溶酶体途径之外主要的蛋白降解途径。在泛素依赖性的蛋白降解途径中,绝大多数底物的降解要先与多个泛素分子共价结合进行降解标记,泛素偶联的蛋白被蛋白酶体识别并迅速降解。蛋白酶体广泛地存在于酵母、果蝇、吸虫以及小鼠等生物中,但至今对日本血吸虫蛋白酶体的研究国内外还没有报道。蛋白酶体的α亚基既可以自身装配成环,也为β环装配所必需,并提供了蛋白酶体活化因子 PA700和PA28的结合位点;同时α亚基位于20S蛋白酶体的入口处,一方面能控制蛋白质的进入,另一方面又能阻止部分水解的底物从活性位点释放,这些都说明α亚基可能在蛋白酶体的结构和功能中起着重要的作用。血吸虫从尾蚴侵入终宿主体内到发育为成虫,在大小、形态、生物学和生理学等方面都发生了很大变化,这些变化的实现以大量内源性蛋白的降解为基础,而蛋白酶体又在这一过程中起着重要的作用。通过对蛋白酶体结构和功能的深入研究,了解各亚基的作用及相互之间的关系,将会对整个蛋白酶体在血吸虫蛋白降解、生长发育中所起的作用有更深的认识。因此,SjPSMA2基因的成功克隆表达具有重要意义。
研究已表明,蛋白酶体在寄生原虫的发育过程中是非常重要的。Shaw等[13]用蛋白酶体抑制剂乳胞素、MG-132作用弓形虫,虫体的生长很快受到抑制,而它的子代芽孢的形成和释放也受到阻碍;Diego等[14]用乳胞素处理克氏锥虫,能够阻止其从有鞭毛体转变为无鞭毛体;Makioka等[15]用乳胞素处理内阿米巴原虫,发现其包囊期被阻断;Lindenthal等[16]报道,用乳胞素处理过的疟原虫,从红细胞外进入到红细胞内的过程被阻断。对曼氏血吸虫的研究表明,通过使用蛋白酶体抑制剂[5]或者进行RNAi[6]敲除蛋白酶体的一个亚基,都能明显地阻断蛋白降解的途径,从而导致曼氏血吸虫在体外和宿主体内不能进一步发育。因此,如果通过人为干预抑制α2亚基的表达或者以该亚基作为药物靶标,是否会引起蛋白酶体20S催化核心结构发生改变,进而影响其功能的发挥,不能正常的进行蛋白降解,并使血吸虫的生长发育受到抑制,从而减轻血吸虫病病理损伤及减少传染源扩散。
本实验的研究结果表明SjPSMA2基因在日本血吸虫感染宿主后第 7、13、18、23、32、42天都有表达,在13 d到18 d这个阶段表达水平都比较高,这个时期正好是日本血吸虫个体大小变化较大的阶段,蛋白代谢比较旺盛,在32~42 d这个阶段,虫体逐步发育成熟并且开始产卵,新陈代谢旺盛,该基因的表达变化特点可能与血吸虫生长发育和繁殖有一定的关系,从侧面揭示了SjPSMA2基因在血吸虫生长发育中的重要作用。Western blotting结果表明该重组表达产物具有良好的抗原性,用SjPSMA2重组抗原免疫 BALB/c小鼠后,可诱导小鼠体内的抗重组抗原的特异性IgG抗体迅速产生,并且维持在一个较高的水平。初步动物免疫实验表明,用重组蛋白免疫诱导了12.33%的减虫率和35.23%的肝组织减卵率。特异性抗体在杀伤虫体中可能起了一定的作用,也暗示该重组蛋白具有发展为抗血吸虫病候选疫苗及新药靶的潜力和深入研究的价值。
本研究首次克隆和表达了SjPSMA2基因,为探索蛋白酶体在血吸虫蛋白代谢、生长发育、繁殖过程中所起的作用以及开发高效的抗血吸虫病疫苗和筛选新型的抗血吸虫药物都奠定了重要基础。
REFERENCES
[1]Engels D, Chitsulo L, Montresor A,et al.The global epidemiological situation of schistosomiasis and new approaches to control and research.Acta Trop, 2002, 82(2):139−146.
[2]Cioli D.Chemotherapy ofSchistosomiasis: an update.Parasitol Today, 1998, 14(10): 418−422.
[3]Ismail M, Metwally A, Farghaly A,et al.Characterization of isolates ofSchistosoma mansonifromEgyptian villagersthat tolerate high doses of praziquantel.Am J Trop Med Hyg, 1996, 55(2): 214−218.
[4]Ram D, Ziv E, Lantner F,et al.Interaction of the proteasome S5a/Rpn10 multiubiquitin-binding protein and the 8 kDa calcium-binding protein ofSchistosoma mansoni.Parasitology, 2003, 127(4): 337−347.
[5]Guerra-Sa R, Castro-Borges W, Evangelista EA,et al.Schistosoma mansoni: functional proteasomes are required for development in the vertebrate host.Exp Parasitol,2005, 109(4): 228−236.
[6]Joseph FN, Fouad ES, Nicholas P,et al.The 26S proteasome inSchistosoma mansoni: bioinformatics analysis, developmental expression, and RNA interference(RNAi)studies.Exp Parasitol, 2007, 117(3): 337−347.
[7]Hoffmann KF, Johnston DA, Dunne DW.Identification ofSchistosoma mansonigender-associated gene transcripts by cDNA microarray profiling.Genome Biol, 2002, 3(8):1−12.
[8]Wang XZ, Gobert GN, Feng XG,et al.Analysis of early hepatic stage schistosomula gene expression by subtractive expressed sequence tags library.Mol Biochem Parasitol, 2009, 166(1): 62−69.
[9]Coux O, Tanaka K, Goldberg F.Structure and functions of the 20S and 26S proteasomes.Ann Rev Biochem, 1996, 65:801−847.
[10]Van Nocker S, Deveraux Q, Rechsteiner M,et al.ArabidopsisMBP1 gene encodes a conserved ubiquitin recognition component of the 26S proteasome.Proc Natl Acad Sci USA, 1996, 93(2): 856−860.
[11]Grziwa A, Baumeister W, Dahlmann,et al.Localization of subunits in proteasomes fromThermoplasma acidophilumby immunoelectron microscopy.FEBS Lett, 1991,290(1/2): 186−190.
[12]PuNer G, Weinkauf S, Bachmann L,et al.Subunit stoichiometry and three-dimensional arrangement in proteasomes from Thermoplasma acidophilum.EMBO,1992, 11(4): 1607−1616.
[13]Shaw MK, He CY, Roos DS,et al.Proteasome inhibitors block intracellular growth and replication ofToxoplasma gondii.Parasitology, 2000, 121(1): 35−47.
[14]De Diego JL, Katz JM, Marshall P,et al.The ubiquitin-proteasome pathway plays an essential role in proteolysis duringTrypanosoma cruziremodeling.Biochemistry, 2001, 40(4): 1053−1062.
[15]Makioka A, Kumagai M, Ohtomo H,et al.Effect of proteasome inhibitors on the growth, encystation, and excystation ofEntamoeba histolyticaandEntamoeba invadens.Parasitol Res, 2002, 88(5): 454−459.
[16]Lindenthal C, Weich N, Chia YS,et al.The proteasome inhibitor MLN-273 blocks exoerythrocytic and erythrocytic development ofPlasmodium parasites.Parasitology, 2005, 131(1): 37−44.
Cloning, expression and characterization of a gene encoding α2 subunit of the proteasome in Schistosoma japonicum
Yang Hong1,2, Hongxiao Han1,2, Jinbiao Peng1, Ye Li1, Yaojun Shi1, Zhiqiang Fu1, Jinming Liu1,Xiangrui Li2, and Jiaojiao Lin1
1 Key Laboratory of Animal Parasitology, Ministry of Agriculture, Shanghai Veterinary Research Institute, Chinese Academy of Agricultural Science,Shanghai 200241, China 2 College of Veterinary Medicine, Nanjing Agricultural University, Nanjing 210095, China
Received:December 16, 2009;Accepted:January 28, 2010
Supported by:National Natural Science Foundation of China(No.30671581), National Basic Research Program of China(973 Program)(No.2007CB513108), National High Technology Research and Development Program of China(863 Program)(No.2006AA10A207), National Key Technology Research and Development Program of China(No.2006BAD06A09).
Corresponding author:Jiaojiao Lin.Tel: +86-021-34293440; E-mail: jjlin@shvri.ac.cn国家自然科学基金(No.30671581),国家重点基础研究发展计划项目(973计划)(No.2007CB513108),国家高技术研究发展计划(863计划)(No.2006AA10A207),国家科技支撑计划(No.2006BAD06A09)资助。
