鸡氨肽酶N的高效可溶性表达及生物学功能分析
2010-10-16尹鑫刘澜澜贾莹明晓波张颖李甜甜魏萍
尹鑫,刘澜澜,贾莹,明晓波,张颖,李甜甜,魏萍
东北农业大学动物医学学院,哈尔滨 150030
鸡氨肽酶N的高效可溶性表达及生物学功能分析
尹鑫,刘澜澜,贾莹,明晓波,张颖,李甜甜,魏萍
东北农业大学动物医学学院,哈尔滨 150030
本研究旨为克隆鸡氨肽酶 N(chAPN)基因,高效表达可溶性目的蛋白,并测定其生物学功能。应用 RT-PCR方法从鸡胚肾细胞中克隆chAPN的基因片段,经测序鉴定后再克隆至原核表达载体pCOLD-TF,构建重组原核表达质粒pCOLD-TF-chAPN,在大肠杆菌BL21(DE3)中经不同条件诱导表达目的蛋白;利用镍柱亲和层析法纯化可溶性蛋白,并进行SDS-PAGE、Western blotting鉴定;Leu-PNA酶促反应和ELISA等方法检测目的蛋白生物学功能。结果显示,重组质粒pCOLD-TF-chAPN在大肠杆菌中以可溶形式高效表达;酶促反应及ELISA结果显示该蛋白具有酶活性,可结合传染性支气管炎病毒(IBV),并表现为剂量依赖性。这为今后研究chAPN的酶活性、作为IBV受体及抗病毒功能奠定了实验基础。
鸡氨肽酶N,可溶性,酶活性
Abstract:To clone and express the gene encoding chicken aminopeptidase N(chAPN), and analysis the biological function of chAPN expressed inEscherichia coli(E.coli).The chAPN gene was amplified by RT-PCR from the kidney cells of chicken embryo and then cloned into the prokaryotic expression vector pCOLD-TF.Recombinant expression plasmid of pCOLD-TF-chAPN was constructed and then transformed into the competentE.coliBL21(DE3)cells for expression under different conditions such as induction time and inductor concentrations.Purified soluble recombinant chAPN was obtained by Ni-NTA His Bind Resin affinity chromatography and identified by SDS-PAGE gel and Western blotting assay.Its biological function was detected by its reaction with Leu-PNA and Enzyme-Linked Immunosorbent Assay(ELISA).The results showed that the expression product of chAPN gene inE.coliwas soluble.It was able to bind infectious bronchitis virus(IBV)dose-dependently.In conclusion, chAPN gene has been successfully cloned and expressed inE.coli, which will establish a basis for further research the enzymatic activity and antiviral function.
Keywords:chAPN, solubility, enzymatic activity
氨肽酶N(APN),是一种Ⅱ型金属蛋白酶,主要分布于肾、小肠、呼吸道上皮细胞、粒细胞、单核细胞、成纤维细胞、内皮细胞、血脑屏障处的脑外膜细胞以及中枢神经系统突触膜等处[1-2],具有促进血管生发[3]、酶解多肽、充当病毒细胞受体、介导信号转导[1]等多种生物学功能。在冠状病毒属中,APN可作为多种病毒的细胞受体[4],如猪传染性胃肠炎病毒(TGEV)[5]、猫传染性腹膜炎病毒(FIPV)[6]、猫冠状病毒(FCoV)[7]、犬冠状病毒(CCoV)[6]及人冠状病毒(HCoV-229E)[8]等的受体。研究表明,鸡氨肽酶 N(chAPN)可作为鸡传染性支气管炎病毒(IBV)的细胞受体[9],同时在鸡胚发育过程发挥重要作用[10]。而国内外未见该蛋白高效可溶性表达,对其生物学功能研究也极少。本研究成功扩增了chAPN的全基因,构建了重组表达质粒pCOLD-TF-chAPN,实现了chAPN的高效、可溶性表达,并探讨了表达产物的生物学功能,为今后进一步开展相关研究奠定了基础。
1 材料与方法
1.1 实验材料
1.1.1 毒株、菌株、质粒及血清
IBV M41株由中国农业科学院哈尔滨兽医研究所刘胜旺研究员馈赠;pCOLD-TF由本研究室保存;大肠杆菌DH5α、BL21(DE3)由本研究室保存;兔抗IBV M41血清由本研究室制备保存。
1.1.2 主要仪器与试剂
fast 200 总 RNA提取试剂盒购于 Fastgene公司;Wizard Purification Plasmid DNA Purification System 购自Promega公司;质粒小量提取试剂盒购于宝泰克公司;氨苄青霉素购于Amersco公司;IPTG(Dioxane free)、M-MLV 反转录酶、Oligo(dT)18、dNTPs、RNase Inhibitor、pMD 18-T Simple 载体、T4 DNA连接酶、EcoRⅠ、SalⅠ等均购于 TaKaRa公司;蛋白纯化试剂盒购于Novagen公司;辣根过氧化物酶(HRP)标记羊抗兔IgG购于Sigma公司。
1.1.3 引物
根据 GenBank上已登录的鸡氨肽酶 Ey序列(Accession No.D87992)及pCOLD-TF多克隆位点设计引物如下:chAPN-Up:5′-GAATTC ATGGCAG CCGGCTTCTTCAT-3′(下划线处为 EcoRⅠ酶切位点);chAPN-Down:5′-GTCGAC GGCTAGCTGGAGG CGGTCTC-3′(下划线处为 SalⅠ酶切位点),用以扩增chAPN基因序列。引物由上海生工有限公司合成,预期扩增目的片段为2906 bp。
1.1.4 鸡胚
18 d鸡胚购于东北农业大学孵化场。
1.2 chAPN基因的克隆与鉴定
1.2.1 鸡胚肾组织的处理及总RNA提取
无菌采集18 d鸡胚肾组织,液氮研磨后,按照Fastgen公司fast 200总RNA提取试剂盒说明书上的操作方法提取总RNA。
1.2.2 chAPN cDNA第一链的合成
取 10 μL 上述提取的 RNA 与 2 μL Oligo(dT)18,混匀,65℃水浴10 min,立即置冰上2 min。然后加入 4 μL 5×buffer,2 μL dNTP Mix,1 μL RNase Inhibitor,1 μL M-MLV,共 20 μL 体系,混匀,42℃水浴60 min,得到cDNA,−20℃保存备用。
1.2.3 chAPN全长基因扩增
以上述合成的 cDNA第一链为模板,扩增chAPN基因片段。PCR反应条件:95 ℃ 5 min ;94℃50 s,61.6 ℃ l min ,72 ℃ 3 min,30个循环;72℃20 min。反应结束后对PCR产物进行琼脂糖凝胶电泳检测。
1.2.4 chAPN基因的克隆
将PCR产物用DNA琼脂糖凝胶回收试剂盒纯化后与 pMD 18-T Simple载体连接,转化 E.coli DH5α感受态细胞,LB平板(AMP抗性)过夜培养筛选,挑选单菌落,振荡培养后用质粒小量提取试剂盒提取质粒,PCR和 EcoRⅠ、SalⅠ双酶切及EcoRⅠ单酶切鉴定均为阳性的质粒送上海生工生物工程技术服务有限公司测序,进一步测序鉴定正确的阳性重组质粒命名为PMD 18-T-chAPN。
1.3 chAPN原核表达载体的构建与鉴定
EcoRⅠ和 Sal Ⅰ双酶切阳性重组质粒 PMD 18-T-chAPN,切出chAPN目的基因,同时用EcoR Ⅰ和Sal Ⅰ双酶切pCOLD-TF空载体;经DNA琼脂糖凝胶回收试剂盒分别回收 chAPN目的基因和pCOLD-TF空载体部分;在T4 DNA连接酶作用下16℃连接过夜,连接产物转化E.coli DH5α感受态细胞,涂布含Amp的LB 平板,37℃培养箱过夜,挑取单菌落,振荡培养后用质粒小量提取试剂盒提取质粒,进行PCR鉴定及EcoR I单酶切、EcoR I/Sal I双酶切鉴定,鉴定均为阳性的质粒送 TaKaRa公司测序,进一步测序鉴定正确的阳性重组质粒命名为pCOLD-TF-chAPN。
1.4 chAPN的诱导表达及SDS-PAGE分析
将测序正确的阳性表达重组体质粒转化至感受态E.coli BL21(DE3),随机挑取Amp抗性单菌落,接种于5 mL含Amp的LB和SOC培养液中,37℃振荡培养过夜,次日按1:100比例接种于10 mL含Amp新鲜LB和SOC培养基,37℃剧烈振摇至菌液OD600为0.5~0.7,15℃预冷培养物30 min后,加入终 浓 度 为 0.1~2.0 mmol/L 的 Isopropylthio-β-D-galactoside(IPTG),15℃低温诱导表达,分别于4、8、12、24、36、48 h取等量菌液,4℃、5000 r/min离心10 min,收集菌体。于冰浴中超声波破碎菌体,超声时间10 s,间隔时间10 s,功率300 W,破碎10 min。裂解菌液于4℃、12 000 r/min离心10 min,取等量上清液和沉淀,进行8% SDS-PAGE电泳,用考马斯亮蓝染色,观察蛋白表达结果。Bandscan软件分析不同诱导表达条件下目的蛋白相对表达量。
1.5 chAPN表达产物的亲和纯化
取3 g诱导表达菌用20 mL的非变性纯化裂解液超声破碎,4℃、12 000 r/min离心15 min,取上清进行蛋白纯化。层析柱预先用Binding Buffer平衡10倍柱体积,上样后用Binding Buffer洗至基线,然后用 6倍柱体积的 Wash Buffer(500 mmol/L NaCl,20 mmol/L Tris,80 mmol/L 咪唑,pH 7.9)洗去非特异吸附蛋白,最后以Elute Buffer(500 mmol/L NaCl,20 mmol/L Tris,1 mol/L 咪唑,pH 7.9)洗脱特异性结合的融合蛋白,收集洗脱液。纯化目的蛋白经蛋白纯化仪脱盐处理后,将其超滤浓缩,以Bradford法蛋白浓度检测试剂盒测定蛋白浓度,即得到最终的目的蛋白。利用8% SDS-PAGE电泳检测纯化产物。
1.6 Western blotting分析
取纯化的重组蛋白样品作SDS-PAGE分析,将凝胶内蛋白条带转印至硝酸纤维素(NC)膜上,用5%脱脂奶粉 4℃封闭过夜后,将膜放置于鼠抗 His单抗(1∶2000)中,37℃温育2 h;再加入辣根过氧化物酶标记的山羊抗鼠IgG(1∶5000)于37℃孵育60 min,DAB避光显色。
1.7 氨肽酶活性的测定
参照Blackmon等[11]的方法。取1 mL不同稀释浓度的纯化目的蛋白,加入1 mL Tris-NaCl Buffer,50 μL Leu-PNA中,37℃水浴 1 h,再加入 0.1 mL 0.4 mol/L Na2CO3使反应终止,在410 nm波长下测定各测定管的吸光度值(OD410),同时取1 mg蛋白质所在相同的体积加入1 mL Tris-NaCl Buffer,50 μL Leu-PNA,0.1 mL 0.4 mol/L Na2CO3作为标准液,每次试验至少重复测定3次,以3次平行试管的算术平均值表示,比较不同浓度表达蛋白与Leu-PNA反应后OD410的差异性。
1.8 ELISA检测chAPN与IBV的结合能力
用不同稀释度的纯化目的蛋白包被酶标板,4℃包被16 h,PBST洗涤3次;经1% BSA于37℃封闭30 min后加入倍比稀释IBV尿囊液进行方阵滴定,37℃孵育60 min;加入兔抗IBV多抗血清(1∶8000),37℃孵育60 min,洗涤后加入新鲜稀释的酶标羊抗兔IgG,37℃孵育60 min,TMB显色后检测450 nm波长OD值,同时设阴性对照及空白对照。
2 结果
2.1 chAPN全长基因的克隆和鉴定
利用合成引物以鸡胚肾细胞的cDNA第一链为模板进行PCR扩增,并将扩增产物克隆到pMD 18-T Simple载体中,经琼脂糖凝胶电泳分析,在2906 bp处有特异性的单一条带(图1),与预期大小一致,将该chAPN基因序列提交GenBank(Accession No.GU223212)。
2.2 chAPN基因原核表达载体的构建与鉴定
以 EcoRⅠ和 SalⅠ双酶切含有 chAPN基因的pMD 18-T Simple,回收目的基因片段,插入pCOLD-TF载体的相同酶切位点获得重组表达质粒pCOLD-TF-chAPN,以重组质粒进行 EcoRⅠ单酶切、EcoRⅠ/SalⅠ双酶切后琼脂糖凝胶电泳分析,结果得到长约2906 bp的片段(图2),阳性克隆测序并分析后证实基因插入位置、方向、读码框均正确。
2.3 表达产物SDS-PAGE鉴定及可溶性分析
SDS-PAGE电泳结果显示,在约160 kDa处出现特异性目的条带,大小与预期相符,而空菌及空载体对照无此特异性条带(图3);经蛋白可溶性分析看出,融合蛋白90%以上以可溶形式表达(图4)。
2.4 chAPN非变性纯化及Western blotting检测
菌体裂解上清液中融合蛋白经亲和层析纯化后,SDS-PAGE结果显示,出现160 kDa的蛋白带,与预期蛋白的大小一致(图5),经凝胶薄层扫描分析,其纯度大于 95%。经 Bradford法定量纯化的chAPN蛋白浓度为4.8 mg/mL。Western blotting分析鉴定,显示获得良好带 His标签目的蛋白,表明获得高表达量的目的蛋白(图6)。

图1 鸡氨肽酶N重组质粒的鉴定Fig.1 Identification of the recombinant chicken aminopeptidase N plasmid.M: DNA marker; 1: identification of the recombinant chAPN plasmid by PCR; 2: pMD18-T-chAPN digested withEcoR I; 3: pMD18-T-chAPN digested withEcoR I andSalI.

图2 pCOLD-TF-chAPN表达载体的构建与鉴定Fig.2 Construction and identification of the recombinant pCOLD-TF-chAPN.M: DNA marker; 1: PCR identification of pCOLD-TF-chAPN; 2: pCOLD-TF-chAPN digested withEcoR I;3: pCOLD-TF-chAPN digested withEcoR I andSalI.

图3 SDS-PAGE分析鸡氨肽酶N在pCOLD-TF表达系统中的表达Fig.3 SDS-PAGE analysis of the recombinant chAPN in pCOLD-TF system.M: protein marker; 1: whole fraction of recombinants with pCOLD-TF-chAPN; 2–3: the supernatant of sonicated recombinants with pCOLD-TF-chAPN; 4: control; 5:the supernatant of sonicated recombinants with pCOLF-TF.
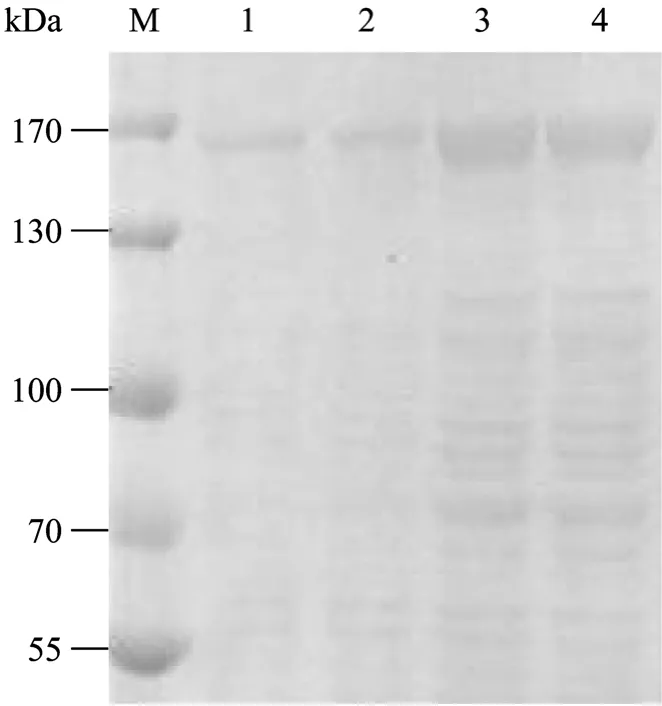
图4 表达产物的可溶性分析Fig.4 Solubility analysis of the expressed product.M: protein molecular weight marker; 1–2: sediment of sonicated recombinants with pCOLD-TF-chAPN; 3–4: supernatant of sonicated recombinants with pCOLD-TF-chAPN.

图5 SDS-PAGE分析Ni-NTA亲和层析纯化的鸡氨肽酶NFig.5 SDS-PAGE analysis of purified recombinant chAPN.M: protein marker; 1: the purified recombinant chAPN.
2.5 不同诱导条件下目的蛋白的表达量分析
SDS-PAGE电泳分析不同诱导条件下目的蛋白的表达量,通过Bandscan软件分析目的蛋白表达相对量,结果显示:pCOLD-TF-chAPN BL21(DE3)在SOC培养基中,IPTG终浓度为0.1 mmol/L,诱导表达时间为24 h时目的蛋白产量最高(图7、8)。
2.6 蛋白酶活性的测定
氨肽酶N可特异性作用于Leu-PNA底物,释放出黄色的对硝基苯胺,在410 nm下有最大吸光度。结果显示,随着表达蛋白浓度梯度性的变化,OD410也呈现梯度性变化(图9),结果表明,表达蛋白具有酶活性。
2.7 ELISA检测结果

图6 Western blotting鉴定鸡氨肽酶NFig.6 Western blotting analysis of recombinant chAPN.1: the purified recombinant chAPN reacted with anti-His mAb; M:protein marker.
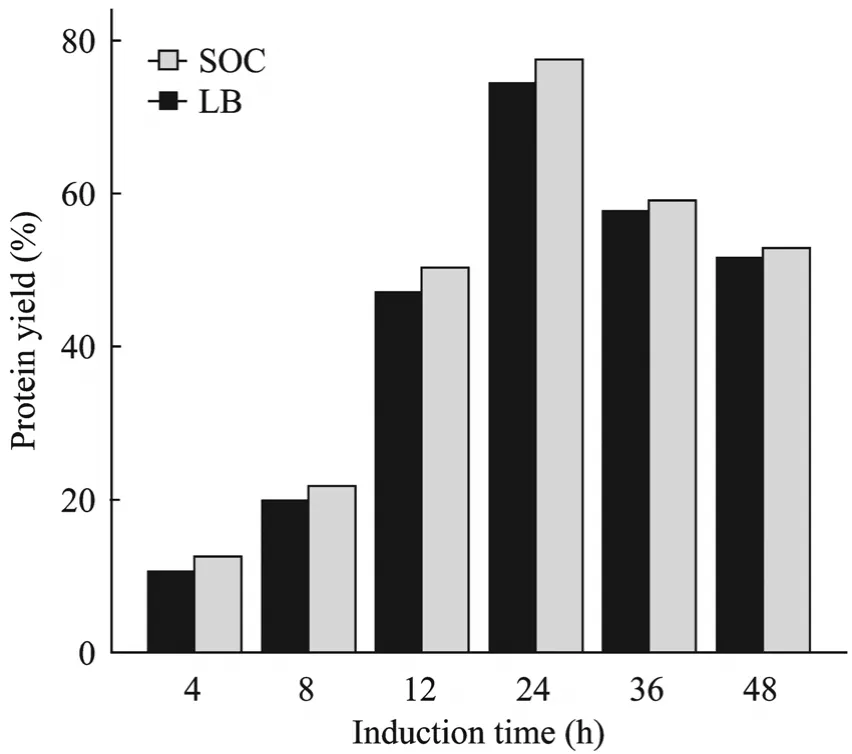
图7 不同诱导时间目的蛋白表达相对量Fig.7 Relative yield of the recombinant chAPN in different stages.

图8 不同IPTG浓度目的蛋白表达相对量Fig.8 The relative yield of recombinant chAPN in different concentrations of IPTG.

图9 不同稀释度的鸡氨肽酶N酶活性测定结果Fig.9 Enzymatic activity of the expressed chAPN at different dilution rates.
用不同浓度的chAPN包被酶标板,同时设立阴性对照与空白对照,结果表明,表达目的蛋白与IBV具有较好的结合能力,P/N值均大于 3,证明了chAPN作为IBV 受体的可能性。方阵滴定显示,最佳纯化目的蛋白稀释浓度为1∶640,最佳病毒稀释浓度为1∶1600。
3 讨论
鸡氨肽酶N是一种Ⅱ型金属蛋白酶,Ichishima等从鸡卵黄中分离到,并将其命名为氨肽酶Ey[12]。Sihn等研究证明chAPN在鸡胚胚胎发育过程中发挥着重要作用[10],目前研究表明,chAPN可介导鸡传染性支气管炎病毒(IBV)感染非易感细胞,可能作为IBV的功能性受体[13];本研究从鸡胚肾组织中克隆到表达chAPN的全长大小约2906 bp的目的基因,经PCR及酶切鉴定阳性后测序结果与公布序列符合率达99.48%,为深入研究chAPN的生物学功能创造了条件。
明晓波及陈汉阳利用pET-28a、pET-32a原核表达载体表达了chAPN,但是表达的融合蛋白主要以包涵体形式存在,需对包涵体成分进行繁琐的变性复性处理,而且活性蛋白回收率低[13-14]。本研究选用pCOLD-TF低温调控原核表达载体进行表达,由于pCOLD-TF带有可溶标签TF(Trigger factor),能促使融合蛋白最大限度地以可溶形式存在,同时该原核表达载体带有冷休克蛋白A(Cold shock protein A),能使重组菌在15℃条件下低温诱导表达,在该条件下,非目的蛋白表达受到抑制,而融合蛋白的表达量、纯度、活性得到相应的提高。本研究通过摸索优化诱导表达条件,如IPTG浓度、诱导时间、培养基等,提高了目的蛋白的表达量。
Leu-PNA酶促反应结果显示,该表达蛋白具有酶活性,呈现剂量依赖性,但chAPN的性质(最适温度、最适pH值、最适底物浓度、金属离子等)对酶活性的影响有待进一步研究。Miguel等认为猫氨肽酶N可能作为IBV的受体[15],但Victor等否定了前者的结论[16]。目前研究显示,chAPN可作为IBV的功能性受体,为了进一步验证 chAPN 作为 IBV功能性受体的可能性,本研究通过体外结合试验检测chAPN与IBV结合能力,通过优化反应条件,显示chAPN能够特异性结合IBV,且存在剂量依赖性,这与陈汉阳[14]的结果相一致,进一步表明chAPN是IBV功能性受体之一。chAPN及其抗体的抗病毒活性,chAPN是否可作为其他冠状病毒的功能性受体,其是否与不同血清型的IBV的组织嗜性存在一定的关系,将有待进一步研究。本研究选用 pCOLD-TF原核表达载体高效表达了chAPN,对该诱导表达条件进行了摸索;对表达蛋白的酶活性、生物学功能进行了探讨,为进一步研究chAPN的生物学功能奠定了基础。
REFERENCES
[1]Albiston AL.Membrane bound members of the M1 family: more than aminopeptidases.Protein Pept Lett,2004, 11: 491−500.
[2]Jeffery CJ.Moonlighting proteins: old proteins learning new tricks.Trends Genet, 2003, 19: 415−417.
[3]Fukasawa K, Hideji F, Yurka S,et al.Aminopeptidase N(APN/CD13)is selectively expressed in vascular endothelial cells and plays multiple roles in angiogenesis.Cancer Lett, 2006, 243: 135−143.
[4]Paul SM.The molecular biology of coronavirues.Adv Virus Res, 2006, 66: 193−292.
[5]Delmas B, Gelfi J, Haridon R,et al.Aminopeptidase N is a major receptor for the entero-pathogenic coronavirus TGEV.Nature, 1992, 357: 417−420.
[6]Hegyi A, Kolb AF.Characterization of determinants involved in the feline infectious peritonitis virus receptor function of feline aminopeptidase N.Gen Virol, 1998, 79:1387−1391.
[7]Tresnan DB, Levis R, Holmes KV.Feline aminopeptidase N serves as a receptor for feline, canine, porcine, and human coronaviruses in serogroup I.Virol, 1996, 70:8669−8674.
[8]Nomura, R.Human coronavirus 229E binds to CD13 in rafts and enters the cell through caveolae.Virol, 2004, 78:8701−8708.
[9]Zeng XW.Analysis on the diversity of tissue tropism of IBV strains and studies on IBV induces apoptosis.Harbin:Northeast Agricultural University, 2006: 79−81.曾祥伟.IBV组织嗜性差异分析及其诱导细胞凋亡的研究.哈尔滨: 东北农业大学, 2006: 79−81.
[10]Sihn G, Savary K, Michaud A,et al.Aminopeptidase N during the ontogeny of the chick.Differentiation, 2006,74: 119−128.
[11]Blackmon DL, Watson AJ, Montrose MH.Assay of apical membrane enzymes based on fluorogenic substrates.Anal Biochem, 1992, 200: 352−358.
[12]Ichishima E, Yamagata Y, Chiba H,et al.Soluble and bound forms of aminopeptidase from hen’s egg yolk.Agric Biol Chem, 1989, 53: 1867−1872.
[13]Ming XB.Tissue quantitation and expression of chicken APN and its potentiality as IBV receptor evaluation.Harbin: Northeast Agricultural University, 2009: 30–35.明晓波.鸡APN组织定量、表达及其作为IBV受体可能性评价.哈尔滨: 东北农业大学, 2009: 30−35.
[14]Chen HY.Study on infection HeLa cells by infectious bronchitis virus and identification of viral natural receptor.Wuhan: Huazhong Agricultural University, 2007: 95–99.陈汉阳.鸡传染性支气管炎病毒感染 HeLa细胞的研究及其天然受体的鉴定.武汉: 华中农业大学, 2007:95−99.
[15]Miguel B, Pharr GT, Wang C,et al.The role of feline aminopeptidase N as a receptor for infectious bronchitis virus.Arch Virol, 2002, 147: 2047−2056.
[16]Victor C, Lisa J, Jed M,et al.Feline aminopeptidase N is not a functional receptor for avian infectious bronchitis virus.J Virol, 2007, 4: 113−128.
Expression and biological function analysis of chicken aminopeptidase N
Xin Yin, Lanlan Liu, Ying Jia, Xiaobo Ming, Ying Zhang, Tiantian Li, and Ping Wei
College of Veterinary Medicine, Northeast Agricultural University, Harbin 150030, China
Received:October 27, 2009;Accepted:March 8, 2010
Supported by:Scientific Research Fund of Heilongjiang Provincial Education Department(No.2003fz012), Program for Innovative Research Team of Northeast Agricultural University(No.CXT-006-4-1).
Corresponding author:Ping Wei.Tel: +86-451-55190125; Fax: +86-451-55190463; E-mail: weiiping@yahoo.com.cn黑龙江省教育厅科学技术研究项目(No.2003fz012),东北农业大学创新团队课题(No.CXT-006-4-1)资助。
Received:September 25, 2009;Accepted:February 25, 2010
Supported by:National Natural Science Foundation of China(Nos.30571745, 30972772).
Corresponding author:Junjie Xu.Tel/Fax: +86-10-63815273; E-mail: xujunjie@sina.com Wei Chen.E-mail: cw789661@yahoo.com国家自然科学基金项目(Nos.30571745, 30972772)资助。
