分支杆菌噬菌体D29 Lysin B的表达、纯化及酶学性质分析
2010-10-16侯丽丽郝丽梅祁建城杨革
侯丽丽,郝丽梅,祁建城,杨革
1 曲阜师范大学生命科学学院,曲阜 273165 2 军事医学科学院卫生装备研究所 国家生物防护装备工程技术研究中心,天津 300161
分支杆菌噬菌体D29 Lysin B的表达、纯化及酶学性质分析
侯丽丽1,2,郝丽梅2,祁建城2,杨革1
1 曲阜师范大学生命科学学院,曲阜 273165 2 军事医学科学院卫生装备研究所 国家生物防护装备工程技术研究中心,天津 300161
克隆表达噬菌体D29 LysinB(LysB)并对其酶学性质进行研究。以噬菌体D29基因组为模板,用PCR方法扩增lys B基因,与表达载体pET22b连接,将重组质粒转化至Escherichia coliBL21(DE3)中表达,镍柱亲和层析(Ni-NTA)纯化可溶性表达产物,并对重组蛋白的活性进行分析检测。结果表明:成功构建了pET22b-lysB表达载体,并从1 L的LB培养物中获得了33.2 mg高纯度重组蛋白(His-LysB);His-LysB具有分解脂肪的能力,属于脂肪酶;生物化学特性分析表明:丁酸对硝基苯(pNPB)为水解底物,His-LysB热稳定性不佳,30℃以下比较稳定,随着温度的升高,稳定性逐渐降低;该蛋白具有较高的pH值适应性,pH 5.0~9.5范围内稳定性较高;在23℃和pH 7.5时酶活力最高,其比酶活为1.3 U/mg;金属离子Zn2+、Cu2+、Mg2+、Mn2+和苯甲基磺酰氟(PMSF)抑制剂对酶活具有强烈的抑制作用。本研究为开发新的治疗结核药物提供了一个新的选择。
噬菌体,分枝杆菌,裂解酶
Abstract:LysinB(LysB)in mycobacteriophage D29 was cloned and expressed and its enzymatic properties were analysed.ThelysBgene was amplified by PCR from mycobacteriophage D29 genomic DNA and inserted into pET22b vector.The constructed recombinant plasmid was transformed intoEscherichia coliBL21(DE3)to express fusion protein, which was purified by Ni-NTA column and enzymatic activity detected.The results showed that expression plasmid pET22b-lysBwas constructed successfully.Highly purified recombination protein(His-LysB)was obtained 33.2 mg from 1 L LB culture medium.A screening for His-LysB activity on esterase and lipase substrates confirmed the lipolytic activity.Withp-nitrophenyl butyrate as substrate,the thermal stability of the enzyme was poor when the temperature was above 30oC.The enzyme exhibited higher stability at pH 5.0–9.5.The optimum temperature and pH for the lipolytic activity of His-LysB were 23oC and 7.5 respectively.Under theoptimum conditions, the specific activity of His-LysB was 1.3 U/mg.Zn, Cu, Mg, Mnand phenylmethane sulfonyl fruoride severely inhibited the lipolytic activity of His-LysB.The result provides a new option for tuberculosis drug research and development.
Keywords:bacteriophage, mycobacteria, lysins
结核病是危害人类健康的重大传染病,由于结核杆菌的多重耐药菌株的出现,使得结核病的情况日益严峻,迫切需要开发新型抗结核药物来缩短治疗时间,杀死耐多药与严重耐多药结核杆菌。
大量的研究表明,噬菌体裂解酶在体内外都有快速有力的杀菌活性,且不会产生耐药菌株。随着大量分支杆菌噬菌体基因组测序工作完成,学者们开始致力于寻找它们的裂解酶基因。研究发现一些分支杆菌噬菌体的裂解酶基因簇除了编码内溶素和穿孔素之外,还能编码具有其他活性的蛋白,这主要是由分支杆菌独特的细胞壁结构决定的。分支杆菌的细胞壁外膜含有丰富的分支菌酸,且该外膜与阿拉伯半乳糖-肽聚糖化合物共价连接[1-2]。分支菌酸是分支杆菌生长繁殖所必需的,也是抗菌药物异烟肼等的主要攻击目标。分支杆菌的外膜在获取营养中起着重要的作用,同时它也是影响噬菌体裂解的一种潜在障碍[3-4]。因此,为实现对宿主菌的裂解,分支杆菌噬菌体除了需要编码能水解肽聚糖层的内溶素之外,还需要借助另外一种酶来分解富含分支菌酸的外膜。
分支杆菌噬菌体Ms6的裂解酶基因簇已经被鉴定出来[5],由5个基因组成,除了内溶素(LysA)和穿孔素(hol)基因外,位于lysA和hol之间的lysB(gp3)基因所编码蛋白经鉴定[6]具有酯酶和脂肪酶的活性而并非内溶素的功能,是噬菌体能编码具有分解脂肪活性蛋白的首次报道。噬菌体D29是一种烈性噬菌体,其基因组序列已被全部测定[7]。氨基酸序列分析表明 D29的 LysB(gp12)与 Ms6的LysB同源性为43%,Payne等[8]也已证实噬菌体D29的LysB不仅具有分解脂肪的活性,还是一种新型的分支菌酸酰基阿拉伯半乳糖酯酶,它能裂解分支菌酸酰基阿拉伯半乳糖连接键并释放出游离的分支菌酸,并指出LysB在裂解的后期通过破坏外膜与阿拉伯半乳糖-肽聚糖层之间的连接来实现宿主菌的完全裂解。由此可见,噬菌体D29的LysB对于辅助内溶素实现对分支杆菌的裂解以及提高宿主菌的裂解效率方面发挥着重要的作用。
本研究克隆出了噬菌体 D29的 LysB基因gene12,采用表达载体pET22b和表达宿主菌大肠杆菌 BL21(DE3),高效表达并纯化了重组蛋白His-LysB,活性鉴定表明His-LysB具有分解脂肪的活性。同时对His-LysB的酶学性质进行了研究,这不仅为今后研究分支杆菌噬菌体裂解酶基因簇之间及其与宿主菌之间的相互作用机制奠定了基础,而且对于将裂解酶应用于结核病治疗方面具有重要的意义。
1 材料和方法
1.1 材料
1.1.1 菌种、质粒
耻垢分支杆菌 ATCC 607和分支杆菌噬菌体D29由中国药品生物制品检定所王国治教授惠赠;E.coliBL21(DE3)、E.coliDH5α、pMD19-T Vecter购自TaKaRa生物公司;质粒pET22b由军事医学科学院生物工程研究所方宏清教授惠赠。
1.1.2 试剂
限制内切酶、T4 DNA连接酶、Taq酶、DNA marker DL2000、1 kb DNA ladder marker、低分子量标准蛋白、异丙基-β-D-硫代半乳糖苷(IPTG)购自TaKaRa生物公司;胶回收试剂盒、质粒提取试剂盒购自鼎国生物公司;引物合成与DNA测序由恒博和泰生物科技有限公司完成;培养基Middlebrook 7H9购自Difco公司;Ni-NTA为纯泰Puribest产品;丁酸对硝基苯(pNPB)购自Sigma公司;其余试剂均为国产或进口分析纯。
1.2 方法
1.2.1 噬菌体D29 lysB的克隆和重组表达载体的构建
提取 D29噬菌体的基因组[9],以基因组为模板扩增噬菌体D29lysB基因。设计的上下游引物分别含有NdeI和NotI酶切位点:上游引物为:5′-AAGGAGATATACATATGAGCAAGCCCTGGCTGT-3′; 下 游 引 物 为 : 5′-TGCTCGAGTGCGGCCGCG ATCTGTCGTAGGAACTCGACC-3′。PCR 条件:95℃5 min;95℃ 30 s,60℃ 30 s,72℃ 30 s,30 个循环;72 ℃ 5 min 。
lysB基因片段回收、纯化后与 pMD19-T 载体连接,连接产物转化E.coliDH5α感受态细胞,重组克隆测序后正确,命名为pMD-lysB。用NdeI/NotI双酶切pMD-lysB和pET22b质粒,切胶回收目的片段后连接,连接产物转化E.coliDH5α感受态细胞,从阳性克隆中提取重组质粒经PCR和NdeI/NotI双酶切检验正确后转化到E.coliBL21(DE3)感受态细胞中,得到表达菌株BL21(DE3)/pET22b-lysB。
1.2.2 重组LysB的表达及可溶性分析
挑取BL21(DE3)/pET22b-lysB单菌落,接入含有100 mg/L氨苄青霉素的LB培养基中,于37℃培养至OD600≈0.4~0.6,加入IPTG至终浓度为 0.5 mmol/L,25℃诱导10 h。分别取诱导前后的培养菌液,进行SDS-PAGE电泳分析蛋白表达情况。
取1 mL诱导表达后的培养菌液,超声破碎,分离可溶性蛋白和非可溶性蛋白,分别取样进行SDS-PAGE电泳分析重组蛋白的可溶性。
1.2.3 重组LysB的纯化
离心收集IPTG诱导表达10 h的1 L培养菌液菌体(5000 r/min,4℃,10 min),并重悬于破碎缓冲液(10 mmol/L Na2HPO4,1.8 mmol/L KH2PO4,140 mmol/L NaCl,2.7 mmol/L KCl,pH 8.0)中超声破碎,离心收集上清液并过Ni-NTA柱。用 5倍体积的含20 mmol/L咪唑的洗涤缓冲液洗柱后,再分别用含有60、100、150、200、250、300 mmol/L咪唑的洗脱缓冲液分步洗脱,SDS-PAGE电泳检测重组蛋白的纯度,采用Bradford法测定蛋白浓度。纯化后的重组蛋白经超滤离心管(截留分子量 10 kDa)浓缩并用储存缓冲液(50 mmol/L Tris-HCl,pH 8.0,50 mmol/L NaCl,50%甘油)进行透析,分装后于–20℃备用。
1.2.4 重组LysB活性分析[10-12]
取 37 μg的 His-LysB滴加在含有 1%(V/V)Tween 80或Tween 20以及1 mmol/L CaCl2的LB平板上,在23℃条件下孵育24 h,观察有无白色沉淀产生。以蛋白质溶解液作为阴性对照。
将适当稀释的酶液加入到200 μL含0.4 μmol/L丁酸对硝基苯(pNPB)的缓冲液(100 mmol/L Tris-HCl,pH 7.5;0.2% Triton X-100)中,于室温条件下反应30 min后测定405 nm处的吸光值,根据标准曲线计算出对硝基苯酚(pNP)的释放量。以不加酶液的反应体系作为空白对照。在一定的温度和pH条件下,每分钟从底物溶液中分解产生1 μmoL pNP所需要的酶量为一个酶活力单位(U)。
2 结果
2.1 表达载体的构建与鉴定
以噬菌体D29基因组DNA为模板,PCR扩增lysB基因片段,产物经琼脂糖凝胶电泳分析,呈现约 750 bp左右的特异性扩增条带,大小与噬菌体D29的lysB(765 bp)相符。扩增产物与 pMD19-T载体连接得到pMD-lysB载体,测序结果与GenBank公布的核苷酸序列相差一个碱基,但不改变氨基酸残基。用NdeI/NotI酶切pMD-lysB和pET22b载体,将目的片段回收后连接,得到 pET22b-lysB载体,转化至E.coliDH5α感受态中,筛选的阳性克隆进行双酶切鉴定,得到了两条与预期大小(5371 bp和769 bp)相符的片段(图1),表明重组表达载体pET22b-lysB构建成功。
2.2 重组蛋白(His-LysB)的表达和纯化
将 pET22b-lysB载体转化进入E.coliBL21(DE3)感受态后,IPTG诱导表达,离心收集菌体,SDS-PAGE电泳结果表明在分子量约为29 kDa处有一明显的蛋白条带(图2),同预计的重组蛋白大小一致(29.5 kDa),表明BL21(DE3)/pET22b-lysB表达成功,重组蛋白(His-LysB)约占全菌总蛋白的50%以上。蛋白的可溶性分析表明,重组蛋白(His-LysB)大部分是可溶性的,占全菌可溶性总蛋白含量的48.1%。
收集诱导后的菌体,超声破碎,离心后取上清用Ni-NTA纯化,SDS-PAGE薄层扫描分析显示其纯度大于85%。将纯化的目的蛋白进行浓缩透析,测定蛋白浓度为3.7 g/L,目的蛋白的获得量为每升LB培养物33.2 mg,分装后−20℃储存备用。

图1 表达质粒pET22b-lysB的双酶切鉴定Fig.1 Restriction enzyme analysis of pET22b-lysB.M1: 1 kb DNA ladder marker; M2: DNA marker DL2000; 1: pET22b digested withNdeI/NotI; 2: pET22b-lysBdigested withNdeI/NotI.

图2 His6-LysB表达与纯化的SDS-PAGE分析Fig.2 SDS-PAGE analysis of pET22b-lysBexpression and purification.M: low molecular weight markers; 1,2: uninduced and induced expression of BL21(DE3)carrying pET22b; 3,4:uninduced and induced expression of BL21(DE3)carrying pET22b-lysB, indication about 29 kDa fusion LysB protein; 5:purified His-LysB.
2.3 His-LysB活性鉴定
将纯化的 His-LysB滴加在含有 Tween 20或Tween 80的LB平板上,均能观察到白色沉淀圈(图3)。Tween 20和Tween 80分别是含12个C的聚氧乙烯山梨醇酐单月桂酸酯和含18个C的聚氧乙烯山梨醇酐单油酸酯,它们均能被分解脂肪的酶裂解成脂肪酸和乙醇。产生的脂肪酸与 Ca2+则形成不可溶的脂肪酸盐,因此会在平板上形成白色沉淀。作为阴性对照的重组蛋白溶解液没有产生白色沉淀。这一结果表明,His-LysB对脂肪酶作用的底物具有明显的分解作用,其具有脂肪酶活性。
2.4 His-LysB酶学性质的研究
2.4.1 反应温度对LysB活性的影响
将适当稀释的酶液加入到含 0.4 μmol/L pNPB的TT缓冲液(100 mmol/L Tris-HCl,pH 7.5;0.2%Triton X-100)中,在不同的温度下反应30 min,测定LysB的最适反应温度,结果见图4。从图4中可以看出该酶最适反应温度为23℃左右。
2.4.2 反应pH值对LysB活性的影响

图3 重组蛋白His-LysB的活性鉴定Fig.3 Effect of His-LysB activity on agar plates containing Tween 80 and CaCl2, Tween 20 and CaCl2.
2.4.3 LysB的热稳定性
酶液置于不同温度下温浴30 min后,测定LysB的活性,以4℃存放的酶液作为对照,计算出相对酶活力,结果如图6所示,该酶在30℃以下比较稳定,温度高于30℃时,酶活力下降较快,37℃相对酶活力不到50%,当温度达到55℃时,相对酶活几乎为0,说明该酶的热稳定性较差。
2.4.4 LysB的pH值稳定性
酶液经不同pH的缓冲液稀释,室温条件下处理1 h后测定LysB的酶活,结果如图7所示,该酶在pH 5.0~9.5之间较稳定,相对酶活均大于80%。

图5 pH对酶活力的影响Fig.5 Effect of pH on the activity of His-LysB.
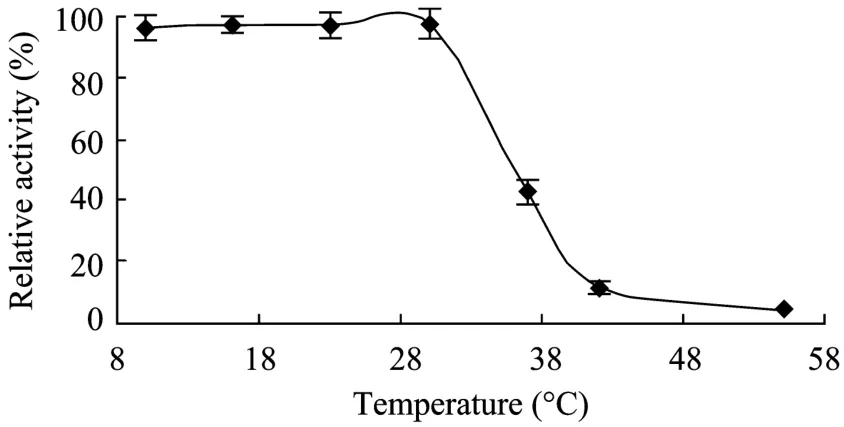
图6 酶的热稳定性Fig.6 Thermal stability of His-LysB.
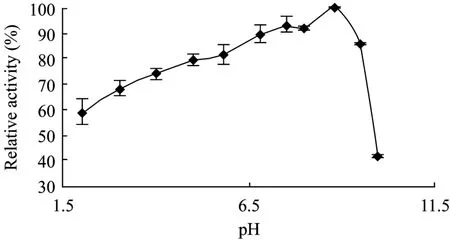
图7 酶的pH稳定性Fig.7 pH stability of His-LysB.
2.4.5 不同金属离子以及抑制剂对LysB活性的影响
将酶液加入到含一定浓度的不同金属离子(5 mmol/L:Ca2+、K+、Zn2+、Fe2+、Cu2+、Mg2+、Mn2+)以及抑制剂(10 mmol/L: EDTA、PMSF)的缓冲液中于室温条件下预处理 2 h,测定处理后的LysB活性,以未加金属离子或抑制剂的LysB为对照,计算相对酶活力,结果见表1。除了Ca2+和EDTA对酶活没有明显影响外,其余金属离子以及 PMSF对酶活均有不同程度的抑制,其中以 Zn2+、Cu2+、Mg2+、Mn2+和 PMSF的抑制作用最为强烈。
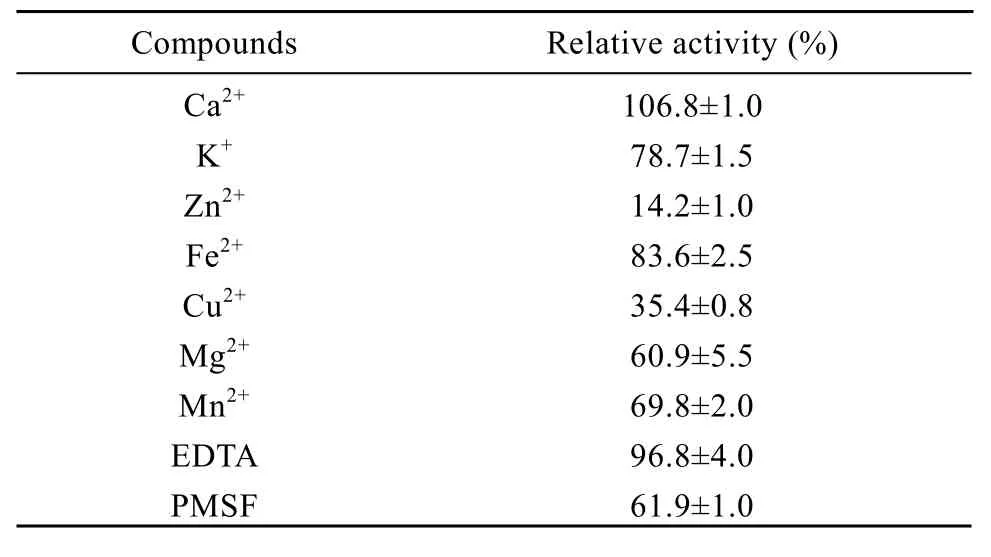
表1 金属离子和抑制剂对酶活力的影响Table 1 Effect of different metal ions and inhibitors on His-LysB activity
3 讨论
本研究采用大肠杆菌表达系统对噬菌体D29的lysB基因进行了克隆表达,表达的重组蛋白约占全菌总蛋白的50%以上。蛋白的可溶性分析表明,重组蛋白大部分是可溶性的,占全菌可溶性总蛋白含量的 48.1%。经 Ni-NTA纯化后的重组蛋白在分别含有Tween 80和Tween 20的LB平板上呈现出分解脂肪的活性。这说明该蛋白属于脂肪酶。以 pNPB为底物,研究了重组蛋白的酶学性质,结果表明该重组蛋白在23℃和pH 7.5处活性最佳,比活性为1.3 U/mg。该酶的热稳定性较差,在30℃以下比较稳定,温度高于30℃时,酶活力下降较快;重组蛋白具有较广的pH范围,在pH 5.0~9.5之间较稳定。在所测试金属离子和抑制剂中,除了 Ca2+和 EDTA抑制剂对酶活没有明显影响外,其余金属离子以及PMSF酶活均有不同程度的抑制作用,其中以Zn2+、Cu2+、Mg2+、Mn2+和 PMSF的抑制作用最为强烈,所以在该酶在处理和保存的过程中尽量避免与这些影响因子接触。
噬菌体D29的LysB虽然并没有表现出内溶素的功能,但作为一种脂肪酶在宿主菌的裂解过程中所发挥的作用是不容忽视的。因为分支杆菌与其他的革兰氏阳性菌不同,它含有一个具有高浓度脂质(大于60%)的复杂的细胞壁。由于细胞壁中的分支菌酸-阿拉伯半乳糖-肽聚糖复合物的中心分布着一些特殊的脂质,从而使其形成了一种有效的表面渗透障[13]。基于分支杆菌的这种细胞壁复杂性,分支杆菌噬菌体有必要编码一种能分解脂肪的酶,以实现噬菌体对宿主菌的快速裂解。除此之外,由于分支杆菌具有富含分支菌酸的外膜,可能会使内溶素在体外难以发挥活性,从而影响了内溶素在治疗结核上的应用。通过对 LysB的研究,设想通过内溶素LysA和LysB的联合作用也许能实现对分支杆菌的体外裂解,具体是否可行还有待于进一步的实验验证。
本研究成功表达了具有脂肪酶活性的分支杆菌噬菌体D29的LysB蛋白并研究了LysB的酶学性质,为开发新的治疗结核的药物提供了一个新的选择。
REFERENCES
[1]Hoffmann C, Leis A, Niederweis M,et al.Disclosure of the mycobacterial outer membrane: cryo-electron tomography and vitreous sections reveal the lipid bilayer structure.Proc Natl AcadSci USA, 2008, 105(10):3963−3967.
[2]Zuber B, Chami M, Houssin C,et al.Direct visualization of the outer membrane of mycobacteria and corynebacteria in their native state.J Bacteriol, 2008, 190(16):5672−5680.
住宅小区与医院的间距每降低一千米,房价增长721元/m2。从图3(f)可以看出:对房价影响较大的主要为西岗区、沙河口区和甘井子区。但在沙河口区和甘井子区等医院分布较集中的区域出现了医院对房价产生正、负中心依次显现的现象,这表示医院对房价的作用并不是单向的。因为一些地区由于医疗服务的便利性,使居民的就医条件得到了显著改善,从而房价上涨。但一些地区因为医院分布太过密集,引发较多环境污染和交通拥堵问题,从而引起房价降低。
[3]Niederweis M.Nutrient acquisition by mycobacteria.Microbiology, 2008, 154(3): 679−692.
[4]Vilcheze C, Jacobs WR Jr.The mechanism of isoniazid killing: clarity through the scope of genetics.AnnuRev Microbiol, 2007, 61: 35−50.
[5]Garcia M, Pimentel M, Moniz-Pereira J.Expression of Mycobacteriophage Ms6 Lysis genes is driven by two σ70-like promoters and is dependent on a transcription termination signal present in the leader RNA.J Bacteriol,2002, 184(11): 3034−3043.
[6]Gil F, Catalao MJ, Moniz-Pereira J,et al.The lytic cassette of mycobacteriophage Ms6 encodes an enzyme with lipolytic activity.Microbiology, 2008, 154(5):1364−1371.
[7]Ford ME, Sarkis GJ, Belanger AE,et al.Genome structure of mycobacteriophage D29: implications for phage evolution.J Mol Biol, 1998, 279(1): 143−164.
[8]Payne K, Sun Q, Sacchettini J,et al.Mycobacteriophage Lysine B is a novel mycolylarabinogalactan esterase.Mol Microbioly, 2009, 73(3): 367−381.
[9]Sambrook J, Russell DW.Molecular Cloning: A Laboratory Manual.3rd ed.Beijing: Science Press, 2002:174−198.萨姆布鲁克 J, 拉赛尔 DW.分子克隆实验指南.3版.北京: 科学出版社, 2002: 174−198.
[10]Schmidt JA, Browning GF, Markham PF.Mycoplasma hyopneumoniaep65 surface lipoprotein is a lpolytic enzyme with a Preference for shorter-chain fatty acids.J Bacteriol, 2004, 186(17): 5790−5798.
[11]Gilham G, Lehner R.Techniques to measure lipase and esterase activityin vitro.Methods, 2005, 36(2): 139−147.
[12]Nikoleit K, Rosenstein R, Verheij HM,et al.Comparative biochemical and molecular analysis ofStaphylococcus hyicus,Staphylococcus aureusand a hybrid lipase.Indication for a C-terminal phospholipase domain.Eur J Biochem, 1995, 228(3): 732−738.
[13]Brennan PJ.Structure, function, and biogenesis of the cell wall ofMycobacterium tuberculosis.Tuber culosis(Edinb), 2003, 83(1/3): 91−97.
Expression and purification of Lysin B in mycobacteriophage D29 and analysis of its enzymatic properties
Lili Hou1,2, Limei Hao2, Jiancheng Qi2, and Ge Yang1
1 College of Life Science, Qufu Normal University, Qufu 273165, China 2 National Bio-protection Engineering Center, Institute of Medical Equipment, Academy of Military Medical Sciences, Tianjin 300161, China
Received:November 26, 2009;Accepted:February 24, 2010
Supported by:Major National Science and Technology Special Projects during the 10th Five-year Plan for Prevention and Treatment of Major Infection Diseases: Study of New Methods for Tuberculosis Treatment(No.2008ZX10003-016).
Corresponding author:Jiancheng Qi.Tel: +86-22-84657486; E-mail: qijch@npec.org.cn Ge Yang.Tel: +86-537-4456909; E-mail: yangge100@126.com国家“艾滋病和病毒性肝炎等重大传染病防治”科技重大专项“十一五”课题《结核病治疗新方法的研究》(No.2008ZX10003-016)资助。
