乙型肝炎病毒核心蛋白作为表位疫苗载体的应用
2010-10-16殷瑛徐俊杰陈薇
殷瑛,徐俊杰,陈薇
军事医学科学院微生物流行病研究所 病原微生物生物安全国家重点实验室,北京 100071
乙型肝炎病毒核心蛋白作为表位疫苗载体的应用
殷瑛,徐俊杰,陈薇
军事医学科学院微生物流行病研究所 病原微生物生物安全国家重点实验室,北京 100071
乙型肝炎病毒核心蛋白(Hepatitis B virus core protein,HBc)可以形成二十面体对称的颗粒样结构,由于其N端、C端和主要免疫显性区域(Major immunodominant region,MIR)允许一定程度的缺失和外源插入,并且能够将外源序列重复且高密度地暴露在颗粒的表面,诱发强烈的外源序列特异的体液和细胞免疫反应,从上世纪80年代中期就开始被运用于表位疫苗的研究。以下主要从影响HBc作为表位疫苗载体的因素,包括HBc长度、外源插入位点和表位序列的性质等来介绍HBc作为表位疫苗载体的应用。
乙肝核心蛋白,表位疫苗,疫苗载体,基因重组
Abstract:Hepatitis B virus core(HBc)proteins have been used as carrier for foreign epitopes since the 1980s.They could self-assemble into icosahedral particles.Foreign epitopes could be inserted into HBc protein in various protein regions, including the N- or C-terminal and the major immunodominant region(MIR).The factors relevant in the design of HBc particles for vaccine purpose are summarized in this review.
Keywords:hepatitis B virus core protein, epitope vaccine, vaccine carrier, gene recombination
重组的乙型肝炎病毒核心蛋白(Hepatitis B virus core protein,HBc)自上世纪80年代中期开始就被用于表位疫苗载体的研究,它能够形成二十面体对称病毒样粒子(Virus-like particle,VLP)的结构,可以被用来展示外源序列。到目前为止,经其展示过的表位涉及病毒、细菌和原生动物蛋白表位(疟原虫、钩端螺旋体)等[1]。HBc颗粒得以作为表位载体的实际运用主要在于它可以在自身表面重复且高密度地展示外源性序列,从而诱发强有力的体液或细胞免疫反应;Pumpens和 Grens[2]以及 Riedl等[3]曾报道,重组的HBc-VLP还能在免疫反应中发挥佐剂作用,并且可以经口腔途径免疫[4],这些都为现代的疫苗设计提供了新的思路。此外,作为病毒样粒子,HBc还具有包裹核酸或其他小分子的能力,可以作为基因或药物的运载工具[5]。另一方面,HBc作为表位载体的能力也受一些因素的限制。以下就有关这些方面的研究进展进行了简述。
1 HBc的结构生物学特点
HBc由乙型肝炎病毒(Hepatitis B virus,HBv)C基因的第2个起始密码子起始翻译而成,是乙肝核心抗原(Hepatitis B core antigen,HBcAg)的结构成分。单体的 HBc主要由 α-螺旋发夹结构组成(图1)[6],2个单体分子组装二聚体结构,形成由 2个 α螺旋发夹构成的四螺旋束(图2),也就是冷冻电镜下所观察到的衣壳表面的刺突(Spike)[7]。刺突的顶端对应于HBc分子的78~82位氨基酸,是所形成的HBc-VLP表面主要的B细胞识别位点,也是主要的免疫显性区域(Major immunodominant region,MIR)[2](图1、2)。此外,2005 年,Roseman 等[8]报道,HBc单体的螺旋发夹结构有2种构象,每一个二聚体均由2个不同构象的单体构成。
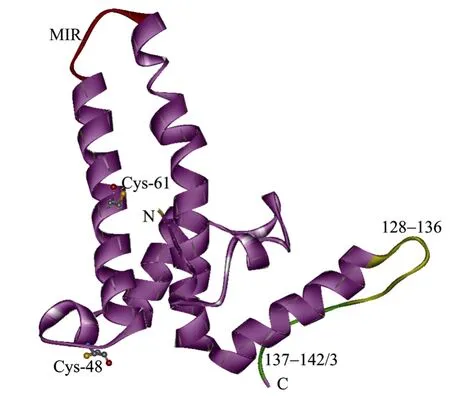
图1 HBV衣壳蛋白单体的结构模式图Fig.1 Structure of the HBV capsid monomer.The structure data is obtained from Protein Data Bank(www.rcsb.org), the PDB ID is 1qgt.The MIR is shown in red, the α-helical hairpin is shown in purple, Cys is shown in jacinth.The α5 helical hairpin and C terminal arm which involved in capsid assembly are shown in yellow and green.
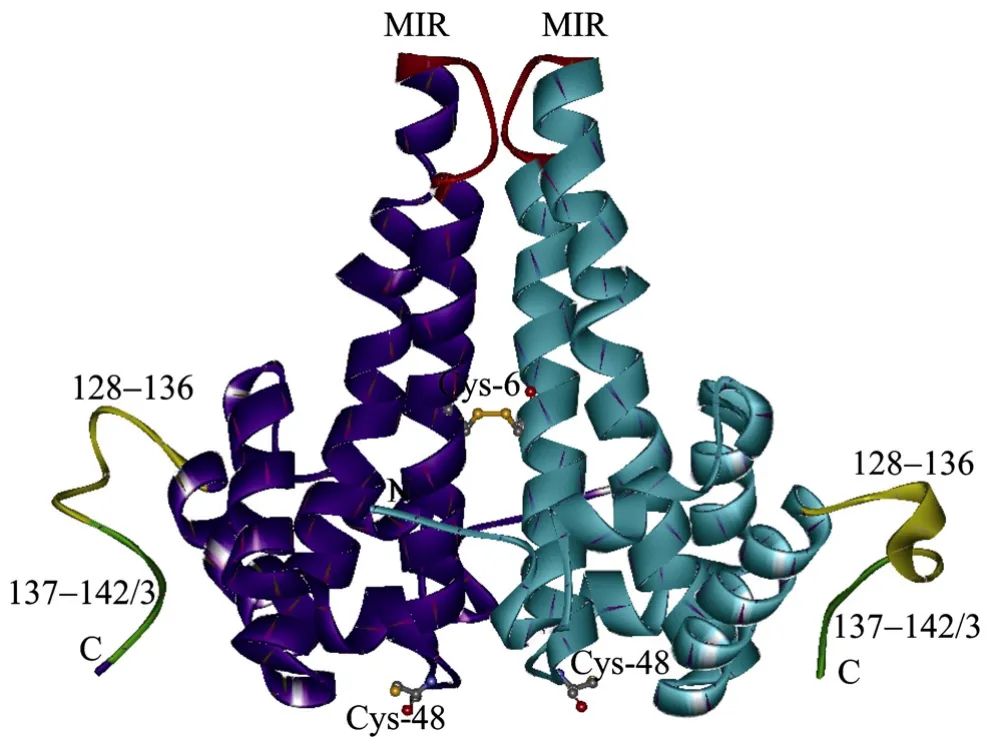
图2 HBV衣壳蛋白二聚体的结构模式图Fig.2 Structure of the HBV capsid dimer.The structure data is obtained from Protein Data Bank(www.rcsb.org), the PDB ID is 1qgt.The MIR is shown in red, the two HBc monomers which constitute a dimer are shown in dark blue and light blue.Cys is shown in jacinth, and Cys-61 in each molecular forms a disulfide bridge between the two monomers.
HBc-VLPs的结构中主要存在3种相互作用[6],首先是疏水作用,主要用来维持单体的折叠和二聚体结构的稳定性;其次是共价键,主要是形成二聚体(图2)的2个单体内,相应的Cys-48或Cys-61之间形成的分子间二硫键,但是这种作用对于二聚体或衣壳的形成影响不大,另外根据2个Cys-48之间二硫键形成的难易程度,也排除了天然HBc颗粒中有二硫键存在的可能;最后一种相互作用是 HBc分子α5螺旋的氨基酸和C端的臂之间的作用,这种作用与这两个区域的氨基酸残基组成及其侧链结构有关,主要影响着颗粒的装配与稳定性。
HBc所形成的衣壳在真核、原核、昆虫及植物表达系统中均能得到正确的表达[1]。大肠杆菌所表达的HBc蛋白主要可以形成2种类型的颗粒[9],分别是由180个单体形成的T=3型颗粒和由240个单体形成的T=4型颗粒。这两种颗粒的表面分别有90或 120个刺突,并且有一些孔洞结构存在,这些孔洞可能是病毒基因组复制时核酸流通的路径,也有可能是形成颗粒的HBc分子,其C端结构与颗粒外环境接触的通道[6]。
2 HBc作为疫苗载体的应用
外源序列主要是通过两种方式与 HBc建立关联:基因重组和化学偶联[10]。
2.1 基因重组
基因重组主要是将某T细胞表位和(或)B细胞表位的编码序列直接插入 HBc编码基因的特定位置,通过各种表达系统来得到插入该肽段的重组HBc-VLPs。在这个过程中可以通过对HBc的长度、外源序列的插入位点、外源序列的组合形式(例如:同种表位多拷贝串联、异种表位串联、目的表位与辅助表位串联等)以及决定HBcAg自身免疫原性的若干氨基酸的缺失等重要参数进行修饰来确保外源序列高水平的B细胞和/或T细胞的免疫原性。
2.1.1 HBc的长度
HBc的长度影响着颗粒的装配能力、颗粒的二态性、与核酸的结合能力和激发免疫的类型。
1)颗粒的装配与二态性
天然的 HBcAg包含有 183或 185个氨基酸,Borisova等和Gallina等发现HBc蛋白C端精氨酸富集的区域150~183位氨基酸对颗粒的形成[11]和衣壳的大小与形态的维持[12]是非必需的,此外,Zlotnick等[9]通过使用由细菌表达的一系列不同长度的衣壳蛋白(1~149aa,1~147aa,1~142aa,1~140aa,1~138aa,3~144aa)在体外研究了衣壳的装配过程。结果表明,大于或等于 140个氨基酸的结构才可以装配成衣壳,而且会形成T=3或T=4型颗粒的混合物。这两种颗粒可以通过蔗糖梯度分开,并且即使是在长期贮存的条件下也不会相互转化。蔗糖梯度分级分离、分析超速离心和冷冻电镜的结果证明T=3型颗粒的比例会随着C端氨基酸缺失数目的增加而增加。此外,通过对T=4型(1~149aa)颗粒晶体结构的电子密度图的分析发现,所表达的149位氨基酸的多肽中,C端的6个氨基酸(144~149aa)基本上没有观察到电子密度,这提示或许可以将形成颗粒所需要多肽的最小长度精确到 143[6]/144[13]个氨基酸。然而,也有文献报道[2,14],切除了 C端的HBc蛋白,虽然在表达量上有很大的提高,在形态上也与天然的颗粒差异不大,但是,去除了C端结构的HBc蛋白不够稳定,因此有研究者在后期的操作中,为了使重组的结构能保持稳定,在C端添加一个半胱氨酸[15-16]。
2)核酸的结合位点及佐剂效应
HBc蛋白的 150~157aa和 157~177aa分别具有RNA和DNA结合活性[2]。一方面HBc可以作为潜在的B细胞激活剂来充分调动B细胞使之成为高效的促使抗原呈递的细胞;另一方面这种C端核酸结合序列能非特异地结合少量真核或原核RNA,通过MyD88依赖性和非依赖性信号传导途径,激活NF-κB和MAPK,引发某些细胞因子的释放及部分共刺激分子的上调,并最终激活特异性免疫系统,而且包裹在HBcAg颗粒中的RNA佐剂效应是游离RNA的1000倍[17]。本实验室的研究也发现,炭疽杆菌保护性抗原(PA)与HBc的融合蛋白在免疫小鼠时,不加佐剂和使用氢氧化铝佐剂组均能激发高效价的抗PA抗体,而且这两组在激发抗PA抗体的能力上没有显著性差异。
3)HBcAg载体的长度影响着激发免疫的类型Th1/Th2
Zlotnick等[9]发现全长的HBc优先激发HBcAg Th1型反应,而突变体HBc-149或144颗粒优先激发Th2型反应。Th1型反应是与细胞毒和局部炎症有关的免疫应答,涉及细胞免疫反应及迟发型超敏性炎症的发生,在机体抗胞内病原体感染中发挥着重要的作用;Th2型反应主要涉及B细胞的增殖以及抗体的产生,与体液免疫相关。这提示可以针对病原体的不同类型(是否胞内病原体)采用不同的HBc蛋白长度。
2.1.2 外源表位的插入位点
对于外源插入位点的研究,主要集中在HBc的N端和 C端,以及刺突顶端的主要免疫显性区域(MIR),因为它们不参与关键的分子内和分子间的相互作用。
1)N端和C端
N端插入是最先使用的插入方式(表 1)。最初使用N端作为插入靶点开展的研究很多,但目前N端插入已经不是首选的插入方法。有文献报道[2],N端插入对外源序列的长度有一定的限制,大于50个氨基酸的长度可能会影响颗粒的组装,过长的N端序列还可能会在空间上影响免疫效应细胞与正常的免疫显性HBc刺突的接触,从而影响免疫辅助作用的发挥[15]。目前进展最好的是基于HBc N端插入的流感候选疫苗。
C端插入也是较常用的插入方法(表1)。但是C端一般被包裹在衣壳的内部,所以融合在这个区域的序列有可能不能被暴露在衣壳表面。HBc颗粒的表面有孔洞存在,有些融合在C端的蛋白可以通过这些孔洞实现与免疫细胞表面受体的接触,然而它们特异的B细胞免疫原性通常较低[1]。

表1 N端、C端和MIR插入能力简表[1-2]Table 1 Capacity of the HBc carrier[1-2]
2)MIR区域
MIR区是目前研究得最多,也是应用最广泛的插入区域(表1)。这主要是因为HBc分子78~82位氨基酸所对应的区域(MIR),位于衣壳表面刺突的顶端,是主要的免疫显性区域,插入到这个区域的外源序列不仅能被暴露在衣壳的表面,而且还能确保高水平的特异性的B细胞和T细胞的免疫原性[2]。例如,本实验室发现[18],将炭疽杆菌保护性抗原(PA)结构域 2 的 2β2−2β3loop(24aa)插入到 HBc的MIR的78~79位氨基酸之间,不仅可以形成电镜下可见的颗粒状结构,这些颗粒在小鼠和豚鼠模型上还可以诱导高效价的抗PA抗体和中和性抗体,并能保护部分豚鼠对抗炭疽毒力芽胞的攻击。此外,虽然这个区域位于HBc分子的内部,但相对于N端和C端而言,它具有更大的插入容量,例如,绿色荧光蛋白的 238个氨基酸通过插入这个区域被天然地展示在了全长的HBc所形成的颗粒表面,嵌合体不仅显示了荧光的能力,同样也引发了针对天然 GFP的有力的体液反应[19]。Nassal等[20]将博氏疏螺旋体的整个外表面脂蛋白 A(OspA)的外功能区的 255个氨基酸和 OspC(OspC(a),OspC(b))的二聚体的189个氨基酸长的突变体分别插入到 HBc的 MIR区,以研究HBc被开发成用于展示整链蛋白抗原的疫苗载体能力,虽然核心蛋白与两个 OspC突变体的融合均可以有效地形成常规的VLPs,与OspA的融合只有部分能装配成常规的VLPs,但是这些融合蛋白都可以激发有效的抗体反应,包括Ig同种型和针对保护性表位“LA-2”的特异性抗体,并主动和被动地保护小鼠对抗博氏疏螺旋体的攻击。
另外,MIR区除了容量大以外,外源序列的插入,对该区域若干氨基酸进行缺失[1-2]或者加入一些辅助表位等,对于消除 HBc自身的抗原性/免疫原性,以及增强外源序列特异的免疫反应也是非常重要的。本实验室发现,炭疽杆菌 PA结构域 2的2β2−2β3loop(24aa)在 HBc78~79 位氨基酸之间插入,或将79~81位氨基酸替换均可以显著地降低抗HBc抗体的产生,插入组和替换组激发的抗HBc抗体效价比不插入组低10倍。Zhang等[21]在将口蹄疫病毒(FMDV)表位融合至 HBc颗粒的研究中分别构建了在 HBc MIR区缺失 3段不同长度氨基酸序列:75~78aa(3个氨基酸),75~80aa(5个氨基酸)和75~82aa(7 个氨基酸)的展示载体(pHBc1,pHBc2,pHBc3),并在这3个缺失部位分别插入了FMDV的多表位的不同组合,BT[VP1(141~160)−VP4(21~40)]和BTB[VP1(141~160)−VP49(21~40)−VP1(141~160)],形成了6种不同的重组质粒。结果表明,pHBc3-BTB表达了可溶性的蛋白,并形成了电镜下可见的完整的 VLP粒子。重组的 VLP可以被细胞吞噬并且在体内和体外均能被观察到。更重要的是,经修饰的颗粒比其他5个重组蛋白和GST-BTB能更显著地激发高效价的肽段特异性和病毒特异性抗体,提高IFN-γ和 IL-4的分泌水平,尤其是强化了淋巴细胞的增殖能力。
2.1.3 对于插入序列自身的要求
影响衣壳装配的因素除了不同的插入位点会有插入长度的限制外,对于插入序列的组成也是有要求的。嵌合的HBcAg自我装配的能力可能依赖于插入序列的氨基酸残基的物理和化学性质。Karpenko等[22]发现在 MIR区进行插入的表位序列如果出现以下 3种情况会影响颗粒的装配:表位高度的疏水性(High epitope hydrophobicity)、过长的表位序列(Large epitope volume)和高 β 链指数(High β-strand index)。这 3个参数的比值越高,HBcAg的融合蛋白形成颗粒的可能性就越小。有研究报道[22]高疏水性引起的装配问题可以通过在一个宿主菌中共同表达天然的 HBcAg的基因和融合有外源序列的HBcAg的基因从而形成嵌合颗粒得到解决,而由高β链指数带来的装配问题可以通过去除HBcAg的β折叠结构或者在插入序列的C端与HBcAg载体相连的地方引入间隔序列(Spacer)来解决。值得注意的是,肽段在N端的插入没有这种显著的相关性,可能对于形成天然的蛋白结构而言,在N端和C端的插入没有那么苛刻的结构上的要求。
此外,Billaud等[14]在对土拨鼠肝炎病毒核心抗原(Woodchuck hepatitis virus core antigen,WHcAg)的研究中发现,插入序列的荷电情况也影响嵌合颗粒装配:带正电荷的插入序列(高 pI)可能不利于二聚体的形成和/或颗粒的装配等;甘氨酸的添加或置换或用天冬氨酸包围插入的表位两侧,可以使原本不能装配的嵌合颗粒变为可以装配。只有酸性氨基酸可以改善携带有正电荷插入序列的,原本不能装配的嵌合颗粒的装配能力。其次,在同样长度的载体中插入同样的异源表位时,表位的插入位置只能影响颗粒的免疫原性而不能改变颗粒整体的免疫原性,位置效应最有可能反映的是表位在颗粒表面的暴露程度和/或其与MIR区域的位置关系。此外,将同一表位插入到不同C端长度的WHcAg的同一位置的结果表明,C端区域的结构可能通过影响颗粒的稳定性来影响颗粒的免疫原性。
2.2 化学偶联
通过化学交联剂将外源肽段直接结合到HBc表面是将外源序列暴露在HBc表面的另一种方式。鉴于经由基因融合所构建的蛋白在结构上可能存在位阻效应,插入 VLPs的外源肽段的大小限制着衣壳的装配,或者是融合至N端或C端的序列不能被很好地暴露,影响免疫原性,或者某些嵌合的 VLPs在体内不稳定,Jegerlehner等[10]建立了直接将外源性肽交联到HBcAg颗粒表面的疫苗形式,主要是通过基因工程的方法使肽段或蛋白含有一个自由的Cys,使HBcAg在MIR区含有一个Lys,让分别含有 2个氨基酸的多肽或蛋白通过交联剂交联起来。这种方法可以消除衣壳装配时的空间位阻,从而诱导强烈的B细胞反应。但是由于这种方法较重组技术而言:不可重复、生产困难、成本高、而且免疫原性相对较弱[14],所以不是主流的设计方法。在基于 M2e的流感疫苗一项临床前研究中,免疫原HBc/K77-M2e[15]就是通过这种方法构建的。
2.3 临床实验
目前较为成功的基于HBc所制备的重组疫苗主要是流感疫苗 ACAM-FLU-A™和疟疾疫苗ICC-1132。
2.3.1 ACAM-FLU-ATM
ACAM-FLU-A™是由英国 Acambis[23]公司研制的针对流感病毒所有A型株的疫苗,它以HBc氨基端 163个氨基酸为载体[24-25],来递送流感病毒离子通道蛋白M2的胞外结构域M2e。2008年1月Acambis公司宣布已经完成了Ⅰ期临床研究,在79名志愿者身上所进行的对疫苗的安全性和产生免疫反应能力的评价结果表明,ACAM-FLU-A™有很好的耐受性和免疫原性,所有的接种组中都能激发免疫反应,ACAM-FLU-A™+ QS-21组的免疫反应是最强烈的,这一组90%的受试对象都发生了血清型转换。
2.3.2 ICC-1132
ICC-1132是由美国研制的针对疟疾的疫苗,它主要是在HBc的MIR区的78位和79位氨基酸之间插入恶性疟原虫免疫显性B细胞表位[(NANP)3]和一个HLA限制性CD4表位(NANPNVDPNANP),并在HBc的149位氨基酸后融合一个通用的T细胞表位(T*)(326~345aa,NF54 isolate)[26],ICC-1132于2008年完成了其在美国的Ⅰ期临床的研究,在这之前,ICC-1132疫苗已经在一些欧洲国家完成了相应的临床研究[27-29]。在51名18~45岁的健康的志愿者身上所开展的对ICC-1132+Al(OH)3的安全性,免疫原性和抗原性的临床研究结果表明,这种候选的疟疾疫苗ICC-1132在设计的所有剂量水平上都是安全的,而且有很好的耐受性,但是使用铝佐剂时疫苗的免疫原性较弱,有待于与更有效的佐剂联合以提高其免疫原性[26]。
3 其他
HBc VLPs近年来也被用于癌症的研究,Zhang等[30]利用HBc VLPs展示了肝癌细胞(HCC)的单个或多个表位,4个HCC的表位MAGE-1(278~286aa)、MAGE-3(271~279aa)、AFP1(158~166aa)、AFP2(542~550aa)分别被融合或偶联至截短的HBV核心基因的N端,虽然不是所有的重组质粒都能表达融合蛋白,但是那些能够表达的蛋白,即使是包涵体的形式,也能形成完整的“成熟”的VLPs。由E.coli表达的截短的HBc(1~144aa)融合蛋白也可以自我装配成VLPs,在形态学和物理学性质上都与野生型相似,而且这些VLPs即使是在6 mol/L尿素的条件下进行变性纯化,所得到的产物经过复性后也依然保持着生物学活性。Song等[31]发现树突细胞吞噬包裹有CpG的HBc VLPs可以增强CD8+诱导的胞毒T细胞反应和抗肿瘤效应,可以有效地促进基于 T细胞疫苗的发展。除了上述这些,截短的HBc还被用来构建基于细胞因子肽 IL-4的治疗性疫苗[32],这种IL-4疫苗抑制了小鼠呼吸道的炎症反应,并为传统的使用单克隆抗体或可溶性受体来阻断过度产生的内源性细胞因子的方法提供了新的思路。此外,Huleatt等[33]发现,TLR5的配体鞭毛蛋白与流感M2e蛋白的 4拷贝串联结构融合所得到的蛋白在不加佐剂和其他成分的情况下免疫小鼠,可以有效地激发M2e特异的抗体反应,并且这种抗体反应在数量和质量上都优于铝佐剂参与的反应,在0.3 mg/只小鼠的剂量时可以保护小鼠对抗流感A型病毒的致死性攻毒。这提示,将特异性TLR的配体或其一部分整合至HBc可能会提高HBc作为免疫载体在没有佐剂或其他辅助刺激免疫反应组分的存在下,激发抗原特异性反应的能力。
4 结语
对HBc作为表位疫苗载体的应用研究已经开展了近30年,研究者在各个层次都进行了探索,但是现有的以HBc为基础的技术平台还是有很多的理论和实践的限制,其中最主要的就是“装配(Assembly)”和“预存免疫(Preexisting immunity)”问题[22,34]。研究者普遍承认,在以HBc为疫苗平台的研究中,只有不到50%的所选外源序列可以被成功地插入到 HBc,这种高失败率被认为是由于外源序列的插入所导致的装配颗粒失去稳定性所致[22]。对于预存免疫的问题,因为HBc是来自于人的病原体,大多数感染过HBV的个体,在体液中都会存在相当高效价的抗HBc抗体,这可能会降低疫苗的免疫原性[34];基于 HBc的疫苗所激发的抗 HBc抗体可能会减弱以检测抗 HBc抗体为主要指标的诊断HBV感染的诊断方法的准确性;最重要的是,在HBV慢性感染的个体中存在着 T细胞的免疫耐受[22]。然而令人兴奋的是De Filette等[34]在小鼠实验中证明,预存的 HBc特异性抗体既不会影响 M2e-HBc颗粒免疫后诱导M2e特异性抗体的产生,也不会影响所激发的免疫反应所带来的保护效力,这提示,即使是在抗HBc阳性的个体中,基于HBc的融合颗粒可能也能够诱导外源序列特异的保护性抗体,以及相应的保护作用,当然,相关的推测还有待临床实验的结果进行验证。虽然需要解决的问题还很多,但已经有两个基于 HBc的疫苗完成了Ⅰ期临床的研究,这无疑给其他的研究者带来很大鼓舞。
REFERENCES
[1]Pumpens P, Grens E.HBV core particles as a carrier for B cell/T cell epitopes.Intervirology, 2001, 44(2/3): 98−114.
[2]Pumpens P, Grens E.Hepatitis B core particles as a universal display model: a structure-function basis for development.FEBS Lett, 1999, 442(1): 1−6.
[3]Riedl P, Stober D, Oehninger C,et al.Priming Th1 immunity to viral core particles is facilitated by trace amounts of RNA bound to its arginine-rich domain.J Immunol, 2002, 168(10): 4951−4959.
[4]Broos K, Janssens ME, De Goeyse I,et al.Comparison of serum humoral responses induced by oral immunization with the hepatitis B virus core antigen and the cholera toxin B subunit.Clin Vaccine Immunol, 2008, 15(5):852−858.
[5]Lee KW, Tan WS.Recombinant hepatitis B virus core particles: association, dissociation and encapsidation of green fluorescent protein.J Virol Methods, 2008, 151(2):172−180.
[6]Wynne SA, Crowther RA, Leslie AG.The crystal structure of the human hepatitis B virus capsid.Mol Cell, 1999, 3(6):771−780.
[7]Crowther RA, Kiselev NA, Bottcher B,et al.Threedimensional structure of hepatitis B virus core particles determined by electron cryomicroscopy.Cell, 1994, 77(6):943−950.
[8]Roseman AM, Berriman JA, Wynne SA,et al.A structural model for maturation of the hepatitis B virus core.Proc Natl Acad Sci USA, 2005, 102(44): 15821−15826.
[9]Zlotnick A, Cheng N, Conway JF,et al.Dimorphism of hepatitis B virus capsids is strongly influenced by the C-terminus of the capsid protein.Biochemistry, 1996,35(23): 7412−7421.
[10]Jegerlehner A, Tissot A, Lechner F,et al.A molecular assembly system that renders antigens of choice highly repetitive for induction of protective B cell responses.Vaccine, 2002, 20(25/26): 3104−3112.
[11]Borisova GP, Kalis IaV, Pushko PM,et al.Genetically engineered mutants of the core antigen of the human hepatitis B virus preserving the ability for native self-assembly.Dokl Akad Nauk SSSR, 1988, 298(6):1474−1478.
[12]Gallina A, Bonelli F, Zentilin L,et al.A recombinant hepatitis B core antigen polypeptide with the protamine-like domain deleted self-assembles into capsid particles but fails to bind nucleic acids.J Virol, 1989,63(11): 4645−4652.
[13]Birnbaum F, Nassal M.Hepatitis B virus nucleocapsid assembly: primary structure requirements in the core protein.J Virol, 1990, 64(7): 3319−3330.
[14]Billaud J N, Peterson D, Barr M,et al.Combinatorial approach to hepadnavirus-like particle vaccine design.J Virol, 2005, 79(21): 13656−13666.
[15]De Filette M, Min JW, Birkett A,et al.Universal influenza A vaccine: optimization of M2-based constructs.Virology,2005, 337(1): 149−161.
[16]De Filette M, Fiers W, Martens W,et al.Improved design and intranasal delivery of an M2e-based human influenza A vaccine.Vaccine, 2006, 24(44/46): 6597−6601.
[17]Han JF, Wu YZ.HBcAg virus like particles and vaccine design.Immunol J, 2005, 21(3): 17−19.韩俊峰, 吴玉章.HBcAg病毒样颗粒与疫苗设计.免疫学杂志, 2005, 21(3): 17−19.
[18]Yin Y, Zhang J, Dong DY,et al.Chimeric hepatitis B virus core particles carrying an epitope of anthrax protective antigen induce protective immunity againstBacillus anthracis.Vaccine, 2008, 26: 5814−5821.
[19]Kratz PA, Bottcher B, Nassal M.Native display of complete foreign protein domains on the surface of hepatitis B virus capsids.Proc Natl Acad Sci USA, 1999,96(5): 1915−1920.
[20]Nassal M, Skamel C, Vogel M,et al.Development of hepatitis B virus capsids into a whole-chain protein antigen display platform: new particulate Lyme disease vaccines.Int J Med Microbiol, 2008, 298(1/2): 135−142.
[21]Zhang YL, Guo YJ, Wang KY,et al.Enhanced immunogenicity of modified hepatitis B virus core particle fused with multiepitopes of foot-and-mouth disease virus.Scand J Immunol, 2007, 65(4): 320−328.
[22]Karpenko LI, Ivanisenko VA, Pika IA,et al.Insertion of foreign epitopes in HBcAg: how to make the chimeric particle assemble.Amino Acids, 2000, 18(4): 329−337.
[23]Schotsaert M, De Filette M, Fiers W,et al.Universal M2 ectodomain-based influenza A vaccines: preclinical and clinical developments.Expert Rev Vaccines, 2009, 8(4):499−508.
[24]Neirynck S, Deroo T, Saelens X,et al.A universal influenza A vaccine based on the extracellular domain of the M2 protein.Nat Med, 1999, 5(10): 1157−1163.
[25]Fiers W, De Filette M, Birkett A,et al.A “universal”human influenza A vaccine.Virus Res, 2004, 103(1/2):173−176.
[26]Gregson AL, Oliveira G, Othoro C,et al.Phase I trial of an alhydrogel adjuvanted hepatitis B core virus-like particle containing epitopes ofPlasmodium falciparumcircumsporozoite protein.PLoS One, 2008, 3(2): e1556.
[27]Nardin EH, Oliveira GA, Calvo-Calle JM,et al.Phase I testing of a malaria vaccine composed of hepatitis B virus core particles expressingPlasmodiumfalciparumcircumsporozoite epitopes.Infect Immun, 2004, 72(11):6519−6527.
[28]Walther M, Dunachie S, Keating S,et al.Safety,immunogenicity and efficacy of a pre-erythrocytic malaria candidate vaccine, ICC-1132 formulated in Seppic ISA 720.Vaccine, 2005, 23(7): 857−864.
[29]Oliveira GA, Wetzel K, Calvo-Calle JM,et al.Safety and enhanced immunogenicity of a hepatitis B core particlePlasmodium falciparummalaria vaccine formulated in adjuvant Montanide ISA 720 in a phase I trial.Infect Immun, 2005, 73(6): 3587−3597.
[30]Zhang Y, Song S, Liu C,et al.Generation of chimeric HBc proteins with epitopes inE.coli: formation of virus-like particles and a potent inducer of antigen-specific cytotoxic immune response and anti-tumor effectin vivo.Cell Immunol, 2007, 247(1): 18−27.
[31]Song S, Wang Y, Zhang Y,et al.Augmented induction of CD8+ cytotoxic T-cell response and antitumor effect by DCs pulsed with virus-like particles packaging with CpG.Cancer Lett, 2007, 256(1): 90−100.
[32]Ma Y, Hayglass KT, Becker AB,et al.Novel cytokine peptide-based vaccines: an interleukin-4 vaccine suppresses airway allergic responses in mice.Allergy, 2007, 62(6):675−682.
[33]Huleatt JW, Nakaar V, Desai P,et al.Potent immunogenicity and efficacy of a universal influenza vaccine candidate comprising a recombinant fusion protein linking influenza M2e to the TLR5 ligand flagellin.Vaccine, 2008, 26(2): 201−214.
[34]De Filette M, Martens W, Smet A,et al.Universal influenza A M2e-HBc vaccine protects against disease even in the presence of pre-existing anti-HBc antibodies.Vaccine, 2008, 26(51): 6503−6507.
Hepatitis B virus core protein as an epitope vaccine carrier:a review
Ying Yin, Junjie Xu, and Wei Chen
State Key Laboratory of Pathogen and Biosecurity, Institute of Microbiology and Epidemiology, Beijing 100071, China
